修回日期: 2009-11-04
接受日期: 2009-11-09
在线出版日期: 2009-12-18
目的: 探讨选择性COX-2抑制剂celecoxib抑制不表达COX-2的胃癌细胞MGC-803生长的机制.
方法: 采用MTT法研究celecoxib对细胞存活率的影响;流式细胞术检测celecoxib处理后细胞DNA含量的变化, 免疫组织化学方法检测Bax及Bcl-2的表达, Elisa法检测VEGF蛋白表达水平, Western blot法检测COX-2及NF-κB蛋白的表达.
结果: MGC-803中未检测到COX-2的表达;选择性COX-2抑制剂celecoxib呈浓度和时间依赖性抑制MGC-803细胞生长(r = 0.985, P<0.05), 流式细胞仪检测DNA图谱上表现为G0/G1期前出现一个代表凋亡细胞的亚G1峰. Bax及Bcl-2无表达, celecoxib对细胞分泌VEGF(r = 0.928, P<0.01)及NF-κB蛋白均有抑制作用, 并且NF-κB蛋白的表达和celecoxib呈浓度和时间依赖性(r = 1).
结论: celecoxib可诱导不表达COX-2的胃癌细胞MGC-803凋亡, 可能通过抑制IKKβ-NF-κB信号通路影响MGC-803细胞的凋亡, 而不依赖COX-2途径.
引文著录: 王云峰, 李健, 葛成华, 王世伟, 张建军, 夏强, 郭克建. 塞来昔布对不表达环氧合酶-2的胃癌细胞生长的影响. 世界华人消化杂志 2009; 17(35): 3583-3589
Revised: November 4, 2009
Accepted: November 9, 2009
Published online: December 18, 2009
AIM: To investigate whether celecoxib, a selective cyclooxygenase-2 (COX-2) inhibitor, can induce the apoptosis of human gastric cancer MGC-803 cells not expressing COX-2 and explore potential mechanisms involved.
METHODS: Cell proliferation was measured by methyl thiazolyl tetrazolium (MTT) assay. Cell cycle distribution was measured by flow cytometry. The expression of Bax and Bcl-2 proteins was detected by immunohistochemistry. The secretion of vascular endothelial growth factor (VEGF) protein was detected by enzyme-linked immunosorbant assay (ELISA). The expression of COX-2 and nuclear factor-κB (NF-κB) proteins was examined by Western blot.
RESULTS: The expression of COX-2 protein was not detected in MGC-803 cells. Celecoxib could inhibit the proliferation and induce the apoptosis of MGC-803 cells in a dose- and time-dependent manner. The reduced rates of growth in cells treated with celecoxib at concentrations of 25, 50, 75 and 100 μmol/L for 24 h were 48.4%, 54.9%, 58.69% and 63.80%, respectively. Flow cytometry analysis showed that the apoptotic rate of MGC-803 cells treated with celecoxib was 4%, and a sub-G1 cell peak was present. Celecoxib inhibited the secretion of VEGF protein in MGC-803 cells. With the prolongation of the duration of incubation with celecoxib, the level of secreted VEGF decreased. Celecoxib could also inhibit the secretion of NF-κB protein by inhibiting its expression in a time-dependent manner.
CONCLUSION: Celecoxib inhibits growth and induces apoptosis of MGC-803 cells in a COX-2-independent manner. Celecoxib exerts its antitumor effects possibly by inhibiting the expression of NF-κB protein.
- Citation: Wang YF, Li J, Ge CH, Wang SW, Zhang JJ, Xia Q, Guo KJ. Celecoxib inhibits the growth of gastric cancer cells not expressing COX-2 in vitro. Shijie Huaren Xiaohua Zazhi 2009; 17(35): 3583-3589
- URL: https://www.wjgnet.com/1009-3079/full/v17/i35/3583.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i35.3583
大量研究表明, 环氧化酶-2(cyclooxygenas 2, COX-2)抑制剂能有效预防肿瘤发生. 其机制主要是诱导细胞凋亡、调控细胞周期、影响肿瘤新生血管生成等. 这种作用与非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)作用的靶点-前腺素(PG)合成限速酶COX-2有关[2]. 我们的研究发现, 选择性COX-2抑制剂celecoxib(塞来昔布)可诱导不表达COX-2的胃癌细胞MGC-803凋亡. 进一步的研究发现癌细胞与正常组织的COX-2表达并无显著差异, 我们推测celecoxib诱导不表达COX-2的胃癌细胞MGC-803凋亡的作用不是通过COX-2起作用,可能存在其他作用途径. 因此, 本研究拟通过体外的细胞株研究celecoxib是否诱导不表达COX-2的胃癌细胞的凋亡, 试图从另一侧面探讨celecoxib诱导胃癌细胞凋亡的机制.
RPMI 1640培养基, 小牛血清购自美国Invitrogen公司; MTT, DMSO购自Sigma公司; celecoxib由辉瑞制药有限公司提供; BCA蛋白定量试剂盒购自北京博奥森生物技术公司; 人的 VEGF ELISA试剂盒购自武汉博士德生物工程有限公司;抗COX-2一抗及抗兔二抗购自美国Santa Cruz公司; 核转录因子-κB(NF-κB)mAb购自美国Santa Cruz公司; 胰蛋白酶、NF-κB二抗、增强化学发光试剂盒(ECL)购自北京中山公司; 其余试剂均为国产分析纯试剂; 人胃癌细胞系MGC-803购自中科院上海细胞所.
1.2.1 COX-2在胃癌细胞株中表达的检测: 采用免疫印迹实验(Western blot)检测COX-2在胃癌细胞株中的表达. 取对数生长期细胞(约109-1010 cells/L), 用冰PBS液洗涤2次, 加入裂解缓冲液(50 mmol/L Tris-HCl, 150 mmol/L NaCl, 0.2 g/L NaN3, 1 g/L SDS, 1.0 mmol/L PMSF, 0.2 g/L aprotinin, 1.0 g/L NP40, 5.0 g/L脱氧胆酸钠, pH8.0)混匀, 冰浴30 min. 收集细胞裂解液4 ℃, 12 000 g离心5 min, 吸取上清, BCA法蛋白定量后, 调整蛋白量进行SDS-PAGE电泳并将蛋白转移到PVDF膜上. 用PBST洗膜3次, 每次5 min. 室温下用含50 g/L脱脂奶粉(PBST溶解)封闭PVDF膜1 h或过夜. 随后加入适当稀释的一抗(抗COX-2抗体, 美国Santa Cruz公司; β-actin抗体, NewMarker公司)室温温育1 h. 用PBST洗脱3次后加入相应的适当稀释的二抗(抗兔二抗, 美国Santa Cruz公司), 温育1 h. PBST洗脱3次后曝光、显影, 凝胶成像系统扫描分析结果.
1.2.2 celecoxib对胃癌细胞生长的影响: (1)细胞存活率测定(MTT法): 收集对数期生长的MGC-803细胞, 调整细胞悬液浓度, 分于96孔板, 每孔100 μL, 5000-6000个/孔. 置37 ℃、50 mL/L CO2温箱培养使细胞贴壁, 培养24 h. 加入两种不同浓度药物样品各200 μL(50和100 μmol/L, 溶剂为含175 mL/L乙醇的RPMI 1640), 分别继续培养至12、24、48、72 h. 小心吸去上清, 加入80 μL新鲜RPMI 1640培养液, 于结束前4 h加入20 μL MTT溶液(5 g/L). 然后吸掉上清, 每孔加入150 μL二甲基亚砜, 置摇床上低速振荡10 min, 使结晶物充分溶解. 在酶联免疫检测仪490 nm处测量各孔的吸光值. 同时设置空白孔(含175 mL/L乙醇的RPMI 1640、MTT、二甲基亚砜), 对照孔(细胞、含175 mL/L乙醇的RPMI 1640、MTT、二甲基亚砜), 每组设定3复孔. 计算抑制率 = [(对照-空白)-(给药-空白)]/(对照-空白)×100%. (2)流式细胞仪分析: 取50 μmol/L celecoxib与胃癌细胞作用24 h后的细胞(1×109 cells/L), 用PBS洗涤2次, 离心后以4 ℃的700 mL/L乙醇固定过夜. 测定前离心洗去乙醇, 加碘化丙啶染液(含50 mg/L PI, 10 mg/L RNase A)避光染色30 min. 以流式细胞仪进样测定.
1.2.3 Bax、Bcl-2免疫组织化学染色: 取50 μmol/L celecoxib作用48 h后的对数生长期细胞进行免疫组织化学染色, 同时用PBS代替一抗作为阴性对照, 用已知的阳性反应组织作阳性对照. 结果判定标准: 凡细胞质中出现明显的棕黄色颗粒为Bcl-2、Bax蛋白阳性细胞. 每片观察5个高倍视野, 不少于500个细胞, 肿瘤细胞染色阳性率在0%记0分, 1%-5%记l分, 5%-30%记2分, 30%-60%记分, >60%记为4分.
1.2.4 NF-κB蛋白在胃癌细胞株中表达的检测: 取celecoxib(50及100 μmol/L)作用24及48 h的对数生长期的细胞用PBS洗涤2次, 加入裂解缓冲液(50 mmol/L Tris-HCl, 150 mmol/L NaCl, 0.2 g/L aprotinin, 1.0 g/L NP40, 5.0 g/L脱氧胆酸纳)混匀, 冰浴30 min. 收集细胞裂解液4 ℃, 离心5 min, 吸取上清, BCA法蛋白定量后, 调整蛋白量为35 μg进行SDS-PAGE电泳. 并将蛋白转移到PVDF膜上. 用PBST洗膜3次, 每次5 min. 室温下用含50 g/L脱脂奶粉(PBST溶解)封闭PVDF膜1 h或过夜. 随后加入适当稀释的一抗(抗NF-κB抗体, 碧云天生物技术研究所; β-actin抗体, New Marker公司)室温温育1 h. 用PBST洗脱3次后加入相应的适当稀释的二抗(抗兔二抗, 碧云天生物技术研究所), 温育1 h. PBST洗脱3次后曝光、显影,凝胶成像系统扫描分析结果.
1.2.5 VEGF蛋白表达的检测: 按Elisa试剂盒建立VEGF蛋白标准曲线, 取对数生长期的细胞, 按1×109 cells/L的浓度, 每孔500 μL培养基分别加入到48孔板中, 24 h细胞贴壁后分别加药(50 μmol/L celecoxib): 细胞对照组、celecoxib(50 μmol/L)处理组, 12, 24, 36, 48, 60, 72, 84, 96 h后收集上层培养基, 每个时间设3个, 离心后上清转入tube管中备用, 将备好的培养基加入已平衡至室温板条的相应孔中(每孔100 μL). 37 ℃孵箱孵育120 min, 取出板充分洗涤5次, 向滤纸上印干后每孔加入一抗工作液50 μL, 充分混匀, 37 ℃孵箱孵育60 min, 洗板5次, 干后每孔加入酶标抗体工作液100 μL, 37 ℃孵箱孵育60 min, 洗板5次, 加入底物工作液每孔100 μL, 37 ℃孵箱暗处反应10 min, 每孔加入终止液1滴, 混匀后即刻测量A492nm值, 减去空白孔A值, 得各标本的A值.
统计学处理 实验数据以mean±SD表示, 采用组间t检验进行统计学处理, 及应用SPSS13统计软件进行方差分析及直线回归与相关性的分析.
免疫印迹实验(Western blot)结果显示, 在MGC-803胃癌细胞中未检到COX-2表达.
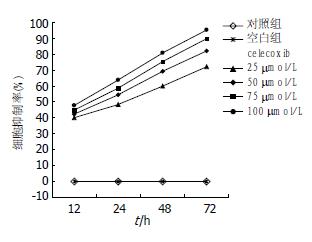
采用MTT法检测发现不同浓度celecoxib处理MGC-803细胞不同时间后, MGC-803细胞的存活率随celecoxib剂量增加和时间延长而降低(图1). 在药物与细胞孵育12 h时, 已有大量细胞发生凋亡现象. 对照组的不同时间的A值之间无差异(P>0.05), 说明细胞正常生长无影响. 不同剂量组之间的A值有差异(P<0.05), 不同时间A值之间也有差异(P<0.05, 表1). 抑制率和celecoxib的作用时间及剂量有直线相关关系, 呈正相关关系(r = 0.985, P<0.05, 表2).
| 分组 | 12 h | 24 h | 48 h | 72 h |
| 对照组 | 1.033±0.079 | 1.032±0.079 | 1.086±0.159 | 1.086±0.159 |
| 空白组 | 0.220±0.003 | 0.202±0.008 | 0.165±0.008 | 0.161±0.004 |
| celecoxib(μmol/L) | ||||
| 25 | 0.707±0.009 | 0.631±0.007 | 0.526±0.006 | 0.419±0.013 |
| 50 | 0.689±0.011 | 0.577±0.009 | 0.449±0.001 | 0.327±0.003 |
| 75 | 0.669±0.003 | 0.546±0.007 | 0.393±0.002 | 0.257±0.009 |
| 100 | 0.639±0.009 | 0.503±0.009 | 0.342±0.007 | 0.206±0.006 |
| 12 h | 24 h | 48 h | 72 h | |
| 25 μmol/L | 40.25±1.04 | 48.40±1.09 | 60.87±1.07 | 72.12±1.12 |
| 50 μmol/L | 42.42±1.12 | 54.90±1.10 | 69.20±1.11 | 82.10±1.62 |
| 75 μmol/L | 44.84±1.08 | 58.69±1.03 | 75.26±1.06 | 89.74±2.08 |
| 100 μmol/L | 47.79±1.18 | 63.80±1.11 | 80.80±1.15 | 95.20±2.41 |
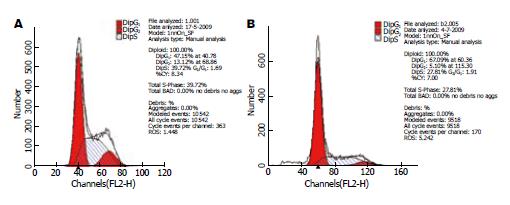
celecoxib能够诱导MGC-803细胞发生凋亡, DNA图谱上表现为G0/G1期前出现一个代表凋亡细胞的亚G1峰. 同正常细胞对比可见G0/G1期细胞比例逐渐增加, S期和G2/M期细胞比例降低(图2).
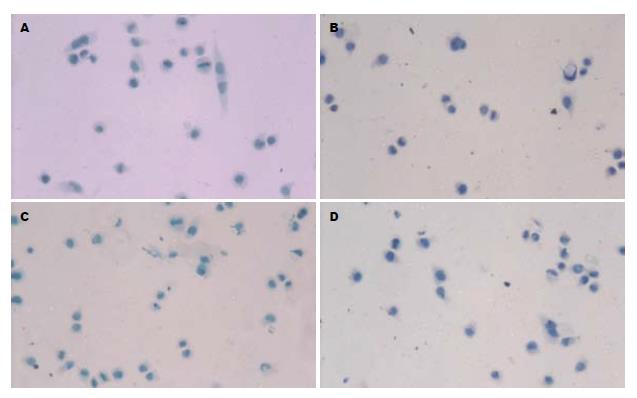
Bcl-2阳性染色主要弥漫性分布于胃癌组织细胞质中, 癌旁组织中也可见少量的表达. Bcl-2蛋白免疫组织化学染色评分为: 48 h对照组0分, 50 µmol/L celecoxib作用48 h组0分, 与对照组比较无统计学意义, Bax阳性反应物位于胞质和胞膜, 呈棕黄色颗粒, Bax蛋白免疫组织化学染色评分为: 48 h对照组0分, 50 µmol/L celecoxib作用48 h组0分, 与对照组比较无统计学意义(图3).
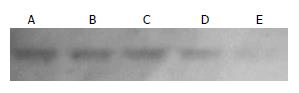
celecoxib对MGC-803细胞分泌NF-κB蛋白有抑制作用, 并且和celecoxib呈浓度和时间相关性(r = 1, 图4).
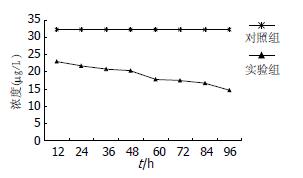
celecoxib对MGC-803细胞分泌VEGF蛋白有抑制作用, 并且和celecoxib呈时间相关性(r = 0.928, P<0.01, 图5).
NSAIDS对消化系肿瘤具有防治作用已有大量的事实, 但其抗癌作用的机制仍不明确, 有研究认为可能与抑制COX这一前列腺素类物质合成的酶, 使前列腺素类物质生成减少有关, 即COX依赖性途径[1-2]. 近来人们发现, NSAIDs也可以在完全缺乏COX活性的细胞发挥抗增殖作用, 故推测可能通过其他途径也可诱导细胞凋亡. 本实验应用MTT方法检测了celecoxib对胃癌MGC-803细胞的生长抑制作用. 结果表明, 随着药物浓度的增加和时间的延长, 细胞存活率逐渐降低, DNA图谱上表现为在G0/G1期前出现一个代表凋亡细胞的亚G1峰. 同正常细胞对比可见G0/G1期细胞比例逐渐增加, S期和G2/M期细胞比例降低. 但是, COX-2蛋白的含量在MGC-803细胞未检测到. Yu et al[3]的研究报道与我们的研究一致, 进一步说明celecoxib抑制细胞生长存在其他途径. 可能是通过COX-2非依赖性途径起作用. 有人报道COX-2非依赖性机制可能与如下途径有关: (1)抑制PPARδ, 诱导肿瘤细胞的凋亡[4], 或激活PPARγ抑制肿瘤细胞的生长[5]; (2)抑制IKKβ-NF-κB信号通路[6-7]; (3)抑制Akt信号通路[8].
本研究中我们通过免疫组织化学方法定性检测Bax及Bcl-2均未见表达, Bcl-2家族的表达和调控是影响细胞凋亡的关键因素. Bcl-2和Bax分别是Bcl-2家族中最有代表性的抑亡和促进凋亡基因, 并且Bax是Bcl-2活性的主要调节子[9]. 近年来研究表明Bcl-2和Bax调节细胞凋亡, 取决于自身表达的高低, 还与Bax/Bcl-2的比率有关[10-11]. Bcl-2水平高于Bax时, Bcl-2和Bcl-2形成同源二聚体, 细胞凋亡受抑制; Bax表达高于Bcl-2时, 则形成Bax和Bax同源二聚体, 细胞凋亡增强; 而Bcl-2和Bax水平相当时, 形成Bcl-2Bax二聚体, 细胞凋亡终止. 我们的研究表明, celecoxib诱导不表达COX-2的胃癌MGC-803细胞凋亡发生可能与Bcl-2及Bax无关. 唐保东 et al[12]的研究与我们的研究结果一致.
本组实验中, 我们研究发现celecoxib对细胞分泌血管内皮生长因子(vascular endothelial growth factor, VEGF)及NF-κB蛋白均有抑制作用, 并且和celecoxib呈浓度和时间依赖性. VEGF家族有较强的促进新生血管和淋巴管形成作用, 参与病理性、生理性淋巴管和血管新生. 许多因素可调节VEGF的表达, 缺氧及HIF、细胞因子(包括PDGF、bFGF、胰岛素样生长因子、角化细胞生长因子、表皮生长因子、 TNF-α、TGF、IL-1、IL-6)、细胞内介质(包括AP-1转录因子、Ras蛋白和酪氨酸蛋白激酶、VHL、COX-2等)、类固醇激素等均对VEGF的调控产生影响[13-15]. 在某些消化道肿瘤中COX-2表达与VEGF呈正相关, 提示COX-2可能通过诱导VEGF表达上调促进肿瘤生长, UefujiK et al[16]认为COX-2可能产生前列腺素E2, 通过EP受体/cAMP途径来调节肿瘤中VEGF基因转录表达[17]. 本实验中检测celecoxib可抑制MGC-803细胞分泌VEGF, 机制可能通过COX-2非依赖性途径起作用, 具体机制需要进一步深入研究.
NF-κB是一种重要的转录因子蛋白, 研究表明NF-κB除了具有调节炎症、免疫反应相关基因转录作用外, 还可以调节细胞增殖, NF-κB几乎存在于所有细胞,与p50/p65结合形成二聚体[18-19]. 静息状态时, p65与κB抑制蛋白(inhibitory kappaB, IκB)结合, 以非活性状态存在于细胞质中,不具有调节基因转录的能力. 当细胞受到内毒素、病毒蛋白、致癌物等细胞外信号刺激时,蛋白激酶被激活, IκB磷酸化并降解, 从而释放NF-κB二聚体, 使其得以转位进入细胞核中, 与靶基因启动子区域中特定的DNA序列结合, 诱导抗凋亡基因和促生长基因等靶基因的转录[20-21]. 我们的研究发现MGC-803细胞株表达NF-κB活性. 用不同药物浓度的celecoxib处理MGC-803细胞后, Western blot检测结果显示NF-κB蛋白表达较处理前明显降低, 并且和celecoxib呈浓度和时间依赖性. 表明celecoxib可抑制MGC-803细胞NF-κB蛋白的表达, 提示celecoxib可通过抑制NF-κB蛋白的表达, 进而抑制IKKβ-NF-κB信号通路而发挥抗肿瘤作用. Dai et al[21]研究指出胃癌组织中NF-κB蛋白表达与VEGF蛋白表达之间存在正相关关系, 提示在胃癌组织中NF-κB的活化对VEGF的表达具有正向的调节作用. Choi et al[22]实验发现, 用NF-κB反义核苷酸抑制TNF-α诱导的血管生成的同时, 能下调TNF-α介导的bFGF和VEGF的表达, 从而提示NF-κB对VEGF的活性确有潜在的正向调节作用. 这或许是肿瘤细胞中VEGF分泌异常增加的启动机制之一, 也为NF-κB对胃癌发生发展的多向调节作用提供了有力佐证. Starenki et al[23]研究认为NF-κB可通过诱导和上调Bcl-2家族蛋白发挥抑制凋亡作用. Bcl-2启动子上存在NF-κB的特异性结合位点, NF-κB可通过转录途径直接上调Bcl-2表达, 同时还可通过TNF-α、p21WAF1[24]等其他途径促进Bcl-2表达. 在肿瘤细胞中由于NF-κB的活化可以激活含有κB的Bcl-2及Bcl-XL编码基因的转录表达, 而对无κB位点的Bax和Bad基因则无此作用, 这就可能使得两类不同功能的蛋白表达量失衡, 从而增强肿瘤细胞的抗凋亡性. 抑制NF-κB活性可抑制Bcl-2的表达, 进而诱导肿瘤细胞凋亡[25].
我们的研究结果提示celecoxib可抑制MGC-803细胞的生长, 并可抑制NF-κB及VEGF蛋白的表达, 此可能为celecoxib抑制肿瘤细胞增殖, 促进细胞凋亡, 抑制肿瘤新生血管形成以及预防肿瘤发生等抗肿瘤作用的一种机制.
COX-2在恶性肿瘤的发生发展过程中起重要作用, COX-2可能成为化学预防和化学辅助治疗恶性肿瘤的新靶点. 塞来昔布(celecoxib)是一种选择性COX-2抑制剂, 可抑制多种肿瘤细胞增殖, 促进细胞凋亡, 他的上述作用机制尚未完全阐明, 可能存在不依赖COX-2的机制.
傅春彬, 主任医师, 吉化集团公司总医院一院消化内科.
塞来昔布作为选择性COX-2抑制剂抗肿瘤药, 已成为近年恶性肿瘤化学预防和治疗的研究热点.
Yu et al报道celecoxib诱导不表达环氧合酶-2的胃癌MGC-803细胞凋亡发生可能与Bcl-2及Bax无关. Ghosh et al报道可能存在COX-2非依赖性机制. Narayanan et al发现celecoxib能抑制模型动物肿瘤生长, 其作用机制是通过抑制NF-κB和COX-2活性表达而实现.
本文具有科学性、创新性和可读性, 能较好地反映我国胃癌基础研究的先进水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Liu Z, Wang X, Lu Y, Han S, Zhang F, Zhai H, Lei T, Liang J, Wang J, Wu K. Expression of 15-PGDH is downregulated by COX-2 in gastric cancer. Carcinogenesis. 2008;29:1219-1227. [PubMed] [DOI] |
| 2. | Bastos-Pereira AL, Lugarini D, de Oliveira-Christoff A, Avila TV, Teixeira S, Pires AD, Muscará MN, Cadena SM, Donatti L, da Silva de Assis HC. Celecoxib prevents tumor growth in an animal model by a COX-2 independent mechanism. Cancer Chemother Pharmacol. 2009; Jun 9. [Epub ahead of print]. [PubMed] |
| 3. | Yu J, Tang BD, Leung WK, To KF, Bai AH, Zeng ZR, Ma PK, Go MY, Hu PJ, Sung JJ. Different cell kinetic changes in rat stomach cancer after treatment with celecoxib or indomethacin: implications on chemoprevention. World J Gastroenterol. 2005;11:41-45. [PubMed] |
| 4. | Ghosh M, Ai Y, Narko K, Wang Z, Peters JM, Hla T. PPARdelta is pro-tumorigenic in a mouse model of COX-2-induced mammary cancer. Prostaglandins Other Lipid Mediat. 2009;88:97-100. [PubMed] [DOI] |
| 5. | Hazra S, Peebles KA, Sharma S, Mao JT, Dubinett SM. The Role of PPARgamma in the Cyclooxygenase Pathway in Lung Cancer. PPAR Res. 2008;2008:790568. [PubMed] |
| 6. | Ding J, Wu K, Zhang D, Luo W, Li J, Ouyang W, Song L, Huang C. Activation of both nuclear factor of activated T cells and inhibitor of nuclear factor-kappa B kinase beta-subunit-/nuclear factor-kappa B is critical for cyclooxygenase-2 induction by benzo[a]pyrene in human bronchial epithelial cells. Cancer Sci. 2007;98:1323-1329. [PubMed] [DOI] |
| 7. | Ouyang W, Ma Q, Li J, Zhang D, Ding J, Huang Y, Xing MM, Huang C. Benzo[a]pyrene diol-epoxide (B[a]PDE) upregulates COX-2 expression through MAPKs/AP-1 and IKKbeta/NF-kappaB in mouse epidermal Cl41 cells. Mol Carcinog. 2007;46:32-41. [PubMed] [DOI] |
| 8. | Fu Y, Zhang Q, Kang C, Zhang K, Zhang J, Pu P, Wang G, Wang T. Inhibitory effects of adenovirus mediated COX-2, Akt1 and PIK3R1 shRNA on the growth of malignant tumor cells in vitro and in vivo. Int J Oncol. 2009;35:583-591. [PubMed] |
| 9. | Panasiuk A, Dzieciol J, Panasiuk B, Prokopowicz D. Expression of p53, Bax and Bcl-2 proteins in hepatocytes in non-alcoholic fatty liver disease. World J Gastroenterol. 2006;12:6198-6202. [PubMed] |
| 10. | Zaldivar V, Magri ML, Zárate S, Jaita G, Eijo G, Radl D, Ferraris J, Pisera D, Seilicovich A. Estradiol increases the Bax/Bcl-2 ratio and induces apoptosis in the anterior pituitary gland. Neuroendocrinology. 2009;90:292-300. [PubMed] [DOI] |
| 11. | Mao JD, Wu P, Xia XH, Hu JQ, Huang WB, Xu GQ. Correlation between expression of gastrin, somatostatin and cell apoptosis regulation gene bcl-2/bax in large intestine carcinoma. World J Gastroenterol. 2005;11:721-725. [PubMed] |
| 12. | 唐 保东, 曾 志荣, 胡 品津. 塞来昔布对MNNG诱导的大鼠胃腺癌组织Bax、Bcl-2、Fas表达的影响. 中山大学学报(医学科学版). 2007;28:16-19. |
| 13. | Athar M, Back JH, Kopelovich L, Bickers DR, Kim AL. Multiple molecular targets of resveratrol: Anti-carcinogenic mechanisms. Arch Biochem Biophys. 2009;486:95-102. [PubMed] [DOI] |
| 14. | Chen HX, Cleck JN. Adverse effects of anticancer agents that target the VEGF pathway. Nat Rev Clin Oncol. 2009;6:465-477. [PubMed] [DOI] |
| 15. | Toomey DP, Murphy JF, Conlon KC. COX-2, VEGF and tumour angiogenesis. Surgeon. 2009;7:174-180. [PubMed] [DOI] |
| 16. | Uefuji K, Ichikura T, Mochizuki H. Increased expression of interleukin-1alpha and cyclooxygenase-2 in human gastric cancer: a possible role in tumor progression. Anticancer Res. 2005;25:3225-3230. [PubMed] [DOI] |
| 17. | Lee CH, Jeon YT, Kim SH, Song YS. NF-kappaB as a potential molecular target for cancer therapy. Biofactors. 2007;29:19-35. [PubMed] [DOI] |
| 18. | Qiu J, Wang X, Guo X, Zhao C, Wu X, Zhang Y. Toll-like receptor 9 agonist inhibits ERalpha-mediated transactivation by activating NF-kappaB in breast cancer cell lines. Oncol Rep. 2009;22:935-941. [PubMed] [DOI] |
| 19. | Piva R, Penolazzi L, Borgatti M, Lampronti I, Lambertini E, Torreggiani E, Gambari R. Apoptosis of human primary osteoclasts treated with molecules targeting nuclear factor-kappaB. Ann N Y Acad Sci. 2009;1171:448-456. [PubMed] [DOI] |
| 20. | Tsang TY, Tang WY, Tsang WP, Co NN, Kong SK, Kwok TT. Mechanistic study on growth suppression and apoptosis induction by targeting hepatoma-derived growth factor in human hepatocellular carcinoma HepG2 cells. Cell Physiol Biochem. 2009;24:253-262. [PubMed] [DOI] |
| 21. | Dai L, Gu L, Ding C, Qiu L, Di W. TWEAK promotes ovarian cancer cell metastasis via NF-kappaB pathway activation and VEGF expression. Cancer Lett. 2009;283:159-167. [PubMed] [DOI] |
| 22. | Choi IK, Shin HJ, Lee HS, Kwon HJ. Streptochlorin, a marine natural product, inhibits NF-kappaB activation and suppresses angiogenesis in vitro. J Microbiol Biotechnol. 2007;17:1338-1343. [PubMed] |
| 23. | Starenki DV, Namba H, Saenko VA, Ohtsuru A, Maeda S, Umezawa K, Yamashita S. Induction of thyroid cancer cell apoptosis by a novel nuclear factor kappaB inhibitor, dehydroxymethylepoxyquinomicin. Clin Cancer Res. 2004;10:6821-6829. [PubMed] [DOI] |
| 24. | Akita K, Kawata S, Shimotohno K. p21WAF1 modulates NF-kappaB signaling and induces anti-apoptotic protein Bcl-2 in Tax-expressing rat fibroblast. Virology. 2005;332:249-257. [PubMed] [DOI] |
| 25. | Fahy BN, Schlieman MG, Mortenson MM, Virudachalam S, Bold RJ. Targeting BCL-2 overexpression in various human malignancies through NF-kappaB inhibition by the proteasome inhibitor bortezomib. Cancer Chemother Pharmacol. 2005;56:46-54. [PubMed] [DOI] |