修回日期: 2009-11-14
接受日期: 2009-11-16
在线出版日期: 2009-12-08
目的: 探讨不同浓度曲古菌素A对食管癌细胞系EC1细胞增殖、细胞周期的影响及其对细胞周期调控基因p21WAF1/CIP1表达的影响.
方法: 用0.3, 0.5, 1.0 μmol/L的TSA处理EC1细胞, MTT检测TSA作用24、48 h对EC1细胞的抑制作用, 流式细胞仪检测0.3, 0.5, 1.0 μmol/L的TSA作用24 h后EC1细胞周期的改变, Western blot法检测p21WAF1/CIP1变化.
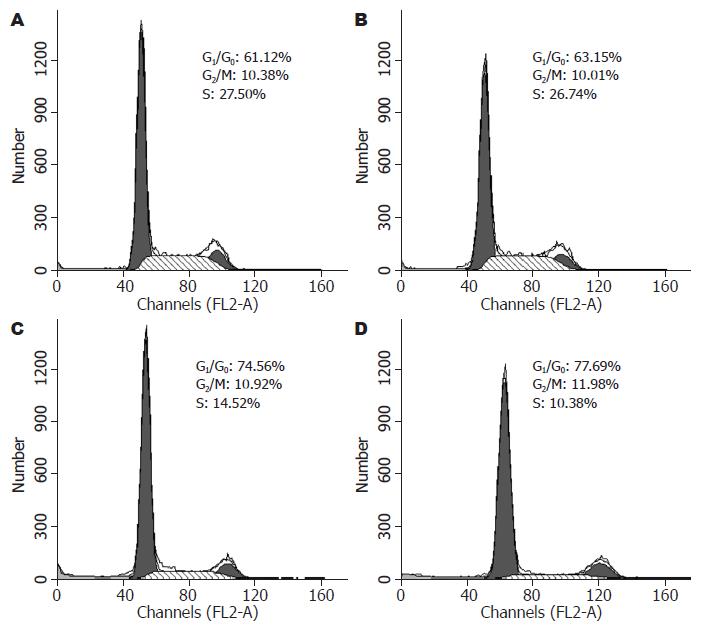
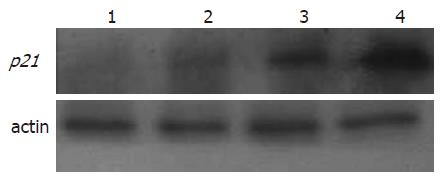
结果: TSA在0.5 μmol/L以上时对EC1细胞有抑制作用; 0.3 μmol/L TSA处理细胞后细胞周期与对照组相比, 无明显变化; 0.5 μmol/L TSA处理EC1细胞后, G0/G1期细胞较对照组明显增加, S期细胞较对照组明显减少(74.56% ±1.34% vs 62.12%±0.52%; 14.52%±1.81% vs 27.50%±0.66%, 均P<0.05); 0.5, 1.0 μmol/L TSA处理细胞后p21WAF1/CIP1表达明显增加(均P<0.05).
结论: 一定浓度的TSA对人食管癌细胞EC具有的增殖抑制作用, 引起EC1细胞发生G0/G1期阻滞, 其部分机制与p21WAF1/CIP1上调有关.
引文著录: 马俊芬, 江亚南, 赵继敏, 黄幼田, 赵明耀, 董子明. 曲古菌素A对食管癌EC1细胞增殖和细胞周期的影响及其分子机制. 世界华人消化杂志 2009; 17(34): 3534-3537
Revised: November 14, 2009
Accepted: November 16, 2009
Published online: December 8, 2009
AIM: To investigate the effects of trichostatin A (TSA) on cell proliferation and cell cycle progression in esophageal carcinoma cell line EC1, and explore potential mechanisms involved.
METHODS: EC1 cells in logarithmic growth phase were incubated with TSA at concentrations of 0.3, 0.5 and 1.0 μmol/L for 24 and 48 hours, respectively. The proliferation of EC1 cells was measured by methyl thiazolyl tetrazolium (MTT) assay. The effects of TSA on cell cycle distribution was detected by flow cytometry (FCM). The expression of p21WAF1/CIP1 was investigated by Western blot.
RESULTS: TSA at concentrations of 0.5 and 1.0 μmol/L inhibited the growth of EC1 cells. In comparison with the control group, the percentage of cells in G0/G1 phase increased, while the percentage of cells in S phase decreased (74.56% ± 1.34% vs 62.12 ± 0.52 and 14.52% ± 1.81% vs 27.50 ± 0.66, respectively; both P < 0.05) in EC1 cells treated with TSA at a concentration of 0.5 μmol/L. TSA induced G0/G1 phase arrest in a dose-dependent manner. Western blot analysis indicated that the expression of p21WAF1/CIP1 was upregulated in EC1 cells treated with TSA at concentrations of 0.5 or 1.0 μmol/L TSA for 24 hours (both P < 0.05).
CONCLUSION: TSA is able to inhibit cell proliferation and induce G0/G1 arrest in human esophageal carcinoma cell line EC1 partly through upregulation of the p21WAF1/CIP1.
- Citation: Ma JF, Jiang YN, Zhao JM, Huang YT, Zhao MY, Dong ZM. Trichostatin A inhibits cell proliferation and induces cell cycle arrest in human esophageal carcinoma cell line EC1. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3534-3537
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3534.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3534
食管癌是一种常见的消化系恶性肿瘤, 发病分布具有鲜明的地理区域特点, 高发地区为包括我国北部、中部在内的"亚洲食管癌高发带". 近年来, 以外科手术为主, 辅以术前或术后放、化疗的综合治疗模式已成为是食管癌治疗的标准模式. 然而, 目前食管癌诊疗的整体形势仍不容乐观, 我国食管癌术后5年生存率仅30%. 因此, 探索和开发新型的更为有效的诊疗技术和手段也成为医学工作者和药物企业共同的重要目标. 曲古菌素A(trichostatin A, TSA)源自链霉菌代谢产物, 是一种抗真菌药物使用, 同时也是强大的组蛋白去乙酰酶(histone deacetylase inhibitor, HDAC)抑制剂, 是目前广泛使用的HDAC之一, 其生物学效应主要包括诱导细胞凋亡, 阻滞细胞周期, 和诱导肿瘤细胞分化[1]. 但是, 不同结构的HDAC抑制剂对不同的细胞系的作用机制不同, 即使同一种细胞对不同的HDAC抑制剂的反应也不相同[2-4]. 人食管癌细胞系EC1为低分化鳞癌, 目前, 在国内外TSA对EC1细胞研究甚少, TSA对EC1细胞增殖、细胞周期的影响尚未见报道. 本文主要探讨TSA对食管癌EC1细胞增殖和细胞周期的影响以及对细胞周期调控基因p21WAF1/CIP1的影响.
RPMI 1640(美国Gibco公司), 胎牛血清(天津TBD生物有限公司), Trichostatin A(美国Sigma公司)溶解于二甲基亚砜, 配成2.5 mmol/L的贮存液. 二甲基亚砜DMSO(美国Sigma公司),细胞周期试剂盒(美国BD公司), 碘化吡啶PI(美国Sigma公司), p21WAF1/CIP1鼠抗人单抗(美国Santa Cruz), RPMI 1640培养液(美国Gibco公司产品), 食管鳞癌EC1细胞由本室保存.
1.2.1 MTT检测TSA对EC1的抑制率: 食管鳞癌细胞EC1在含100 mL/L的胎牛血清1640完全培养基培养至对数生长期, 消化接种于96孔板, 接种细胞数每孔约5×103个, 将96孔板放于37 ℃、50 mL/L CO2培养箱中培养24 h, 随机分成TSA处理组和空白对照组. TSA处理组分为含0.3, 0.5, 1.0 μmol/L TSA, 对照组换为等浓度的DMSO, 同时设仅加培养基的阴性对照组和空白组, 每组设5个复孔, 在培养24和48 h后, 加入20 μL 5 g/L的MTT溶液, 继续培养4 h准备收集细胞, 吸去上清, 加入200 μL DMSO, 室温下振荡10 min使紫色结晶全部溶解, 在96孔酶标仪上以空白对照孔调零、570 nm处读取吸光度值A570. 并按下面公式计算不同浓度的TSA对EC1细胞的增殖活力的抑制, 细胞存活率 = (实验孔平均A值/对照孔平均A值)×100%.
1.2.2 流式细胞仪检测周期: 将各组细胞用0.05%胰蛋白酶消化, 2000 r/min离心8 min, 弃去上清; 用PBS洗2遍, 离心后弃上清, 加入700 mL/L冰乙醇固定, 4 ℃过夜; 上机前, 2000 r/min离心8 min, 弃去乙醇, PBS洗2遍; 加入1 mL PBS制成细胞悬液, 加RNaseA(终浓度50 mg/L), 室温放置1 h; 调整细胞浓度为1×106/管, 加1 mL PI(50 mg/L), 避光30 min, 上机检测细胞周期, 每个样本检测10 000个细胞.
1.2.3 Western blot法检测p21WAF1/CIP1蛋白的表达: 按照细胞总蛋白试剂盒提取总蛋白, Bradford法检测蛋白质的含量, 50 µg上样量分别用12% SDS-聚丙烯酰胺凝胶进行垂直电泳分离, 转移至PVDF膜上, 用含50 g/L牛血清白蛋白(bovine serum albumin, BSA)封闭3 h, 加入p21WAF1/CIP1一抗, 4 ℃过夜. 将膜放于TBST稀释的二抗中, 室温轻摇2 h, 用TBST洗涤3次, 使用辣根过氧化物酶HRP-ECL发光法进行显影, 结果用以Gel-Doc图像分析软件进行分析.
统计学处理 统计学多样本均数采用单因素方差分析, SPSS10.0统计软件处理. 以P<0.05有统计学意义.
EC1细胞经不同浓度的TSA处理24和48 h后, MTT法检测细胞增殖变化, 各处理组细胞在TSA的作用下细胞的A值较对照组下降, EC1细胞的存活率降低, 增殖受到抑制, 其中0.3 μmol/L TSA组作用24和48 h A值与对照组相比无统计学差异(P>0.05), 0.5、1.0 μmol/L TSA组和对照组24和48 h A值与对照组均有统计学差异(均P<0.05, 表1).
0.3 μmol/L TSA处理细胞后细胞周期与对照组相比, 无明显变化. 随TSA浓度增加, G0/G1期细胞百分比逐渐增大, 而S期细胞百分比降低, 且呈浓度依赖关系, 与溶剂对照组相比差异均有统计学意义(P<0.05), 表明细胞被阻滞于G0/G1期(表2, 图1).
为了探讨TSA对EC1细胞周期阻滞的分子机制, 我们检测了细胞周期蛋白p21WAF1/CIP1, TSA处理EC1细胞, Western blot检测0.3 μmol/L TSA引起的p21WAF1/CIP1的改变和对照组相比无统计学差异, 0.5、1.0 μmol/L TSA组较对照组p21WAF1/CIP1明显增加(均P<0.05, 图2), 提示TSA对细胞周期的抑制至少部分是由于p21WAF1/CIP1上调引起的.
核小体是最基本的染色体结构. 核小体中心组蛋白的乙酰化(acetylation)和去乙酰化(deacetylation)是调节染色体结构和基因转录的重要修饰. 组蛋白乙酰转移酶(histone acetylase, HAT)和HDAC是调节染色体结等构和基因表达的关键激酶. 通过翻译后修饰改变染色体结构, 尤其是对位于核心组蛋白N-端的赖氨酸的乙酰化修饰可以改变染色体结构和功能. 一般情况下, 细胞及有机体内组蛋白的乙酰化和去乙酰化之间存在动态平衡, 从而控制染色质的结构和调节基因的表达. 研究表明肿瘤的发病与组蛋白的乙酰化和去乙酰化这对平衡的紊乱有着密切关系. HAT可以增加组蛋白的乙酰化中和组蛋白电荷, 使RNA合成酶、转录因子、调节因子复合物接近DNA, 使基因更容易表达. 与之相反, HDAC的去乙酰化作用则由于恢复了组蛋白正电荷, 从而增加DNA与组蛋白之间的引力, 使松弛的核小体变得十分紧密, 不利于特定基因的表达, 包括一些肿瘤抑制基因. 曲古菌素A作为HDAC抑制剂, 通过改变核小体组蛋白乙酰化水平来改变染色体的结构, 从而调控了基因的表达[5-7]. 诸多研究表明, 当HDAC过度表达时, 既可导致某些特定基因的非正常抑制, 引起肿瘤的发生, 因此HDAC抑制剂成为肿瘤治疗的新热点.
本研究发现0.3 μmo/L TSA处理细胞后细胞周期与对照组相比, 无明显变化. 随TSA浓度增加, G0/G1期细胞百分比逐渐增大, 而S期细胞百分比降低. TSA可以使食管癌细胞EC1发生G0/G1期阻滞从而抑制肿瘤细胞的增殖. 我们又探讨了TSA引起胞EC1发生G0/G1期阻滞的机制. 利用Western blot分析当TSA作用于EC1细胞时细胞周期抑制基因p21WAF1/CIP1的表达增强且随着药物浓度增加而增加.
细胞周期是指细胞从一次分裂结束到下一次分裂终了的过程, 细胞周期分为G1期, S期, G2期和M期, 其中最关键的是S期, 此期细胞进行DNA倍增和染色体复制, 是增殖的关键时期. 若发生G1期阻滞, 则细胞无法增殖. 细胞周期的进程受到一系列周期素依赖激酶(CDK), 周期素依赖激酶抑制剂(CDKI), 周期素(cyclin)精密的调控[8-9]. 其中, p21可以和所有的细胞周期蛋白依赖性激酶(CDK2、4、6)复合物相结合, 是一种通用的细胞周期依赖性激酶抑制剂, 控制细胞周期G1/S调控点, 抑制细胞增殖, 在肿瘤的发生发展发挥重要作用TSA作用于EC1细胞时细胞周期抑制基因p21WAF1/CIP1的表达增强, 从而抑制细胞增殖[10-11]. 由此我们可以看出TSA抑制EC1增殖的机制之一是由于引起细胞周期抑制基因p21的表达上调而引起的G1期阻滞.
曲古菌素A(TSA)既是一种抗真菌药物, 同时也是强大的组蛋白去乙酰酶(HDAC)抑制剂, 其生物学效应主要包括诱导细胞凋亡, 阻滞细胞周期和诱导肿瘤细胞分化. 不同结构的HDAC抑制剂对不同的细胞系的作用及机制不同, 本实验探讨TSA对食管癌EC1细胞增殖和细胞周期的影响.
秦成勇, 教授, 山东省立医院消化内科
核小体中心组蛋白的乙酰化(acetylation)和去乙酰化(deacetylation)是调节染色体结构和基因转录的重要修饰. 细胞及有机体内组蛋白的乙酰化和去乙酰化之间存在动态平衡, 从而控制染色质的结构和调节基因的表达. 诸多研究表明, 当HDAC过度表达时, 既可导致某些特定基因的非正常抑制, 引起肿瘤的发生, 因此HDAC抑制剂成为肿瘤治疗的新热点.
本研究发现, 一定浓度的TSA可通过引起细胞周期抑制基因p21WAF1/CIP1的表达增强导致食管癌EC1细胞发生细胞增殖抑制和细胞周期G0/G1阻滞, 为进一步探索HDAC抑制剂对食管癌治疗奠定了理论基础.
本研究探讨了曲古菌素A对食管癌EC1细胞增殖和细胞周期的影响及其分子机制, 有一定新颖性, 结论有一定参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Mariadason JM. HDACs and HDAC inhibitors in colon cancer. Epigenetics. 2008;3:28-37. [PubMed] |
| 2. | Althuis MD, Dozier JM, Anderson WF, Devesa SS, Brinton LA. Global trends in breast cancer incidence and mortality 1973-1997. Int J Epidemiol. 2005;34:405-412. [PubMed] [DOI] |
| 3. | Marks PA, Miller T, Richon VM. Histone deacetylases. Curr Opin Pharmacol. 2003;3:344-351. [PubMed] [DOI] |
| 4. | Suzuki T, Yokozaki H, Kuniyasu H, Hayashi K, Naka K, Ono S, Ishikawa T, Tahara E, Yasui W. Effect of trichostatin A on cell growth and expression of cell cycle- and apoptosis-related molecules in human gastric and oral carcinoma cell lines. Int J Cancer. 2000;88:992-997. [PubMed] [DOI] |
| 5. | Malinen M, Saramäki A, Ropponen A, Degenhardt T, Väisänen S, Carlberg C. Distinct HDACs regulate the transcriptional response of human cyclin-dependent kinase inhibitor genes to Trichostatin A and 1alpha,25-dihydroxyvitamin D3. Nucleic Acids Res. 2008;36:121-132. [PubMed] [DOI] |
| 7. | Kang MR, Kang JS, Han SB, Kim JH, Kim DM, Lee K, Lee CW, Lee KH, Lee CH, Han G. A novel delta-lactam-based histone deacetylase inhibitor, KBH-A42, induces cell cycle arrest and apoptosis in colon cancer cells. Biochem Pharmacol. 2009;78:486-494. [PubMed] [DOI] |
| 8. | Qu W, Kang YD, Zhou MS, Fu LL, Hua ZH, Wang LM. Experimental study on inhibitory effects of histone deacetylase inhibitor MS-275 and TSA on bladder cancer cells. Urol Oncol. 2009; Jan 30. [Epub ahead of print]. [PubMed] |
| 9. | Roy S, Packman K, Jeffrey R, Tenniswood M. Histone deacetylase inhibitors differentially stabilize acetylated p53 and induce cell cycle arrest or apoptosis in prostate cancer cells. Cell Death Differ. 2005;12:482-491. [PubMed] [DOI] |
| 10. | Habold C, Poehlmann A, Bajbouj K, Hartig R, Korkmaz KS, Roessner A, Schneider-Stock R. Trichostatin A causes p53 to switch oxidative-damaged colorectal cancer cells from cell cycle arrest into apoptosis. J Cell Mol Med. 2008;12:607-621. [PubMed] [DOI] |