修回日期: 2009-11-13
接受日期: 2009-11-16
在线出版日期: 2009-12-08
目的: 探讨在食物过敏小鼠模型中CD4+CD25+ Treg细胞的功能状态及TIM4与TIM1对其的影响, 分析食物过敏的发生机制.
方法: 无受试蛋白喂养BALB/c小鼠32只, 随机分为4组: 空白对照组、金黄色葡萄球菌肠毒素B(SEB)+卵清蛋白(OVA)共同作用组、TIM1抗体干预组及TIM4抗体干预组, 分别于0、3、9 d ip生理盐水, SEB和OVA, TIM1抗体+SEB+OVA, TIM4抗体+SEB+OVA, 并于第7、14天给予SEB+OVA(空白对照组以生理盐水ig)ig. RT-PCR检测空肠及脾脏Foxp3 mRNA表达、空肠TIM4 mRNA表达, ELISA法测定血清TGF-β1与IL-10的表达. 免疫组织化学法检测空肠黏膜TGF-β1与IL-10表达.
结果: 与空白对照组相比, SEB+OVA共同作用组小鼠空肠及脾脏Foxp3 mRNA表达明显下降(0.401±0.145 vs 0.732±0.162; 0.407±0.082 vs 0.691±0.145, 均P<0.05), TIM4 mRNA表达明显增高(P<0.05), 血清和空肠黏膜TGF-β1表达显著降低(7859.853±126.704 ng/L vs 8342.814±488.461 ng/L; 108.834±9.634 ng/L vs 156.298±12.002 ng/L, 均P<0.05); 与SEB+OVA组相比, TIM1和TIM4抗体干预组小鼠空肠及脾脏Foxp3 mRNA及血清和空肠黏膜TGF-β1表达显著增高(均P<0.05).
结论: TIM4与TIM1抗体干预可恢复SEB+ OVA致敏小鼠Treg细胞功能, 维持耐受平衡, 减轻过敏症状, 提示TIM4-TIM1通路可能在食物过敏的发生中起重要作用.
引文著录: 王新亭, 郑鹏远, 罗予, 刘志强, 张利利. TIM1与TIM4对小鼠食物过敏模型中CD4+CD25+调节性T细胞功能的影响. 世界华人消化杂志 2009; 17(34): 3507-3513
Revised: November 13, 2009
Accepted: November 16, 2009
Published online: December 8, 2009
AIM: To evaluate the function of T regulatory (Treg) cells and determine the role of T cell immunoglobulin and mucin domain-containing protein 4 (TIM4) and TIM1 in modulating the function of Treg cells in mice with food allergy.
METHODS: Thirty-two BALB/c mice fed an ovalbumin (OVA)-free diet were randomly and equally divided into four groups: normal saline (NS) group, staphylococcal enterotoxin B (SEB) plus OVA group, anti-TIM1 antibody plus SEB and OVA group, and anti-TIM4 antibody plus SEB and OVA group. Mice in the four groups were sensitized by intraperitoneal injections of NS, SEB/OVA, anti-TIM1/SEB/OVA, and anti-TIM4/SEB/OVA on days 0, 3 and 9, respectively. All mice (except the NS group) were challenged by intraperitoneal injections of SEB/OVA on days 7 and 14, respectively. The expression of forkhead box P3 (FOXP3) mRNA in the jejunum and spleen and TIM4 mRNA in the jejunum was measured by reverse transcription-polymerase chain reaction (RT-PCR). The levels of transforming growth factor β1 (TGF-β1) and interleukin-10 (IL-10) in the serum were analyzed by enzyme-linked immunosorbent assay (ELISA). The expression of TGF-β1 and IL-10 proteins in the jejunum was detected by immunohistochemistry.
RESULTS: Compared with the NS group, the expression levels of FOXP3 mRNA in the jejunum and spleen significantly decreased (0.401 ± 0.145 vs 0.732 ± 0.162 and 0.407 ± 0.082 vs 0.691 ± 0.145, respectively; both P < 0.05), the expression level of TIM4 mRNA increased significantly (P < 0.05), and the levels of TGF-β1 in the serum and jejunum decreased significantly (7859.853 ± 126.704 ng/L vs 8342.814 ± 488.461 ng/L and 108.834 ± 9.634 ng/L vs 156.298 ± 12.002 ng/L, respectively; both P < 0.05) in the SEB/OVA group. In contrast, the expression levels of FOXP3 mRNA in the jejunum and spleen and TGF-β1 in the serum and jejunum were significantly higher in the anti-TIM1/SEB/OVA and anti-TIM4/SEB/OVA groups than in the SEB/OVA group (all P < 0.05).
CONCLUSION: Treg cells in SEB/OVA-sensitized mice are dysfunctional. Pretreatment with anti-TIM1 or anti-TIM4 can restore the function of Treg cells, suggesting that the TIM4-TIM1 pathway may play a key role in the development of food allergy.
- Citation: Wang XT, Zheng PY, Luo Y, Liu ZQ, Zhang LL. TIM4 and TIM1 modulate the function of CD4+CD25+ T regulatory cells in mice with food allergy. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3507-3513
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3507.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3507
近年来, 过敏性疾病的发病率在全球内迅速增加[1], 目前2%-6%的人有食物过敏(food allergy, FA)及相关症状[2]. FA的症状轻则表现为呕吐、腹泻、呼吸困难、皮疹等不适, 重则发生威胁生命的过敏性休克[3]. 而FA的病因和免疫机制仍不清楚, 当前普遍认为FA是肠道免疫系统与食物抗原之间的耐受平衡打破, 产生的以Th2细胞反应为主的免疫反应. 正常情况下, 肠道免疫系统对食物抗原和肠道共生菌耐受, 肠道上皮完整性、树突状细胞(dendritic cell, DC)和调节性T细胞等对维持这种平衡至关重要[4]. 调节性T细胞尤其是CD4+CD25+调节性T(CD4+CD25+ regulatory T cells, Treg)细胞在机体免疫系统中发挥负向调节作用, 在口服耐受中发挥关键作用, 其功能紊乱或数目下降将打破肠道耐受平衡[5]. 鼠和人中Treg能选择性表达叉头翼螺旋转录因子(Foxp3), 表达Foxp3的Treg细胞在维持免疫耐受的作用已被证实, Foxp3的基因突变或表达下降, 可导致Treg细胞的功能不全[6-9]. T细胞免疫球蛋白与黏蛋白域(T cell immunoglobulin and mucin domains, TIMS)蛋白最近在小鼠中发现, 包括TIM1-TIM8, 在人和猴子基因组中也发现有同源类似分子[10]. TIMS家族的基因多态性与自身免疫性疾病、过敏性疾病及Thl-Th2细胞间的平衡作用受到人们重视[11-12]. 小鼠空肠CD4+ T细胞表达TIM1, TIM4是他的配体[11], 表达于抗原递呈细胞, 特别是成熟的DC, 高表达的TIM4与TIM1结合能够打破Thl-Th2细胞平衡, 促进Th2细胞炎症因子释放, 并产生相应炎症反应[13-14]. TIM1在调节Treg细胞的功能中也显示出重要作用, 在体外实验中已证实, TIM1的激活能够降低Treg细胞Foxp3、糖皮质激素诱发型肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor, GITR)和其他Treg细胞表面分子的mRNA及其功能, 并能减少相应细胞向Treg细胞转化[15]. 目前对FA中的Treg的功能状态及TIM1对其影响尚未见报道, 我们推测FA中也存在Treg细胞功能不全, TIM4与TIM1的相互作用可能降低Treg细胞的功能及状态, 破坏免疫耐受平衡, 是造成FA的重要机制之一. 本研究通过构建过敏模型, 检测过敏状态下Treg的功能, 并用TIM1和TIM4抗体干预, 对TIM1对Treg的影响和FA的发病机制做进一步探讨.
卵清蛋白(OVA, Sigma公司), SEB由郑州大学生物工程系提供, TIM1(美国RD公司), TIM4(美国BioLegend公司), 小鼠IL-10、TGF-β1 ELISA定量试剂盒(上海西唐生物科技有限公司), BALB/c小鼠购于河南省实验动物中心.
1.2.1 动物模型实验: 无受试蛋白喂养BALB/c小鼠32只, 6-8 wk, ♂, 随机分为4组: 空白对照组(A)、SEB+OVA共同作用组(B)、TIM1干预组(C)、TIM4干预组(D), 每组8只. 按照文献[14]方法进行造模, B组小鼠的致敏和激发过程如下: 取BALB/c小鼠8只, 第0、3、9天使用10 μg SEB及20 μg OVA无菌生理盐水(NS)溶液0.2 mL ip进行基础致敏, 第7、14天使用10 μg SEB及20 μg OVA无菌生理盐水(NS)溶液0.2 mL对B组小鼠进行ig激发. 另设小剂量TIM1特殊对照组(E)(n = 8), A组以等体积的生理盐水, C、D、E组抗体分别于SEB+OVA ip和ig前30 min ip, 总剂量分别为每只50 μg、50 μg、10 μg. 以腹泻为造模成功标志, 如果被致敏小鼠未出现明显腹泻, 可观察处死后小鼠的空肠内容物, 相对于正常小鼠结肠中的球样大便, 水样粪便亦可被视为腹泻. 第15天处死小鼠, 留取血清标本.
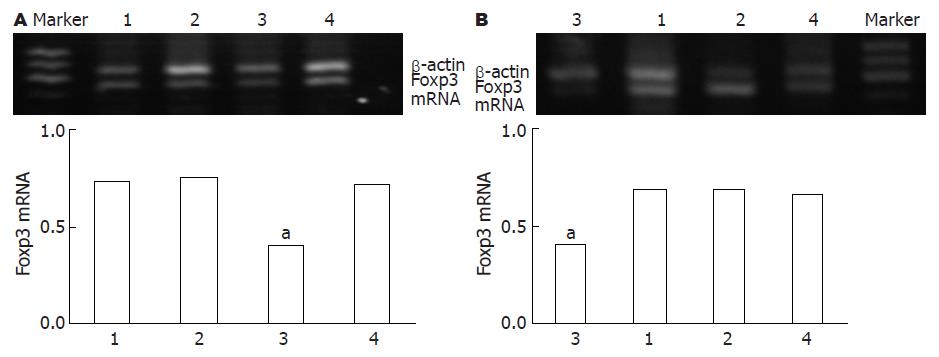
1.2.2 RT-PCR检测Foxp3和TIM4 mRNA表达: 无菌取空肠和脾脏, 生理盐水冲洗, 以TRIzol法提取总RNA, 按试剂盒说明进行cDNA合成和PCR扩增, Foxp3引物(上游: 5'-AGGAGAAAGCGGATACCA-3', 下游: 5'-GAAGGACATACC CAGAAGC-3', 55 ℃, 扩增产物349 bp)、TIM4引物(上游: 5'-AGGGTCCGCCTCACTAC-3', 下游: 5'-TCCCGTCTTCATCATCCC-3', 55 ℃, 扩增产物404 bp)、β-actin(上游: 5'-GAGACCTTCAACACCCCGC-3', 下游: 5'-CCACAGGATTCCAT CCCAA-3', 59 ℃, 扩增产物446 bp), PCR产物以1.5%琼脂糖凝胶电泳, 以DNA Marker标记确定条带大小. 凝胶扫描成像分析系统进行摄像后并对凝胶条带灰度信号强度半定量分析, 以Foxp3/β-actin及TIM4/β-actin的比值作为Foxp3和TIM4 mRNA表达的相对表达强度.
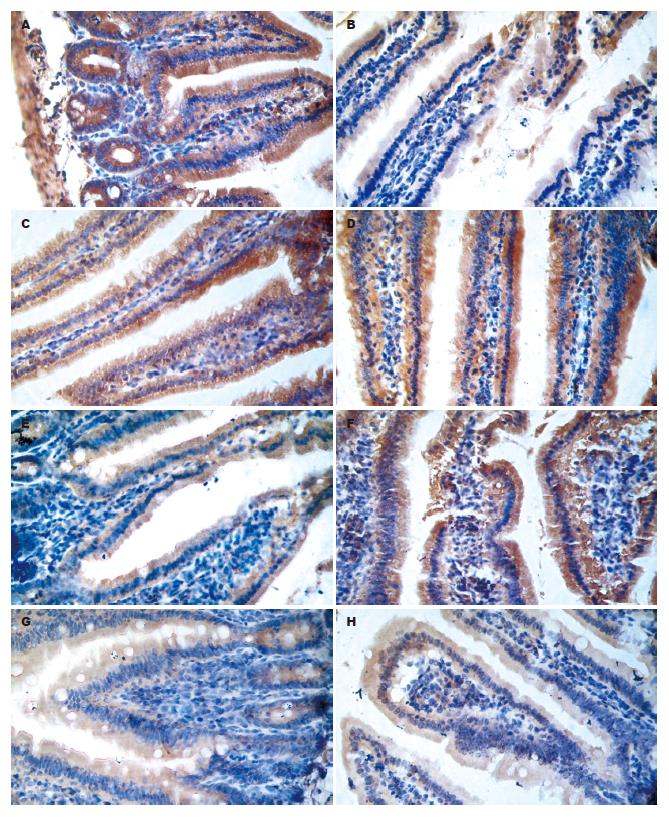
1.2.3 空肠黏膜TGF-β1、IL-10免疫组织化学测定: 无菌取空肠, 生理盐水冲洗, 40 g/L多聚甲醛固定24-48 h, 以SP方法检测空肠黏膜TGF-β1、IL-10表达.
统计学处理 实验结果采用SPSS13.0统计软件包分析. 组间均数比较选用单因素方差分析达. 采用α = 0.05为假设检验标准.
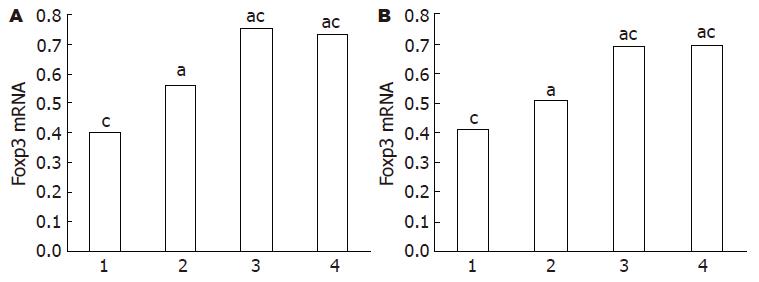
与空白对照组小鼠相比, SEB+OVA过敏小鼠空肠及脾脏Foxp3 mRNA表达明显减少(0.401±0.145 vs 0.732±0.162; 0.407±0.082 vs 0.691±0.145, 均P = 0.000), TIM1和TIM4抗体干预组空肠及脾脏Foxp3表达较过敏组小鼠明显恢复(均P = 0.000), 与空白对照组接近(图1). 我们以较小剂量TIM1干预做特别对照, 结果提示TIM1的干预对SEB+OVA过敏小鼠Foxp3的恢复具有剂量依从性(图2).
空肠TIM4 mRNA表达: 与空白对照组小鼠相比, SEB+OVA、TIM1和TIM4抗体干预组小鼠TIM4表达较高(P = 0.004、0.007和0.033, 图3), 抗体干预组之间表达无明显差异.
SEB+OVA实验组小鼠的平均TGF-β1与空白对照组、anti-TIM1组和anti-TIM4组比较明显减少, 差异具有统计学意义(P = 0.012, 0.010和0.000), 小剂量TIM1抗体干预组TGF-β1与实验组相比明显增高(P = 0.020), 大剂量TIM1抗体干预组与小剂量TIM1干预组相比TGF-β1仍高(P = 0.001); 空白对照组血清IL-10水平为40.395±6.319 ng/L, SEB+OVA实验组IL-10明显升高(P<0.05), 其余干预组IL-10略有升高, 但无统计学意义(表1).
实验组小鼠TGF-β1表达明显减少, 低于空白对照组和各干预组(均P<0.05), 与血清TGF-β1表达相似, TIM1干预具有剂量依从性(图4); 与实验组相比, 大小剂量TIM1干预后, TGF-β1明显升高(均P<0.05), 大小剂量TIM1干预比较差异仍具有统计学意义(均P<0.05); 与空白对照组相比, 实验组及干预组IL-10明显升高(均P<0.05, 表2).
近年来有关FA领域的研究进展迅速, 而其发生机制仍不清楚, 目前研究多集中在Th1/Th2细胞失衡与卫生假说、细菌毒素及食物蛋白的共同作用、口服耐受受损等方面[16-18]. TIMS家族的发现及其在免疫调节中的作用带来新的研究思路. TIM蛋白是TIM基因编码的一类具有共同基序的跨膜糖蛋白, 其基本结构包括一个信号肽、免疫球蛋白(IgV)样区、黏蛋白样区、跨膜区和有磷酸位点的胞内尾巴区[19], TIM蛋白在自身免疫性疾病、超敏反应性疾病及移植耐受中均发挥重要作用, CD4+ T细胞表达TIM1, TIM4是其内源性配体, 二者相互作用促进CD4+ T细胞的分化, 调节Th1-Th2平衡[20], 然而二者对Treg细胞的影响尚不清楚, 而Treg细胞在维持口服耐受过程中发挥重要作用, 口服耐受受损可以促进FA发生[21]. 因此在FA中, 了解Treg细胞的功能及TIM1对其影响, 对于了解发生FA的病因和免疫机制有重要意义.
Foxp3是Treg细胞的重要标记分子, 同时也是控制Treg发育及其功能效应的关键基因[22-23], Foxp3决定了Treg细胞的抑制功能[24], Foxp3的表达高低可以有效判断Treg细胞的功能状态. 本研究显示FA小鼠空肠组织和脾脏Foxp3 mRNA表达明显减少, 提示存在Treg细胞的功能不全. 通过释放抑制性细胞因子TGF-β1和IL-10是Treg细胞发挥抑制功能的重要方面[25-26], 而TGF-β1与IL-10共同作用可以有效发挥抑制作用. 空肠是FA累及的重要靶器官, 我们检测了血清和空肠组织局部的TGF-β1和IL-10, 发现FA小鼠血清和空肠组织TGF-β1明显下降, 这与Foxp3下降是一致的, 进一步证实FA中存在Treg细胞功能不全, 可以导致口服耐受受损, 从而发生FA. 尽管过敏组小鼠血清和空肠组织IL-10比正常组略高, 其原因可能是IL-10也是Th2分泌的重要因子, 在FA中存在Th2极化, 能够释放大量IL-10, 除此外, DC和Th3等细胞也能分泌部分IL-10, 最终影响IL-10水平, 提示IL-10作用十分广泛和复杂, 值得进一步探讨.
Degauque et al[15]通过体外实验证实TIM1的激活能够降低CD4+CD25+ Treg细胞的功能和数目, 是破坏移植耐受的重要原因. 我们推测FA中Treg细胞的功能不全也存在类似机制, SEB与OVA共刺激可以促进DC的TIM4高表达[14], 本实验也证实了这一点, 而高表达的TIM4可以激活TIM1, 导致Treg细胞功能不全. 我们采用SEB+OVA过敏小鼠模型, 分别用TIM1和TIM4抗体干预, 检测干预后CD4+CD25+ Treg细胞的功能, 发现TIM1和TIM4抗体干预后, 过敏小鼠的Foxp3与TGF-β1均明显恢复, 同时我们用不同剂量TIM1抗体干预, 发现Foxp3与TGF-β1的恢复与TIM1抗体干预具有剂量依从性, 提示在FA中, TIM1的激活可以导致Treg细胞功能下降, 而高表达的TIM4与TIM1作用导致Treg细胞功能下降可能是导致FA的重要原因之一. 病理诊断是诊断FA病情的有效指标, 我们证实在过敏小鼠空肠组织存在大量的M细胞和嗜酸性粒细胞等炎症细胞(数据未显示), 抗体干预组小鼠炎症细胞明显减少, 和正常对照组小鼠类似, 说明抗体干预是有效的, 而破坏TIM4-TIM1通路有希望成为治疗FA的理想靶点.
大量临床证据提示致病性细菌感染参与过敏性疾病的发生, 我们前期研究发现SEB在FA反应中发挥重要作用[17], SEB能够通过促进DC的TIM4表达增高, 且具有剂量依从性, 而TLR2、NOD1参与促进DC TIM4表达增高, 高表达TIM4的DC能够促进Th2细胞分化及因子释放, 干扰TIM1-TIM4作用则能消除该作用[21]. Yang et al发现, SEB与OVA共刺激不仅能显著促进DC的TIM4表达, 而且能显著促进MHCⅡ分子的表达, 而只有SEB和OVA共同作用可促进FA的发生, 他们同时检测其他肠道细菌产物如葡萄菌肽多糖和百日咳毒素也能促进DC TIM4表达[14]. 另有研究表明, 霍乱毒素(cholera toxin, CT)也能够促进DC TIM4表达, 在花生过敏模型中, 只有CT与花生提取物共同作用可促进FA的发生[27], 这些结果提示体内微生物毒素和食物抗原的共同作用对过敏的发生至关重要. 结合本研究, 我们认为FA的发生机制可能如下: 正常情况下肠道免疫系统不会对食物抗原和肠道固有细菌发生免疫反应, 为口服耐受状态, 这种耐受状态与肠上皮细胞的各组成部分的完整性、DC的提呈作用、CD4+CD25+ Treg细胞的作用等因素密切相关[4]; 在炎症及各种理化因子的刺激下, 肠道黏膜完整性受到破坏, DC与大量食物抗原和致病性细菌及产物相遇, DC通过TLR受体、NOD受体及吞噬作用处理细菌产物, 促进TIM4及共刺激分子表达增多, 同时通过吞噬作用处理食物抗原, 二者的共同作用导致大量TIM4表达及DC的成熟及活化, 该DC与CD4+ T细胞通过TIM4与TIM1的相互作用作用, 一方面促其向Th2细胞分化, 另一方面, 抑制Treg Foxp3表达及抑制因子释放, 最终打破口服耐受, 导致Th2细胞的高度极化, 释放大量IL-4、IL-5、IL-10及IL-13等因子, 促使M细胞和嗜酸性粒细胞增多和活化, 释放大量炎症因子, 造成细胞水肿及组织损伤, 产生过敏症状. 我们认为成熟DC的形成可能是导致FA最为关键的因素, 致病微生物的感染是促进DC成熟的重要环节, 而阻止该DC的形成和破坏其重要信号传导可能成为有效控制FA的方法, 然而, FA发生机制十分复杂, 尚需大量的基础研究证实.
最近的研究发现TIM1和TIM4分子还可以表达磷脂酰丝氨酸(PS)的受体[28], 表达在APC上TIM4分子胞外的IgV区可与表达在凋亡细胞的PS结合, 在清除凋亡细胞及预防自身免疫发挥重要作用, 提示TIM1和TIM4的作用复杂, 值得进一步探讨. 我们在实验中证实, 在动物过敏模型中, 存在口服耐受受损及调节性T细胞功能不全, 而TIM4-TIM1通路可能导致Treg细胞的功能下降, 用相应抗体破坏其相互作用, 则能改善Treg细胞的功能. 实验结果表明在FA中, TIM1的激活对CD4+ T细胞的功能和分化起着关键性作用, 不仅能促进Th2细胞极化, 并且降低Treg功能, 破坏TIM1信号传导, 可以有效维持耐受平衡, 改善相应过敏症状.
FA在世界上广泛存在, 最近几十年其发病率在全球范围内大大提高. 然而FA的发病机制尚不清楚, 最近几年有关FA领域研究发展迅速. 口服耐受受损是致FA的重要因素之一, 维持口服耐受的复杂免疫调节网络成为研究热点.
范建高, 教授, 上海交通大学医学院附属新华医院消化内科
目前对FA的研究多集中在Th1/Th2细胞失衡与卫生假说、细菌毒素及食物蛋白的共同作用、口服耐受受损等方面. TIMS家族的发现及其在免疫调节中的作用逐渐受到重视, 尤其TIMS蛋白在过敏性疾病中的重要作用引起研究者关注.
Yang et al研究表明TIM4与TIM1的作用能促进Th2细胞分化, 在FA中发挥重要作用, 用相应抗体干预则能改善症状. Degauque et al研究认为在移植反应中TIM1的激活能够降低CD4+CD25+ Treg细胞的功能和数目, 破坏免疫耐受. 已有研究表明在FA模型中, 小鼠脾脏的CD4+CD25+ Treg细胞的数目下降显著.
肠道是人体最大的免疫器官, 检测肠道及血清Treg细胞因子表达, 可以明确其功能状态. 本研究通过构建过敏模型, 检测过敏状态下Treg的功能, 并用TIM1和TIM4抗体干预, 对TIM1对Treg的影响和FA的发病机制做进一步探讨.
本研究结果显示, TIM4与TIM1的作用不仅能促进Th2细胞分化, 而且能降低Treg功能, TIM1的激活对FA的发生至关重要. 应用TIM4与TIM1抗体, 可以防止FA的发生, 维持免疫耐受.
本文探讨了TIM1与TIM4对小鼠食物过敏模型中CD4+CD25+调节性T细胞功能的影响, 内容新颖, 可读性好.
编辑: 李军亮 电编: 何基才
| 1. | Sicherer SH, Leung DY. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2008. J Allergy Clin Immunol. 2009;123:319-327. [PubMed] [DOI] |
| 2. | Vierk KA, Koehler KM, Fein SB, Street DA. Prevalence of self-reported food allergy in American adults and use of food labels. J Allergy Clin Immunol. 2007;119:1504-1510. [PubMed] [DOI] |
| 3. | Bahna SL. Diagnosis of food allergy. Ann Allergy Asthma Immunol. 2003;90:77-80. [PubMed] |
| 4. | Strobel S, Mowat AM. Oral tolerance and allergic responses to food proteins. Curr Opin Allergy Clin Immunol. 2006;6:207-213. [PubMed] [DOI] |
| 5. | Almeida AR, Legrand N, Papiernik M, Freitas AA. Homeostasis of peripheral CD4+ T cells: IL-2R alpha and IL-2 shape a population of regulatory cells that controls CD4+ T cell numbers. J Immunol. 2002;169:4850-4860. [PubMed] |
| 6. | Powrie F, Read S, Mottet C, Uhlig H, Maloy K. Control of immune pathology by regulatory T cells. Novartis Found Symp. 2003;252:92-98; discussion 98-105, 106-114. [PubMed] |
| 7. | Coombes JL, Robinson NJ, Maloy KJ, Uhlig HH, Powrie F. Regulatory T cells and intestinal homeostasis. Immunol Rev. 2005;204:184-194. [PubMed] [DOI] |
| 8. | Fantini MC, Becker C, Tubbe I, Nikolaev A, Lehr HA, Galle P, Neurath MF. Transforming growth factor beta induced FoxP3+ regulatory T cells suppress Th1 mediated experimental colitis. Gut. 2006;55:671-680. [PubMed] [DOI] |
| 9. | Ochando JC, Homma C, Yang Y, Hidalgo A, Garin A, Tacke F, Angeli V, Li Y, Boros P, Ding Y. Alloantigen-presenting plasmacytoid dendritic cells mediate tolerance to vascularized grafts. Nat Immunol. 2006;7:652-662. [PubMed] [DOI] |
| 10. | Umetsu DT, McIntire JJ, DeKruyff RH. TIM-1, hepatitis A virus and the hygiene theory of atopy: association of TIM-1 with atopy. J Pediatr Gastroenterol Nutr. 2005;40 Suppl 1:S43. [PubMed] [DOI] |
| 11. | Umetsu SE, Lee WL, McIntire JJ, Downey L, Sanjanwala B, Akbari O, Berry GJ, Nagumo H, Freeman GJ, Umetsu DT. TIM-1 induces T cell activation and inhibits the development of peripheral tolerance. Nat Immunol. 2005;6:447-454. [PubMed] [DOI] |
| 12. | Vincentz JW, McWhirter JR, Murre C, Baldini A, Furuta Y. Fgf15 is required for proper morphogenesis of the mouse cardiac outflow tract. Genesis. 2005;41:192-201. [PubMed] [DOI] |
| 13. | Meyers JH, Chakravarti S, Schlesinger D, Illes Z, Waldner H, Umetsu SE, Kenny J, Zheng XX, Umetsu DT, DeKruyff RH. TIM-4 is the ligand for TIM-1, and the TIM-1-TIM-4 interaction regulates T cell proliferation. Nat Immunol. 2005;6:455-464. [PubMed] [DOI] |
| 14. | Yang PC, Xing Z, Berin CM, Soderholm JD, Feng BS, Wu L, Yeh C. TIM-4 expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy. Gastroenterology. 2007;133:1522-1533. [PubMed] [DOI] |
| 15. | Degauque N, Mariat C, Kenny J, Zhang D, Gao W, Vu MD, Alexopoulos S, Oukka M, Umetsu DT, DeKruyff RH. Immunostimulatory Tim-1-specific antibody deprograms Tregs and prevents transplant tolerance in mice. J Clin Invest. 2008;118:735-741. [PubMed] [DOI] |
| 16. | Yazdanbakhsh M, Kremsner PG, van Ree R. Allergy, parasites, and the hygiene hypothesis. Science. 2002;296:490-494. [PubMed] [DOI] |
| 17. | Liu T, Wang BQ, Zheng PY, He SH, Yang PC. Rhinosinusitis derived Staphylococcal enterotoxin B plays a possible role in pathogenesis of food allergy. BMC Gastroenterol. 2006;6:24. [PubMed] [DOI] |
| 18. | Faria AM, Weiner HL. Oral tolerance. Immunol Rev. 2005;206:232-259. [PubMed] [DOI] |
| 19. | McIntire JJ, Umetsu SE, Akbari O, Potter M, Kuchroo VK, Barsh GS, Freeman GJ, Umetsu DT, DeKruyff RH. Identification of Tapr (an airway hyperreactivity regulatory locus) and the linked Tim gene family. Nat Immunol. 2001;2:1109-1116. [PubMed] [DOI] |
| 20. | Liu T, He SH, Zheng PY, Zhang TY, Wang BQ, Yang PC. Staphylococcal enterotoxin B increases TIM4 expression in human dendritic cells that drives naïve CD4 T cells to differentiate into Th2 cells. Mol Immunol. 2007;44:3580-3587. [PubMed] [DOI] |
| 21. | Ganeshan K, Neilsen CV, Hadsaitong A, Schleimer RP, Luo X, Bryce PJ. Impairing oral tolerance promotes allergy and anaphylaxis: a new murine food allergy model. J Allergy Clin Immunol. 2009;123:231-238.e4. [PubMed] |
| 22. | Fehérvari Z, Sakaguchi S. Development and function of CD25+CD4+ regulatory T cells. Curr Opin Immunol. 2004;16:203-208. [PubMed] [DOI] |
| 23. | Yagi H, Nomura T, Nakamura K, Yamazaki S, Kitawaki T, Hori S, Maeda M, Onodera M, Uchiyama T, Fujii S. Crucial role of FOXP3 in the development and function of human CD25+CD4+ regulatory T cells. Int Immunol. 2004;16:1643-1656. [PubMed] [DOI] |
| 24. | Khattri R, Cox T, Yasayko SA, Ramsdell F. An essential role for Scurfin in CD4+CD25+ T regulatory cells. Nat Immunol. 2003;4:337-342. [PubMed] [DOI] |
| 25. | Annacker O, Pimenta-Araujo R, Burlen-Defranoux O, Barbosa TC, Cumano A, Bandeira A. CD25+ CD4+ T cells regulate the expansion of peripheral CD4 T cells through the production of IL-10. J Immunol. 2001;166:3008-3018. [PubMed] |
| 26. | Marie JC, Letterio JJ, Gavin M, Rudensky AY. TGF-beta1 maintains suppressor function and Foxp3 expression in CD4+CD25+ regulatory T cells. J Exp Med. 2005;201:1061-1067. [PubMed] [DOI] |
| 27. | Feng BS, Chen X, He SH, Zheng PY, Foster J, Xing Z, Bienenstock J, Yang PC. Disruption of T-cell immunoglobulin and mucin domain molecule (TIM)-1/TIM4 interaction as a therapeutic strategy in a dendritic cell-induced peanut allergy model. J Allergy Clin Immunol. 2008;122:55-61, 61.e1-e7. [PubMed] |