修回日期: 2009-11-22
接受日期: 2009-11-23
在线出版日期: 2009-12-08
目的: 探讨胰岛素样生长因子1(IGF-1)对大鼠结肠平滑肌细胞(SMC)表达干细胞因子(SCF)的影响.
方法: 酶解法分离培养SD大鼠结肠SMC、α-actin免疫荧光鉴定, 然后将大鼠结肠SMC随机分为IGF-1不同浓度(0、5、10、50、100、150 μg/L)、时间(0、8、16、24、48 h)及IGF-1α受体(IGF-1Rα)抗体(0、50、100、150 μg/L)干预组; Western blot、RT-PCR法检测SMC合成SCF的变化.
结果: 低剂量IGF-1(5、10 μg/L)对SCF蛋白和mRNA表达无影响(P>0.05), 中高剂量IGF-1(50、100、150 μg/L)诱导其表达增加(均P<0.05), 100 μg/L可能为体外最大有效浓度(0.820±0.061 vs 0.167±0.015; 1.269±0.219 vs 0.560±0.023, 均P<0.05), 且其促SCF蛋白和mRNA合成的最高峰在第16小时(0.420±0.034 vs 0.209±0.001; 1.407±0.133 vs 0.477±0.041, 均P<0.05), IGF-1Rα抗体可抑制SCF蛋白和mRNA合成, 抑制作用呈浓度依赖性(P<0.05).
结论: IGF-1能通过作用于SMC上的IGF-1受体刺激大鼠结肠SMC内SCF的表达.
引文著录: 宁月季, 张蔚, 成家飞, 李学良, 王美峰, 林琳. 胰岛素样生长因子1对大鼠结肠平滑肌细胞中干细胞因子表达的影响. 世界华人消化杂志 2009; 17(34): 3502-3506
Revised: November 22, 2009
Accepted: November 23, 2009
Published online: December 8, 2009
AIM: To investigate the effects of insulin-like growth factor-1 (IGF-1) on the expression of stem cell factor (SCF) in rat colonic smooth muscle cells (SMCs).
METHODS: Rat colonic SMCs were separated, cultured, and identified by immunofluorescence staining of α-actin. Cultured colonic SMCs were divided into IGF-1 treatment group and IGF-1 receptor antibody intervention group. Cells in the IGF-1 treatment group incubated with different concentrations (0, 5, 10, 50, 100 and 150 μg/L) of IGF-1 for different durations (0, 8, 16, 24 and 48 hours), while those in the IGF-1 receptor antibody intervention group were treated with IGF-1 and different concentrations of IGF-1 receptor monoclonal antibody (0, 50, 100 and 150 μg/L). The expression of SCF in colonic SMCs was examined by Western blot and quantitative reverse transcription-polymerase chain reaction.
RESULTS: Although IGF-1 at low concentrations (5 and 10 μg/L) had no significant impact on the expression of SCF mRNA and protein in SMCs (all P > 0.05), IGF-1 at moderate or high concentrations (50, 100 and 150 μg/L) significantly upregulated the expression of SCF mRNA and protein (all P < 0.05). The optimum concentration of IGF-1 to upregulate SCF expression in vitro was 100 μg/L (0.820 ± 0.061 vs 0.167 ± 0.015 and 1.269 ± 0.219 vs 0.560 ± 0.023, respectively; both P < 0.05), and the peak expression of SCF occurred 16 hours after incubation with IGF-1 (0.420 ± 0.034 vs 0.209 ± 0.001 and 1.407 ± 0.133 vs 0.477 ± 0.041, respectively; both P < 0.05). IGF-1 receptor monoclonal antibody could inhibit the expression of SCF in SMCs in a dose-dependent manner (all P < 0.05).
CONCLUSION: IGF-1 can upregulate the expression of SCF in colonic SMCs perhaps in an IGF-1 receptor-dependent manner.
- Citation: Ning YJ, Zhang W, Cheng JF, Li XL, Wang MF, Lin L. Insulin-like growth factor-1 upregulates the expression of stem cell factor in rat colonic smooth muscle cells. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3502-3506
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3502.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3502
Cajal间质细胞(interstitial cells of Cajal, ICC)是胃肠动力的起搏细胞, 且调节电活动的扩布和参与神经冲动的传导[1-2]; 许多胃肠动力障碍性疾病与胃肠道ICC的缺失或病变有关[3-7]. 干细胞因子(stem cell factor, SCF)是一种多功能细胞因子, 是胃肠道ICC生长、功能及表型维持的主要调控因子, 胃肠动力性疾病中SCF下降可能是ICC数量减少和超微结构改变的直接原因[8-10]. 研究发现[11], 胰岛素样生长因子1(insulin-like growth factor 1, IGF-1)可能通过胃平滑肌细胞(smooth muscle cell, SMC)调控SCF的合成, 进而对胃ICC具有保护作用. 我们前期实验发现, IGF-1能促进体外培养的胃SMC合成SCF, 其对结肠SMC的作用不清楚, 本研究从细胞水平探讨IGF-1对大鼠结肠SMC表达SCF的影响.
SD大鼠, 雌雄不拘, 体质量150-200 g, 由南京医科大学医学实验动物中心提供. DMEM培养液、胎牛血清、Ⅱ型胶原酶、大豆胰蛋白酶抑制剂(Gibco, USA), 重组大鼠IGF-1(R&D, UK), IGF-IRα抗体(Abcam, UK), SCF抗体(Santa Cruz, USA), α-actin抗体(北京博奥森公司), SCF引物(南京博尔迪生物科技公司).
1.2.1 结肠SMC的分离和培养: SD大鼠断椎处死, 快速自肛门上2 cm取结肠10 cm左右, 用含抗生素的Hepes-Ringer缓冲液反复冲洗, 去除黏膜层和浆膜层. 将平滑肌组织剪碎匀浆, 置入消化液(0.1%的Ⅱ型胶原酶和0.01%的大豆胰蛋白酶抑制剂)中, 30 ℃孵育20 min、离心、弃消化液, 反复2次, 加含100 mL/L胎牛血清的DMEM培养液中止消化、离心, DMEM培养液重悬细胞, 过筛; 台盼蓝染色确认细胞活力>90%, 于37 ℃ 950 mL/L O2和50 mL/L CO2条件下培养, SMC长至致密单层时, 传代培养. 采用第3-5代SMC进行实验.
1.2.2 结肠SMC的鉴定: 取对数生长的SMC, 胰蛋白酶消化, 制成单细胞悬液; 将SMC接种到放置载玻片的培养皿中, 置CO2孵箱中培养1-3 d, 待SMC长至单层时, 取出载玻片. PBS冲洗、丙酮固定, 3% H2O2阻断内源性过氧化物酶; 滴加α-actin一抗(1:100), 4 ℃过夜, PBS冲洗, 滴加罗丹明标记的羊抗兔IgG二抗, 室温避光湿盒中孵育1 h, PBS冲洗, 滴加Hoechst染核, PBS冲洗、封片, 观察特异性荧光.
1.2.3 分组与处理: 将2.5×108/L的SMC接种于含100 mL/L胎牛血清的DMEM培养液中培养至融和后, PBS洗涤, 加入无胎牛血清的培养基饥饿24 h. 分组: IGF-1不同时间组、IGF-1不同浓度组、IGF-1+不同浓度IGF-1Rα抗体组. IGF-1不同时间组: SMC+IGF-1(100 μg/L), 分别培养0, 8, 16, 24和48 h. IGF-1不同浓度组: SMC+IGF-1(0, 5, 10, 50, 100, 150 μg/L)培养16 h. IGF-1+IGF-1R抗体组: SMC+IGF-1(100 μg/L)与不同浓度的IGF-1R抗体(0, 50, 100, 150 μg/L)培养16 h. 以上实验重复3次.
1.2.4 Western blot法检测SMC中SCF蛋白: 蛋白裂解液提取各组细胞蛋白, BCA法测定蛋白浓度. 60 μg蛋白/泳道加样恒流30 mA电泳, 恒压100 V转膜55 min, 封闭2 h. 加入SCF一抗(1:100), 4 ℃过夜; 二抗1:5000, 37 ℃孵育, 曝光、显影.
1.2.5 RT-PCR法检测SMC中SCF mRNA: 按TRIzol试剂说明提取各组细胞总mRNA, 逆转录为cDNA, 以此cDNA为模板行PCR扩增. PCR反应条件: 94 ℃预变性5 min、94 ℃变性15 s、55 ℃退火30 s、72 ℃延伸15 s、共循环30次, 最后于72 ℃延伸8 min, PCR产物经3%琼脂糖凝胶电泳, 观测、拍照. SCF上游引物: 5'-TTCGCTTGTAATTGGCTTTGC-3'; 下游引物5'-CAACTGCCCTTGTAAGACTTGA-3'(76 bp, NM_021843); GAPDH上游引物: 5'-CCCCCAATGTATCCGTTGTG-3'; 下游引物5'-TAGCCCAGGATGCCCTTTAGT-3'(118 bp, BC059110).
统计学处理 所有数据录入SPSS10.0软件包分析, 以mean±SD表示, 采用方差分析和成组t检验, P<0.05为有显著性差异.
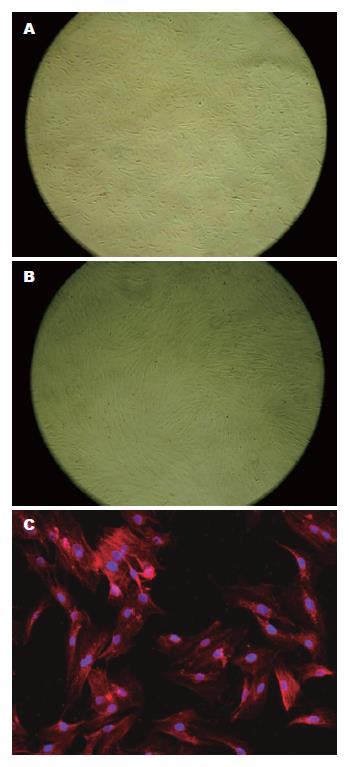
结肠SMC培养24 h后, 可见细胞贴壁, 呈三角形或梭形, 有少量突起; 3-5 d开始增殖(图1A); 14 d后细胞密集, 呈峰谷样生长(图1B). α-actin免疫荧光阳性反应: 大部分多角形细胞胞质内见红色荧光, 细胞核Hoechst染色呈蓝色(图1C).
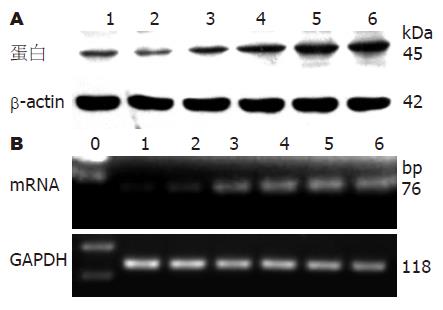
低浓度IGF-1(5, 10 μg/L)对SMC中SCF蛋白和mRNA表达无影响(P>0.05, 表1, 图2), IGF-1在50 μg/L时, SCF表达增加(P<0.05, 表1, 图2), 在100 μg/L时表达最多(P<0.05, 表1, 图2), 150 μg/L时仍显著促进SCF蛋白和mRNA的表达(类似100 μg/L时, P<0.05, 表1, 图2).
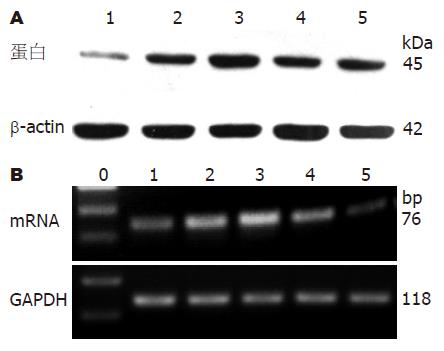
IGF-1在100 μg/L时, 促进SMC内SCF蛋白和mRNA的表达呈时间依赖性地升高, 16 h达最高(P<0.05, 表2, 图3), 此后逐渐下降; 48 h与0 h对SCF作用无统计学差异(P>0.05, 表2, 图3).
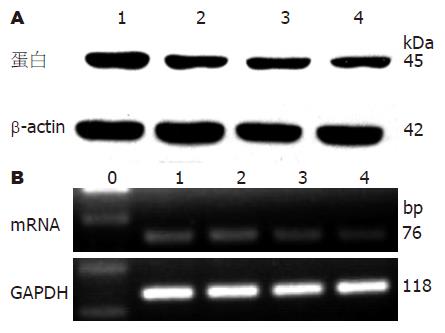
加入IGF-1(100 μg/L)与不同浓度的IGF-1R(IGF-1Rα)抗体后, 随抗体浓度的增高, SCF蛋白和mRNA的表达愈加减少, 各浓度组之间有统计学差异(P<0.05, 表3, 图4).
ICC以网络状分布于胃肠神经末梢及平滑肌之间, ICC、肠神经细胞和SMC构成"功能元件", 共同调控胃肠道的各种生理功能. 研究已证实ICC的缺失或病变是胃肠动力障碍重要原因之一, 包括糖尿病胃肠病变时, 均存在ICC破坏[3-7].
SCF是c-kit的天然配体, SCF与kit结合后形成SCF-kit信号系统, 在造血细胞、肥大细胞、生殖细胞以及黑色素细胞的发育中起关键作用, 研究证实[9-10,12], SCF在胃肠道ICC的发育、增殖和表型维持过程中起关键作用, SCF减少与胃肠动力相关的ICC异常有关. 人体SCF可由成纤维细胞、角蛋白细胞、内皮细胞、骨髓、小细胞肺癌细胞等产生, 胃肠道SCF可来自SMC、肠神经元细胞, 研究发现[11], 维持胃肠ICC所需的SCF可能来源于胃肠SMC. 大量研究表明[3,13-16], IGF-1、一氧化氮(NO)、5-HT、血红素氧化酶-1(HO-1)及IL-9等因素均与ICC的生存和表型维持有关. 但IGF-1保护胃肠ICC的分子机制不清? Horváthet al[11]离体培养DM小鼠胃窦和胃体组织, 给予胰岛素或IGF-1, 可完全阻止ICC的减少, 认为DM病程中, 胃SMC萎缩、合成SCF减少, 导致ICC病变, 因此推测IGF-1刺激胃SMC表达SCF, 进而对ICC起调控作用. 我们前期实验提示, 体外培养胃SMC, 给予IGF-1可促进SCF表达增加. 由于胃肠道不同部位ICC的分布不同, 且胃肠道不同部位及不同亚型的ICC对SCF的需求量亦不同[17-19], 因此, 结肠SMC在IGF-1作用下是否表达SCF增加, 还不清楚. 本实验培养结肠SMC显示, 中高剂量的IGF-1可明显促进结肠SMC合成SCF, 且体外IGF-1在100 μg/L、作用16 h, 促进结肠SMC合成SCF的作用最强, 提示IGF-1以浓度和时间依赖性方式诱导结肠SMC表达SCF.
IGF-1是胰岛素样生长因子家族中的一种, 含70个氨基酸, 相对分子质量为7649 Da, 主要由肝脏分泌, 以内分泌、自分泌、旁分泌的方式, 与靶细胞表面的IGF-1R结合, 对外周组织、细胞起生理和病理调节作用[20]. IGF-1R是一种具有酪氨酸激酶活性的跨膜蛋白质, 包括两个α亚基和两个β亚基, α亚基位于细胞膜外侧, β亚基位于细胞膜内侧, IGF-1首先与α亚基结合, 激活β亚基上的酪氨酸激酶, 使之磷酸化, 引起胞质内一系列的信号级联反应和基因转录, 从而产生IGF-1的生物学效应. 本实验中, IGF-1Rα抗体以浓度依赖性的方式抑制结肠SMC合成SCF, 提示IGF-1可与结肠SMC胞膜上IGF-1Rα结合, 促进SCF的合成.
总之, 本实验初步证实了体外IGF-1可诱导结肠SMC产生SCF, 且可能通过SMC上的IGF-1受体. IGF-1使SMC表面的IGF-1R磷酸化后, 引起的细胞内机制尚待进一步研究. 为进一步探讨SCF的调控、相应的干预方法、促使SCF的合成以及为ICC的保护、治疗胃肠动力障碍提供了实验依据.
胃肠动力障碍性疾病的发病机制目前仍不清楚, 临床缺乏有效的治疗手段, 随着对ICC间质细胞功能的研究日益增多, 发现IGF-1是ICC间质细胞的保护因子. IGF-1有望成为治疗该病新的突破口.
宛新建, 副教授, 上海市第一人民医院消化内科
Horvath et al离体培养糖尿病小鼠胃窦和胃体组织, 给予IGF-1, 可完全阻止ICC间质细胞的减少. 该研究提示IGF-1可能刺激平滑肌细胞表达干细胞因子, 进而对ICC间质细胞起调控作用.
本研究首次在体外培养结肠平滑肌细胞, 应用外源性IGF-1对结肠平滑肌细胞进行干预, 结果验证了其对结肠平滑肌细胞产生干细胞因子的显著影响.
本研究证实了, IGF-1能通过作用于SMC上的IGF-1受体刺激大鼠结肠SMC内SCF的表达, 为临床治疗胃肠动力障碍性疾病提供新的理论依据.
本研究的内容具有重要的价值和新颖性, 客观地反映了IGF-1对结肠SMC表达SCF的影响, 有较好的可读性.
编辑: 李军亮 电编: 何基才
| 1. | Wang XY, Sanders KM, Ward SM. Intimate relationship between interstitial cells of cajal and enteric nerves in the guinea-pig small intestine. Cell Tissue Res. 1999;295:247-256. [PubMed] [DOI] |
| 2. | Kito Y, Ward SM, Sanders KM. Pacemaker potentials generated by interstitial cells of Cajal in the murine intestine. Am J Physiol Cell Physiol. 2005;288:C710-C720. [PubMed] [DOI] |
| 3. | Horváth VJ, Vittal H, Ordög T. Reduced insulin and IGF-I signaling, not hyperglycemia, underlies the diabetes-associated depletion of interstitial cells of Cajal in the murine stomach. Diabetes. 2005;54:1528-1533. [PubMed] [DOI] |
| 4. | Forster J, Damjanov I, Lin Z, Sarosiek I, Wetzel P, McCallum RW. Absence of the interstitial cells of Cajal in patients with gastroparesis and correlation with clinical findings. J Gastrointest Surg. 2005;9:102-108. [PubMed] [DOI] |
| 5. | Battaglia E, Bassotti G, Bellone G, Dughera L, Serra AM, Chiusa L, Repici A, Mioli P, Emanuelli G. Loss of interstitial cells of Cajal network in severe idiopathic gastroparesis. World J Gastroenterol. 2006;12:6172-6177. [PubMed] |
| 6. | Iwasaki H, Kajimura M, Osawa S, Kanaoka S, Furuta T, Ikuma M, Hishida A. A deficiency of gastric interstitial cells of Cajal accompanied by decreased expression of neuronal nitric oxide synthase and substance P in patients with type 2 diabetes mellitus. J Gastroenterol. 2006;41:1076-1087. [PubMed] [DOI] |
| 7. | Wang XY, Huizinga JD, Diamond J, Liu LW. Loss of intramuscular and submuscular interstitial cells of Cajal and associated enteric nerves is related to decreased gastric emptying in streptozotocin-induced diabetes. Neurogastroenterol Motil. 2009;21:e1095-e1092. [PubMed] [DOI] |
| 11. | Horváth VJ, Vittal H, Lörincz A, Chen H, Almeida-Porada G, Redelman D, Ordög T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology. 2006;130:759-770. [PubMed] [DOI] |
| 12. | Sanders KM, Ward SM. Interstitial cells of Cajal: a new perspective on smooth muscle function. J Physiol. 2006;576:721-726. [PubMed] [DOI] |
| 13. | Choi KM, Gibbons SJ, Roeder JL, Lurken MS, Zhu J, Wouters MM, Miller SM, Szurszewski JH, Farrugia G. Regulation of interstitial cells of Cajal in the mouse gastric body by neuronal nitric oxide. Neurogastroenterol Motil. 2007;19:585-595. [PubMed] [DOI] |
| 14. | Wouters MM, Gibbons SJ, Roeder JL, Distad M, Ou Y, Strege PR, Szurszewski JH, Farrugia G. Exogenous serotonin regulates proliferation of interstitial cells of Cajal in mouse jejunum through 5-HT2B receptors. Gastroenterology. 2007;133:897-906. [PubMed] [DOI] |
| 15. | Choi KM, Gibbons SJ, Nguyen TV, Stoltz GJ, Lurken MS, Ordog T, Szurszewski JH, Farrugia G. Heme oxygenase-1 protects interstitial cells of Cajal from oxidative stress and reverses diabetic gastroparesis. Gastroenterology. 2008;135:2055-2064, 2064.e1-2064.e2. [PubMed] |
| 16. | Ye J, Zhu Y, Khan WI, Van Snick J, Huizinga JD. IL-9 enhances growth of ICC, maintains network structure and strengthens rhythmicity of contraction in culture. J Cell Mol Med. 2006;10:687-694. [PubMed] [DOI] |
| 17. | Ordög T, Baldo M, Danko R, Sanders KM. Plasticity of electrical pacemaking by interstitial cells of Cajal and gastric dysrhythmias in W/W mutant mice. Gastroenterology. 2002;123:2028-2040. [PubMed] [DOI] |
| 18. | Fox EA, Phillips RJ, Byerly MS, Baronowsky EA, Chi MM, Powley TL. Selective loss of vagal intramuscular mechanoreceptors in mice mutant for steel factor, the c-Kit receptor ligand. Anat Embryol (Berl). 2002;205:325-342. [PubMed] [DOI] |
| 19. | Seki K, Komuro T. Distribution of interstitial cells of Cajal and gap junction protein, Cx 43 in the stomach of wild-type and W/Wv mutant mice. Anat Embryol (Berl). 2002;206:57-65. [PubMed] [DOI] |
| 20. | Lim HJ, Park HY, Ko YG, Lee SH, Cho SY, Lee EJ, Jameson JL, Jang Y. Dominant negative insulin-like growth factor-1 receptor inhibits neointimal formation through suppression of vascular smooth muscle cell migration and proliferation, and induction of apoptosis. Biochem Biophys Res Commun. 2004;325:1106-1114. [PubMed] [DOI] |