修回日期: 2009-09-29
接受日期: 2009-10-12
在线出版日期: 2009-12-08
目的: 探讨Ghrelin对胃外分泌功能的作用.
方法: 从断奶大鼠中获得新鲜胃黏膜组织. 分离培养胃黏膜上皮细胞, 培养30 h后, 实验组换为分别含有1×10-4、1×10-3、1×10-2和1×10-1 μmol/L Ghrelin的新鲜培养液, 对照组换为不含Ghrelin的正常新鲜培养液. 继续培养4 h, 收集培养液和细胞, 分别测定细胞的相对活性(MTT法)、培养液中胃蛋白酶活性、细胞中H+-K+-ATPase mRNA表达和活性.
结果: 实验组中细胞的相对活性与对照组相比没有发生明显的变化; 1×10-3 µmol/L Ghrelin可显著提高胃蛋白酶的活性(P<0.05). 1×10-3 µmol/L Ghrelin可显著增加细胞中H+-K+-ATPase mRNA的表达(P<0.05), 1×10-4和1×10-3 μmol/L Ghrelin明显增加了胃黏膜上皮细胞中H+-K+-ATPase的活性(均P<0.05).
结论: Ghrelin体外作用于胃黏膜上皮细胞可刺激胃蛋白酶和胃酸的分泌.
引文著录: 杜改梅, 刘茂军, 陈钟鸣. Ghrelin对大鼠胃黏膜上皮细胞胃酸分泌的调节作用. 世界华人消化杂志 2009; 17(34): 3486-3490
Revised: September 29, 2009
Accepted: October 12, 2009
Published online: December 8, 2009
AIM: To investigate the effects of ghrelin on gastric exocrine secretion.
METHODS: Gastric mucosa was obtained from weaned rats. Gastric mucosal cells were dispersed from freshly obtained gastric mucosa and divided into two groups: treatment group and control group. The treatment group was incubated with fresh culture medium containing different concentrations of ghrelin (1 × 10-4, 1×10-3, 1 × 10-2 and 1 × 10-1 μmol/L), while the control group was incubated with fresh culture medium without ghrelin. Four hours after incubation, culture supernatants were collected, and cells were harvested. Cell viability was measured by methyl thiazolyl tetrazolium (MTT) assay. Pepsin activity and H+-K+-ATPase mRNA expression and activity were evaluated.
RESULTS: No significant difference was noted in cell viability between the control group and treatment group. Ghrelin at a concentration of 1 × 10-3 μmol/L significantly augmented pepsin activity and H+-K+-ATPase mRNA expression (both P < 0.05). Ghrelin at a concentration of 1 × 10-4 and 1 × 10-3 μmol/L significantly increased H+-K+-ATPase activity in gastric mucosal cells (both P < 0.05).
CONCLUSION: Ghrelin can significantly stimulate the secretion of both pepsin and gastric acid by gastric mucosal cells in vitro.
- Citation: Du GM, Liu MJ, Chen ZM. Ghrelin stimulates gastric acid secretion by rat gastric mucosal cells in vitro. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3486-3490
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3486.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3486
胃功能发育缓慢, 胃酸和胃蛋白酶分泌不足是导致新生动物腹泻、生长缓慢的主要原因之一[1]. 曾有研究发现, 在新生动物日粮中添加有机酸的方法来降低腹泻率, 取得了较好的效果, 但存在较多弊端. 一方面添加的剂量较难掌握, 剂量太高, 影响饲料适口性和动物采食量; 另一方面添加酸性物质可通过负反馈作用抑制胃泌素的分泌, 从而抑制动物自身的胃酸分泌能力[1-2]. 因此, 如何激发动物内源性的胃酸分泌能力, 促进胃功能的发育成为研究人员和养殖业最关注的问题.
Ghrelin是1999年由日本发现的一种由A-like细胞分泌的一种28个氨基酸残基组成的新脑肠肽, 又名生长素[3]. Ghrelin具有许多生物学功能, 如促进垂体生长激素的释放, 促进动物采食, 增加体质量, 调节能量平衡, 促进胃排空和胃酸分泌等[4-6]. Sibilia et al和Trudel et al研究证明, Ghrelin在消化系中具有许多功能性作用, 如调节胃肠运动, 保护胃黏膜免受乙醇和应激等引起的损伤, 促进胃酸分泌, 肠上皮细胞的更新等[7-8]. Ariyasu et al研究发现, 切除胃中产酸区域, 血清Ghrelin浓度显著下降, 提示Ghrelin与胃酸分泌有密切的关系[4]. 近年来, 虽然大多研究均已证明Ghrelin可以促进胃肠道运动和排空[9-10], 但关于Ghrelin对胃酸分泌的作用目前仍然存在争议, 尚待作进一步的研究. 研究发现, 给小鼠脑室内注射Ghrelin, 引起小鼠剂量依赖性的胃酸分泌, 迷走神经切断或给予阿托品后, 能阻断Ghrelin引起的胃酸分泌增多, 提示Ghrelin对胃酸分泌的促进作用主要是通过中枢神经系统来调节[11], 然而, Ghrelin的外周作用并不能被忽视. Ghrelin对体外培养的胃黏膜上皮细胞功能的影响尚未见报道.
胃蛋白酶原主要由胃底主细胞分泌, 然后经胃酸刺激成为有活性的胃蛋白酶, 才能参与胃肠道的消化功能. 胃蛋白酶作用的适宜环境约为pH 2, 在pH值大于6时, 酶活性消失[12]. 质子泵, 又名H+-K+-ATP酶(H+-K+-ATPase), 专一性地存在于壁细胞中, 是胃酸分泌的分子基础, 也是调控壁细胞泌酸的最后通道. H+-K+-ATPase表达和活性的增高, 标志着胃酸分泌能力的增强[13]. 因此, H+-K+-ATPase的活性可以作为评价壁细胞泌酸能力的一个重要指标. 本研究主要采用大鼠为动物模型, 探索Ghrelin对断奶大鼠胃蛋白酶和胃酸分泌的体外作用.
Ghrelin购自美国Peptide公司. H+-K+-ATPase Kit购自南京建成生物有限公司. Trypsin、MTT、DMEM/F-12和HEPES分别购自Sigma、Gibco和Hyclone. 胎牛血清购自杭州四季青公司. 反转录酶(MMLV)、DNA聚合酶(Taq)和RNA酶抑制剂(RNase inhibitor)购自Promega公司.
1.2.1 细胞培养和处理: 断颈处死断奶SD大鼠(体质量48 g), 迅速取出胃, 用4 ℃含有双抗(青霉素500 kU/L和链霉素500 kU/L)的D-Hanks液洗去胃内容物, 分离胃黏膜, 按照Terano et al[14]的方法, 略加改进, 进行胃黏膜上皮细胞的培养. 用含有双抗(100 kU/L青霉素和100 kU/L链霉素)的D-Hank's液反复冲洗胃黏膜, 直到洗液不再混浊为止. 将胃黏膜剪成1 mm3左右的小块, 在37 ℃, 用0.15%的胰蛋白酶消化20-30 min, 铜网过滤后离心5 min(1000 r/min). 然后将离心的沉淀用D-Hank's液冲洗1次, 再离心5 min(1000 r/min), 重复2次后将沉淀用DEME/F-12(含有10%的胎牛血清和双抗)悬浮, 制成细胞悬液, 用0.1%台盼蓝染色检测细胞存活率在95%以上. 将细胞密度调整至2×106个/mL, 接种到12孔培养板上, 然后将细胞放入CO2培养箱中进行培养(37 ℃, 5% CO2). 培养细胞分为6组, 每组6个样本, 每个样本4孔. 细胞培养30 h后, 实验组换为分别含有1×10-4、1×10-3、1×10-2和1×10-1 μmol/L Ghrelin的新鲜培养液, 对照组换为不含Ghrelin的正常新鲜培养液. 继续培养4 h, 收集培养液和细胞, 分别测定培养液中胃蛋白酶和细胞中H+-K+-ATPase mRNA表达和活性.
1.2.2 MTT法测定细胞活力: 将大鼠胃黏膜上皮细胞培养于96孔板中, 培养30 h后, 实验组换为分别含有1×10-4、1×10-3、1×10-2和1×10-1 μmol/L Ghrelin的新鲜培养液, 继续培养4 h, 然后在每孔培养液中均加入20 µL MTT液, 再继续培养3-4 h. 然后从每个培养孔中均吸去100 µL培养液, 再加入等量的20% SDS(sodium dodecyl sulfate)-50% DMF(dimethylformamide), 在微型振荡器上振荡5 min, 37 ℃孵育4 h, 在酶标仪上测光吸光度值(A值)(波长490 nm, 参考波长560 nm).
1.2.3 胃蛋白酶活性: 采用常规生物化学方法进行测定, 主要步骤如下: 培养结束后收集细胞培养液, 用DAB9[15]法测培养液中总胃蛋白酶活性, 同时用考马斯亮蓝法测培养液中总蛋白质浓度, 计算方法为: 胃黏膜上皮细胞培养液中总胃蛋白酶比活(U/g) = 胃黏膜上皮细胞培养液中总胃蛋白酶活性(U/mL)/胃黏膜上皮细胞培养液中总蛋白质浓度(g/mL).
1.2.4 相对定量RT-PCR: (1)总RNA提取: 采用总RNA提取试剂盒(TRIzol法)提取胃组织样的总RNA. 用紫外分光光度计测定总RNA浓度(260 nm), 并通过1.4%的琼脂糖-甲醛变性凝胶电泳检验总RNA的质量. (2)反转录(RT): 用随机引物对样品的RNA进行RT, 获得RNA的cDNA(RT产物). RT反应总体积25 µL, 包括2 µg总RNA, 0.4 µmol/L随机引物, 0.4 mmol/L dNTP, 加ddH2O至10 µL, 70 ℃变性5 min, 立即放冰上冷却, 再加8 U RNA酶抑制剂, 100 U M-MLV反转录酶, 5 µL 5×RT Buffer(含250 mmol/L pH 8.3 Tris-HCl, 15 mmol/L MgCl2, 375 mmol/L KCl, 50 mmol/L DTT), 补充DEPC处理水至25 µL, 37 ℃反应60 min, 95 ℃反应5 min. 同时用不加反转录酶的反转录体系作为阴性对照(C1), 用于检测总RNA样品中是否有基因组DNA污染. 反转录产物(RT产物)-20 ℃保存备用. (3)引物设计及PCR扩增条件: H+-K+-ATPase引物根据GenBank(M22724)提供的全序列设计. 上游引物序列为: 5'-GAGAACCACCACCTACAAG-3', 下游引物序列为: 5'-CAACAGCGAACTCCAAG-3', 由大连宝生物工程公司合成, 预期PCR产物长度为362 bp. PCR反应体积25 µL, 含模板(RT产物)2 µL, 0.5 U Taq DNA聚合酶, 2.5 µL 10×PCR Buffer(含50 mmol/L Tris-HCl pH 9.0, 100 mmol/L NaCl, 1.0 mmol/L DTT, 0.1 mmol/L EDTA, 500 mL/L glycerol, 10 g/L Triton X-100), 0.2 mmol/L dNTP, 1.0-2.0 mmol/L MgCl2, 0.2 µmol/L H+-K+-ATPase引物, 0.02-0.03 µmol/L 18S rRNA内标. PCR扩增条件为: 94 ℃预变性5 min; 94 ℃变性30 s, 56 ℃复性30 s, 72 ℃延伸40 s, 共26个循环; 72 ℃终延伸10 min. H+-K+-ATPase, PCR反应分别在26个循环时, 18S rRNA和目的基因的PCR产物均在线性扩增范围. 每个样品至少作3次重复, 同时用ddH2O和RNA样品分别取代RT产物作对照, 以检验是否有外源和基因组DNA污染. (4)电泳及灰度分析: 取20 µL PCR产物在含EB的2.0%琼脂糖凝胶上电泳. 图像处理及灰度分析, 根据H+-K+-ATPase和18S PCR产物的灰度比, 确定样品中H+-K+-ATPase mRNA表达的相对含量.
1.2.5 H+-K+-ATPase活性测定: 细胞培养结束后, 吸去培养液, 每孔加入1 mL 0.2%的TritonX-100, 反复吹吸数次使细胞破碎, 然后收集细胞破碎液, 按试剂盒说明进行测定. 同时用考马斯亮蓝法测定细胞中总蛋白含量, 结果以反应1 h内H+-K+-ATPase磷酸化释放磷量和细胞中总蛋白含量比值来表示H+-K+-ATPase活性, 单位为µmol Pi/(mg prot·h). 也可以将细胞破碎液保存于-20 ℃冰箱待测酶活性.
统计学处理 所有数据用mean±SD表示. 采用SPSS11.0统计软件统计, 差异显著性检验采用单因子方差分析(One-way ANOVA, LSD).
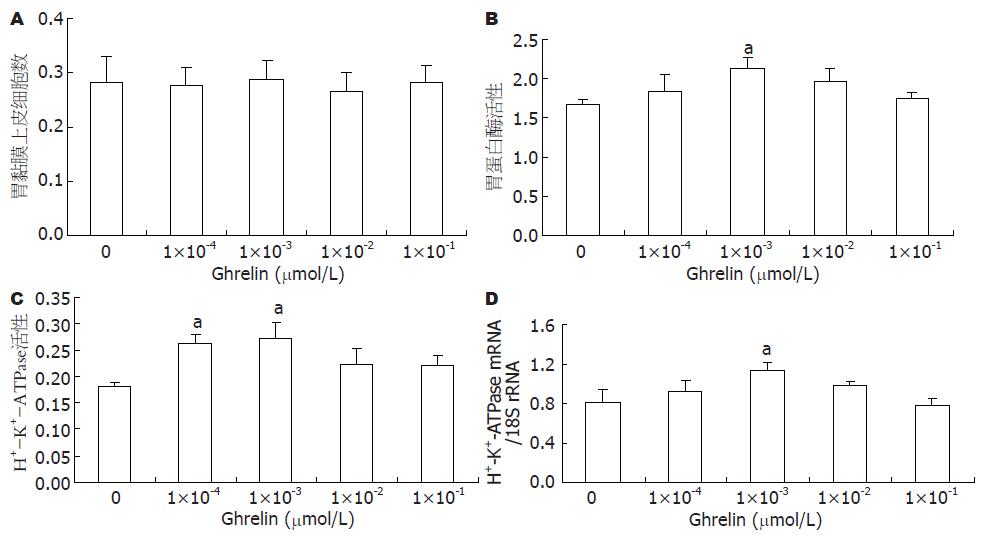
用MTT法检测大鼠胃黏膜上皮细胞的增殖, 结果发现细胞的相对活性与对照组相比没有发生明显的变化(图1A).
用不同剂量的Ghrelin处理培养的大鼠胃黏膜上皮细胞, 1×10-3 µmol/L Ghrelin可显著提高培养液中胃蛋白酶活性(图1B). 因为在pH 1.6的酸性条件下测定的培养液中胃蛋白酶活性, 反映的是总胃蛋白酶活性(包括被盐酸激活的胃蛋白酶原和有活性的胃蛋白酶), 所以该结果暗示Ghrelin对主细胞分泌胃蛋白酶原具有明显的促进作用.
从图1C中我们可以得知, 用1×10-4和1×10-3 Ghrelin处理细胞后, 胃黏膜上皮细胞中H+-K+-ATPase的活性与对照组相比明显增加(均P<0.05).
用不同剂量的Ghrelin处理培养的大鼠胃黏膜上皮细胞, 1×10-3 µmol/L Ghrelin可显著提高胃黏膜上皮细胞中H+-K+-ATPase mRNA的表达(图1D).
Ghrelin主要由位于胃泌酸区域的A-like分泌, 提示Ghrelin与胃酸分泌具有密切的关系[16]. 研究表明, 人和大鼠Ghrelin免疫活性细胞密集分布于胃的泌酸腺黏膜, 约占胃泌酸腺区内分泌细胞总数的20%, 在胃窦、十二指肠和空肠也发现Ghrelin免疫活性细胞[17]. 血清Ghrelin浓度会随着胃中产酸区域的切除而显著下降[4], 这表明Ghrelin与胃酸分泌有密切的关系. 有研究发现外源性Ghrelin能通过肠壁内在神经丛的胆碱能神经元促进大鼠在体和离体小肠运动[18]. 我们曾研究发现, 断奶前后仔猪胃黏膜Ghrelin mRNA的表达变化规律与胃黏膜H+-K+-ATPase的表达呈显著的正相关, 暗示Ghrelin可能参与胃酸分泌的调节[19]. 目前, 许多研究均已证明Ghrelin对胃排空确实具有明显的促进作用[8], 而他对胃酸分泌的作用仍然存在分歧[9,20-21], Date et al和Trudel et al分别给小鼠脑室内和大鼠静脉内注射Ghrelin, 发现均可引起剂量依赖性的胃酸分泌增多, 胃收缩增强[8,11]. Sibilia et al[20]研究证明大鼠脑室内注射Ghrelin对胃酸分泌有抑制作用. Dornonville et al[9]给大鼠皮下注射Ghrelin, 结果胃排空促进, 而胃酸分泌未受到任何促进或抑制作用. 这种分歧可能与Ghrelin的处理途径、剂量, 动物状态以及评估胃酸分泌能力的指标不同等有关.
H+-K+-ATP酶通过自身的磷酸化和去磷酸化, 将细胞外液中的K+转运入细胞内, 同时逆浓度梯度将细胞内的H+泵出细胞外, 完成H+/K+电中性跨膜离子转运和胃酸分泌功能[22]. 研究发现H+-K+-ATPase的表达和活性变化趋势与胃酸分泌能力相一致[23]. 因此通过测定H+-K+-ATPase的表达和活性可精确反映胃酸分泌能力. 以往的报道是以胃液pH值来衡量其胃酸分泌能力, 而胃液pH值反映的是动物自身分泌的盐酸、食糜和乳汁所形成的总酸度, 并且容易受到采食、饮水的影响[2], 因此胃液pH值并不能精确反映动物自身胃酸分泌的能力. 而本实验以胃酸分泌过程中的关键酶(H+-K+-ATPase)作为指标, 则更能准确衡量大鼠的胃酸分泌能力. 此外, Ghrelin主要通过与存在于胃肠道和胰腺中的受体结合来调节胃肠运动和胃酸分泌, 提示Ghrelin对胃功能的作用主要是通过中枢神经系统来调节的[11], 然而, Ghrelin的外周作用并不能被排除. 本研究通过培养胃黏膜上皮细胞进行了体外实验, 结果证明用一定剂量的Ghrelin处理体外培养的大鼠胃黏膜上皮细胞, 能明显促进胃黏膜上皮细胞中H+-K+-ATPase活性, 这首次研究表明Ghrelin可能不通过迷走神经和中枢神经系统也能促进胃酸的分泌. 胃蛋白酶原主要由胃黏膜主细胞分泌, 分泌后在胃酸的刺激下, 转变为具有活性的胃蛋白酶[12]. 本实验是在pH 1.6的酸性条件下测定的培养液中胃蛋白酶活性, 反映的是总胃蛋白酶活性(包括被盐酸激活的胃蛋白酶原和有活性的胃蛋白酶), 所以本研究结果Ghrelin可明显促进胃蛋白酶的活性, 表明Ghrelin对主细胞分泌胃蛋白酶原具有明显的促进作用. 然而Ghrelin是直接作用于壁细胞和主细胞还是间接作用于胃黏膜其他细胞来调节胃酸和胃蛋白酶原的分泌, 还需要进行进一步的研究. 然而, 用Ghrelin处理培养的大鼠胃黏膜上皮细胞, 细胞的相对活性没有发生显著的变化, 这可能与MTT检测方法的敏感性和特异性有关.
本研究证明Ghrelin可以作用于体外培养的胃黏膜上皮细胞, 促进胃蛋白酶活性和H+-K+-ATP酶活性, 但其作用机制还需要进行进一步研究.
生长素(Ghrelin)是一种主要由胃内分泌细胞分泌的一种新的脑肠肽, 他与其受体结合可以发挥许多生物学功能, 其中发现Ghrelin对胃肠道的结构和功能具有重要的调节作用. 许多研究证明Ghrelin可以促进胃肠运动, 而其对胃功能发育的作用尚不清楚. 目前虽然有许多有关Ghrelin对胃酸分泌的研究报道, 但结果仍然存在争议.
白爱平, 副教授, 南昌大学第一附属医院消化内科
Ghrelin作为一种重要的胃肠道激素. 是否对胃功能发育具有一定的调节作用? Ghrelin是否可以通过外周途径来调节胃的结构和功能发育都成为研究人员最关注的问题.
Sibilia et al研究证明大鼠脑室内注射Ghrelin对胃酸分泌有抑制作用. 而Dornonville et al给大鼠皮下注射Ghrelin, 结果胃排空促进, 而胃酸分泌未受到任何促进或抑制作用.
本研究为了排除体内多种因素的影响, 首次通过体外培养胃黏膜上皮细胞来研究Ghrelin对胃功能发育的外周作用. 以往研究多以胃液pH值来衡量其胃酸分泌能力, 而胃液pH值不能精确反映动物自身胃酸分泌的能力. 为了避免采食、饮水等食糜的影响, 本研究则主要以胃酸分泌过程中的关键酶-H+-K+-ATPase作为指标, 更能准确衡量胃酸的分泌能力.
本研究探讨了Ghrelin对大鼠胃黏膜上皮细胞胃酸分泌的调节作用, 有一定学术价值和可读性.
编辑: 李军亮 电编: 何基才
| 3. | Kojima M, Hosoda H, Date Y, Nakazato M, Matsuo H, Kangawa K. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 1999;402:656-660. [PubMed] [DOI] |
| 4. | Ariyasu H, Takaya K, Tagami T, Ogawa Y, Hosoda K, Akamizu T, Suda M, Koh T, Natsui K, Toyooka S. Stomach is a major source of circulating ghrelin, and feeding state determines plasma ghrelin-like immunoreactivity levels in humans. J Clin Endocrinol Metab. 2001;86:4753-4758. [PubMed] [DOI] |
| 5. | Okimura Y, Ukai K, Hosoda H, Murata M, Iguchi G, Iida K, Kaji H, Kojima M, Kangawa K, Chihara K. The role of circulating ghrelin in growth hormone (GH) secretion in freely moving male rats. Life Sci. 2003;72:2517-2524. [PubMed] [DOI] |
| 6. | Rubino F, Zizzari P, Tomasetto C, Bluet-Pajot MT, Forgione A, Vix M, Grouselle D, Marescaux J. The role of the small bowel in the regulation of circulating ghrelin levels and food intake in the obese Zucker rat. Endocrinology. 2005;146:1745-1751. [PubMed] [DOI] |
| 7. | Sibilia V, Rindi G, Pagani F, Rapetti D, Locatelli V, Torsello A, Campanini N, Deghenghi R, Netti C. Ghrelin protects against ethanol-induced gastric ulcers in rats: studies on the mechanisms of action. Endocrinology. 2003;144:353-359. [PubMed] [DOI] |
| 8. | Trudel L, Tomasetto C, Rio MC, Bouin M, Plourde V, Eberling P, Poitras P. Ghrelin/motilin-related peptide is a potent prokinetic to reverse gastric postoperative ileus in rat. Am J Physiol Gastrointest Liver Physiol. 2002;282:G948-G952. [PubMed] |
| 9. | Dornonville de la Cour C, Lindström E, Norlén P, Håkanson R. Ghrelin stimulates gastric emptying but is without effect on acid secretion and gastric endocrine cells. Regul Pept. 2004;120:23-32. [PubMed] [DOI] |
| 10. | Peeters TL. Central and peripheral mechanisms by which ghrelin regulates gut motility. J Physiol Pharmacol. 2003;54 Suppl 4:95-103. [PubMed] |
| 11. | Date Y, Nakazato M, Murakami N, Kojima M, Kangawa K, Matsukura S. Ghrelin acts in the central nervous system to stimulate gastric acid secretion. Biochem Biophys Res Commun. 2001;280:904-907. [PubMed] [DOI] |
| 12. | 陈 杰. 家畜生理学. 第4版. 北京: 中国农业出版社 2003; 151-157. |
| 13. | Wallmark B, Larsson H, Humble L. The relationship between gastric acid secretion and gastric H+,K+-ATPase activity. J Biol Chem. 1985;260:13681-13684. [PubMed] |
| 14. | Terano A, Ivey KJ, Stachura J, Sekhon S, Hosojima H, McKenzie WN Jr, Krause WJ, Wyche JH. Cell culture of rat gastric fundic mucosa. Gastroenterology. 1982;83:1280-1291. [PubMed] |
| 15. | Stellmach Bruno, 钱嘉渊. 酶的测定方法. 北京: 中国轻工业出版社 1992; 256-260. |
| 16. | Sakata I, Nakamura K, Yamazaki M, Matsubara M, Hayashi Y, Kangawa K, Sakai T. Ghrelin-producing cells exist as two types of cells, closed- and opened-type cells, in the rat gastrointestinal tract. Peptides. 2002;23:531-536. [PubMed] [DOI] |
| 17. | Date Y, Kojima M, Hosoda H, Sawaguchi A, Mondal MS, Suganuma T, Matsukura S, Kangawa K, Nakazato M. Ghrelin, a novel growth hormone-releasing acylated peptide, is synthesized in a distinct endocrine cell type in the gastrointestinal tracts of rats and humans. Endocrinology. 2000;141:4255-4261. [PubMed] [DOI] |
| 18. | Edholm T, Levin F, Hellström PM, Schmidt PT. Ghrelin stimulates motility in the small intestine of rats through intrinsic cholinergic neurons. Regul Pept. 2004;121:25-30. [PubMed] [DOI] |
| 19. | Du GM, Shi ZM, Wei XH, Liu MJ, Zhang L, Zhao RQ. Expression of gastric ghrelin and H(+)-K(+)-ATPase mRNA in weanling piglets and effect of ghrelin on H(+)-K(+)-ATPase expression and activity in gastric mucosal cells in vitro. Res Vet Sci. 2007;82:99-104. [PubMed] [DOI] |
| 20. | Sibilia V, Pagani F, Guidobono F, Locatelli V, Torsello A, Deghenghi R, Netti C. Evidence for a central inhibitory role of growth hormone secretagogues and ghrelin on gastric acid secretion in conscious rats. Neuroendocrinology. 2002;75:92-97. |
| 21. | Masuda Y, Tanaka T, Inomata N, Ohnuma N, Tanaka S, Itoh Z, Hosoda H, Kojima M, Kangawa K. Ghrelin stimulates gastric acid secretion and motility in rats. Biochem Biophys Res Commun. 2000;276:905-908. [PubMed] [DOI] |
| 22. | Yao X, Forte JG. Cell biology of acid secretion by the parietal cell. Annu Rev Physiol. 2003;65:103-131. [PubMed] [DOI] |
| 23. | Hervatin F, Benkouka F, Robert JC, Péranzi G, Soumarmon A. The ontogeny of rat gastric H+/K+-ATPase. Biochim Biophys Acta. 1989;985:320-324. [PubMed] [DOI] |