修回日期: 2009-11-09
接受日期: 2009-11-09
在线出版日期: 2009-11-28
目的: 探讨错配修复基因hMLH1和hMSH2在胃癌发生中的作用.
方法: 收集青岛大学医学院附属医院普外科手术切除的胃癌组织40例, 经病理诊断腺癌33例, 黏液腺癌7例, 患者术前均未接受放化疗和免疫治疗, 每例均取相应癌旁组织. 胃镜活检20例慢性胃炎黏膜组织(慢性浅表性胃炎10例, 慢性萎缩性胃炎10例). 采用Western blot法检测hMLH1和hMSH2蛋白在胃癌组织、癌旁组织及胃炎组织中的表达.
结果: 胃癌组织中hMSH2蛋白的表达显著高于癌旁组织和胃炎组织(0.28±0.10 vs 0.23±0.07, 0.11±0.10, 均P<0.01); hMLH1蛋白在胃炎组织和癌旁组织中的表达显著高于胃癌组织(0.28±0.07, 0.26±0.06 vs 0.22±0.06, 均P<0.01); hMLH1和hMSH2在胃癌中的表达与年龄、性别、肿瘤部位、肿瘤大小、浸润深度、组织学类型、分化程度、淋巴结转移、远处转移等无关, 差异均无显著性.
结论: hMSH2高表达可能是胃癌发生的标志之一, 而hMLH1则可能是胃癌预警组织的一种标志物.
引文著录: 夏頔, 刘希双, 杨堃, 隋爱华. 错配修复基因hMLH1和hMSH2在胃癌组织中的表达及意义. 世界华人消化杂志 2009; 17(33): 3446-3450
Revised: November 9, 2009
Accepted: November 9, 2009
Published online: November 28, 2009
AIM: To investigate the role of mismatch repair genes human mutL homolog 1 (hMLH1) and human mutL homolog 2 (hMSH2) in the carcinogenesis of gastric cancer.
METHODS: A total of 40 gastric cancer patients who underwent surgical resection at our hospital were included in the study, of which 33 were pathologically diagnosed as adenocarcinoma, and 7 as mucinous adenocarcinoma. All the patients did not underwent preoperative chemotherapy or immunotherapy. The gastric cancer specimens, matched cancer-adjacent tissue specimens, and 20 chronic gastritis mucosa specimens (10 diagnosed as chronic superficial gastritis by gastroscopic biopsy, and 10 as chronic atrophic gastritis) were collected. The expression of hMLH1 and hMSH2 proteins in these specimens was detected by Western blot.
RESULTS: The positive rate of hMSH2 expression in cancer tissue was significantly higher than those in cancer-adjacent tissue and gastritis mucosa tissue (0.28 ± 0.10 vs 0.23 ± 0.07 and 0.11 ± 0.10, respectively; both P < 0.01). The positive rate of hMLH1 expression in cancer tissue was significantly lower than those in cancer-adjacent tissue and gastritis mucosa tissue (0.22 ± 0.06 vs 0.28 ± 0.07, 0.26 ± 0.06, both P < 0.01). The positive rates of hMLH1 and hMSH2 expression were not correlated with various clinicopathological parameters in gastric cancer.
CONCLUSION: High hMSH2 expression and low hMLH1 expression may be potential markers for prediction of the development of gastric cancer.
- Citation: Xia D, Liu XS, Yang K, Sui AH. Significance of mismatch repair genes hMLH1 and hMSH2 expression in gastric cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3446-3450
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3446.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3446
胃癌是我国常见的恶性肿瘤之一, 每10万人口的年死亡率为25.12, 在各种恶性肿瘤中占首位. 肿瘤的发生需经过一个较长的、多步骤的过程, 涉及多个癌基因的激活和抑癌基因的失活. 近年来的研究表明, 错配修复基因(mismathc repair, MMR)的突变也参与肿瘤的发生. MMR是人体细胞的一种能修复DNA碱基错配的安全保障体系, 由一系列特异性修复DNA碱基错配的酶分子组成, 能修复各种因素所致的DNA碱基错配、小片段插入或缺失、小环形成等形式的DNA损伤和基因结构异常, 在维持基因结构稳定性、降低基因突变率、保证遗传信息稳定性方面起重要作用. 在以往对遗传性非息肉性大肠癌等遗传性肿瘤的研究中发现, MMR基因中hMLH1和hMSH2的异常改变具有突出地位[1]. 本研究采用Western blot法, 检测胃癌、癌旁和胃炎组织中hMLH1和hMSH2基因的表达情况, 探究胃癌发病的相关分子机制.
标本取自青岛大学医学院附属医院普外科手术切除的胃癌组织40例, 男25例, 女15例, 年龄36.3-78.6(平均年龄58.2)岁, 男女比5:3, 经病理诊断腺癌33例, 黏液腺癌7例. 患者术前均未接受放化疗和免疫治疗, 每例均取相应癌旁组织, 即距离癌组织边缘5 cm的组织. 胃镜活检20例慢性胃炎黏膜组织(慢性浅表性胃炎10例, 慢性萎缩性胃炎10例), 男9例, 女11例, 年龄21-67(平均年龄46.3)岁. 新鲜标本取出后置于-70 ℃冰箱保存备用. 抗hMSH2小鼠mAb(Santa Cruz Biotechnology, 稀释比例1:100), 抗hMLH1小鼠mAb(Santa Cruz Biotechnology, 稀释比例1:200), 内参GAPDH(联科生物, 原产美国, 稀释比例1:500), 辣根过氧化物酶标记山羊抗小鼠IgG(联科生物, 原产美国, 稀释比例1:2000).
1.2.1 蛋白样品制备: 分别取胃癌组织、癌旁组织及胃炎组织各100 mg加入200 μL裂解液(50 mmol/L Tris-HCl, pH 8.0; 1 mmol/L EDTA, pH 8.0; 5 mmol/L DTT; 2% SDS), 置冰上用研磨棒研磨组织, 并加入蛋白酶抑制剂(与裂解液1:100比例配制)提取组织总蛋白, 13000 r/min离心15 min, 吸取含蛋白的上清液. BCA法测定蛋白浓度.
1.2.2 Western blot: 取50 μg蛋白在10% SDS-PAGE胶上100 V恒压电泳分离2 h, 转移至PVDF膜上. 1%的脱脂奶粉室温封闭2 h, 一抗置杂交袋中与膜杂交4 ℃孵育过夜, GAPDH作为内参. 取出膜TTBS洗4次×10 min, 再与辣根过氧化物酶标记的二抗室温孵育2 h, TTBS洗3次×10 min. 最后用将PVDF膜用ECL发光液充分润湿后作用1 min, 保鲜膜覆盖, 置暗盒中曝光3 min. 显影、水洗、定影后观察结果.
1.2.3 结果分析: 应用BIO-RAD图像分析软件对Western blot杂交条带进行密度扫描, 以hMSH2及hMLH1条带灰度值与GAPDH条带灰度值比值表示各组织中hMSH2及hMLH1的表达水平(灰度值为条带密度值及面积值的乘积, 设空白对照相对密度值为0).
统计学处理 用SPSS11.5统计软件对相关数据行方差分析.
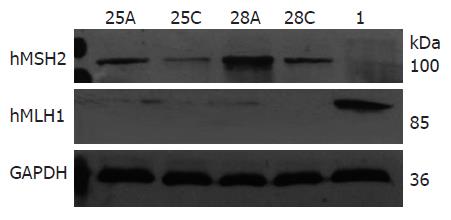
hMSH2蛋白在10例浅表性胃炎黏膜组织10例全失表达, 失表达率为100%, 10例萎缩性胃炎黏膜组织4例失表达, 失表达率为40%. 胃癌组hMSH2蛋白表达明显高于癌旁组(F = 8.798, P = 0.004), 胃癌组与胃炎组比较hMSH2蛋白表达明显增多(F = 33.969, P<0.01), 癌旁组与胃炎组比较差别有统计学意义(F = 28.590, P<0.01), 具体结果见表1, 部分组织标本Western blot检测结果见图1.
胃炎黏膜组织及癌旁组织中hMLH1蛋白的表达明显高于胃癌组织(F = 9.798, 9.056, P = 0.003); 胃炎组与癌旁组比较差别无统计学意义(F = 1.244, P = 0.281); 胃炎组中浅表性胃炎与萎缩性胃炎比较差别无统计学意义(F = 2.885, P = 0.107), 具体结果见表1, 部分组织标本Western blot检测结果见图1.
hMSH2及hMLH1蛋白表达在患者不同年龄组、性别、肿瘤部位、肿瘤大小、浸润深度、组织学类型、分化程度、淋巴结转移及临床分期等比较, 差异均无显著性(P>0.05, 表2).
| 病理特征 | n | hMSH2蛋白表达 | F值 | P值 | hMLH1蛋白表达 | F值 | P值 |
| 年龄(岁) | |||||||
| ≤50 | 28 | 0.28±0.10 | 0.324 | 0.573 | 0.21±0.06 | 1.275 | 0.266 |
| >50 | 12 | 0.30±0.10 | 0.24±0.07 | ||||
| 性别 | |||||||
| 男 | 25 | 0.28±0.11 | 0.021 | 0.886 | 0.22±0.06 | 0.199 | 0.658 |
| 女 | 15 | 0.28±0.05 | 0.22±0.07 | ||||
| 肿瘤部位 | |||||||
| 胃窦 | 25 | 0.29±0.08 | 0.034 | 0.856 | 0.22±0.07 | 0.046 | 0.831 |
| 胃体底 | 15 | 0.28±0.10 | 0.22±0.06 | ||||
| 肿瘤最大径(cm) | |||||||
| ≤5 | 23 | 0.30±0.07 | 2.086 | 0.157 | 0.23±0.06 | 1.595 | 0.214 |
| >5 | 17 | 0.26±0.10 | 0.20±0.07 | ||||
| 组织学类型 | |||||||
| 腺癌 | 33 | 0.29±0.09 | 0.417 | 0.522 | 0.22±0.06 | 0.044 | 0.835 |
| 黏液腺癌 | 7 | 0.26±0.11 | 0.21±0.07 | ||||
| 浸润深度 | |||||||
| 黏膜下层 | 6 | 0.32±0.08 | 0.504 | 0.465 | 0.21±0.06 | 0.975 | 0.415 |
| 肌层 | 9 | 0.27±0.05 | 0.20±0.06 | ||||
| 浆膜层 | 14 | 0.27±0.09 | 0.24±0.05 | ||||
| 浆膜外层 | 11 | 0.28±0.12 | 0.21±0.07 | ||||
| 淋巴结转移 | |||||||
| 有 | 29 | 0.28±0.10 | 0.545 | 0.465 | 0.21±0.06 | 2.231 | 0.144 |
| 无 | 11 | 0.30±0.08 | 0.24±0.06 | ||||
| 远处转移 | |||||||
| 有 | 9 | 0.27±0.05 | 0.141 | 0.709 | 0.21±0.07 | 0.529 | 0.472 |
| 无 | 31 | 0.29±0.10 | 0.22±0.06 | ||||
| H pylori感染 | |||||||
| - | 26 | 0.28±0.10 | 0.459 | 0.502 | 0.22±0.07 | 0.017 | 0.897 |
| + | 14 | 0.27±0.06 | 0.22±0.06 |
MMR基因是一组高度保守的管家基因, 具有修复DNA碱基错配、增强DNA复制忠实性、维持基因组稳定性和降低自发性突变的功能[2-3]. 近年来分子生物学的研究表明, 基因的不稳定性是人类癌症多步骤发生过程中最重要的环节, 能增加正常突变速率及致癌基因及抑癌基因的突变, 基因组的稳定性有赖于高度保真的DNA复制, 内外环境的各种因素都可能造成DNA损伤. MMR在修复DNA复制过程中的错误和内源性、外源性因素造成的损伤中具有重要作用[4], 纠正DNA合成和复制所产生的错误, 为MMR能诱导DNA受到严重损伤细胞的程序性凋亡. DNA错配修复基因缺陷可致细胞突变频率增加而形成突变子表型(mutato phenotype), 这些突变子表型的存在使得基因突变的事件不断放大、积累, 导致肿瘤发生. hMSH2和hMLH1是最先发现的2个错配修复基因, 与肿瘤关系密切[5]. hMSH2蛋白与hMSH6、hMSH3蛋白分别形成异二聚体hMutS-α和hMutS-β, 可识别错配位点, 并与错配位点结合形成复合物. hPMS2蛋白的氨基末段片断具有与DNA结合的活性, 和hMLH1蛋白形成hMutL-α二聚体, 与结合到DNA链上的hMutS形成一种暂时性的复合物, 从而启动错配修复[6].
胃癌发生是一个多病因、多阶段的连续过程. 从慢性胃炎经萎缩性胃炎、肠上皮化生和不典型增生, 最后发展为胃癌[7]. 本研究发现, hMSH2蛋白在胃癌中的表达显著高于癌旁和胃炎黏膜(P<0.01), 癌旁组织hMSH2的表达较胃炎组明显增多(P<0.01), 在浅表性胃炎及部分萎缩性胃炎中表达缺失, 说明癌细胞旺盛的增殖活动使hMSH2基因表达上调, 远离肿瘤组织的癌旁组hMSH2表达降低, 而hMSH2在浅表性胃炎组中有失表达的现象(失表达率100%), 在萎缩性胃炎中有部分失表达(失表达率40%). hMSH2蛋白在胃癌中高表达的原因可能是在某些因素的不断刺激下, 一些增殖活跃的细胞容易出现基因的多点突变和DNA复制错误, 使hMSH2基因表达代偿性上调, 但增多的基因产物仍不足以修复已发生损伤的基因, 使细胞恶性转化, 也不排除hMSH2基因自身可能发生突变, 编码有缺陷的产物增加, 促进肿瘤的发生. 如现已发现某些抑癌基因(如p53)发生突变从而促进了肿瘤的发生. Leach et al[8]在对膀胱癌的研究中发现, 原发性膀胱癌患者的膀胱冲洗液中具有hMSH2的表达, 且在治疗后转为阴性, 无膀胱癌的患者则无此基因的表达. 这些结果说明, hMSH2基因的高表达间接反映了肿瘤存在的情况. 但也有相反的报道: 在宫颈鳞状细胞癌、前列腺癌等肿瘤中的hMSH2基因表达减少或缺失[9-10], 而hMSH2表达下调或缺失的肿瘤通常伴有微卫星不稳定性的发生. 微卫星的不稳定性反应了错配修复系统的缺陷.
由试验结果可见, 胃癌中hMSH2基因的高表达与患者年龄、性别、肿瘤部位、肿瘤大小、浸润深度、组织学类型、分化程度、淋巴结转移及临床分期及幽门螺旋杆菌感染等均无关, 与肿瘤的恶性程度无关. 本研究认为, hMSH2基因表达增高与胃癌的发生有关.
本研究中, hMLH1基因在癌组织中的表达明显少于癌旁及胃炎组织(P<0.01), 癌旁组hMLH1表达较胃炎组少, 差别没有统计学意义(P>0.05), 胃炎组中浅表性胃炎组较萎缩性胃炎组hMLH1表达稍多, 但差别没有统计学意义(P>0.05), 这与Kakar et al[11]在大肠癌中的发现基本相似, 说明hMLH1的高表达在一定程度上可能会抑制DNA突变或损伤所造成的细胞恶变趋势, 进而抑制恶性肿瘤的发生. Baek et al[12]在对胃癌的研究中发现, 在8%的MSI阳性腺瘤与88%的癌中可见hMLH1表达缺失或减少, 在子宫内膜癌亦可见hMLH1表达缺失[13], hMLH1表达下调的原因, 可能是基因突变引起的表达缺失, 而更多的则是因为启动子区域甲基化. 慢性萎缩性胃炎是胃癌发生发展中的一个过程, hMLH1表达的减少, 但与浅表性胃炎组比较差别无统计学意义, 但也从一定程度上预示胃癌发生的可能, hMLH1表达下调导致错配修复效率下调, 造成突变的累积及肿瘤的发生. Kruschewski et al[14]在研究直肠癌中MMR基因表达与肿瘤生物学行为关系时发现MMR基因hMLH1的表达与患者的年龄、性别、肿瘤部位、组织学类型、浸润深度、分化程度、临床分期和淋巴结转移均无关, 与本实验结果相符.
以上研究表明, hMLH1基因与hMSH2基因有所不同, 在某种程度上反映了hMLH1与hMSH2基因功能上的差异, hMSH2基因表达异常与胃癌相关, 该基因的高表达可能是胃癌发生的标志. hMLH1表达减少则可能预示胃癌的发生, hMLH1蛋白可能作为预警胃癌发生的组织学标志物. 随着MMR基因研究的深入及分子生物学技术的发展, 人们将更进一步了解hMLH1和hMSH2基因与胃癌的关系, 为胃癌的病因研究及早期诊断预后等方面提供依据.
DNA错配修复系统首先在原核生物中被发现, 随后在酵母及更高等的真核生物中亦发现相似的MMR活性. 自1993年由Fishel et al分离克隆到第一个人类MMR基因hMSH2后, 到目前为止, 从人体细胞中共分离克隆到9个MMR基因, 其中与大肠杆菌MutS同源的基因有hMSH2、hMSH3、hMSH4、hMSH5和hMSH6, 与大肠杆菌MutL同源的基因有hMLH1、hMLH3、hPMS1和hPMS2.
郑鹏远, 教授, 郑州大学第二附属医院消化科
Flelsher et al在对65例胃癌的研究中发现了MSI、启动予甲基化和Hml-H1基因沉默这三者之间的密切相关. Fleisher et al发现MSI胃癌组织中hMLH1表达减少, 并证实hMLH1基因的过甲基化与胃癌MSI有关.
本研究发现, hMLH1和hMSH2参与胃癌的发生、发展; hMSH2高表达可能是胃癌发生的标志之一, 而hMLH1则可能是胃癌预警组织的一种标志物. 为胃癌的病因研究及早期诊断预后等方面提供依据.
本文研究错配修复基因hMLH1和hMSH2在胃癌组织中的表达及其意义, 有一定的理论意义和临床价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Papadopoulos N, Lindblom A. Molecular basis of HNPCC: mutations of MMR genes. Hum Mutat. 1997;10:89-99. [PubMed] [DOI] |
| 2. | Jacob S, Praz F. DNA mismatch repair defects: role in colorectal carcinogenesis. Biochimie. 2002;84:27-47. [PubMed] [DOI] |
| 3. | Kulke MH, Thakore KS, Thomas G, Wang H, Loda M, Eng C, Odze RD. Microsatellite instability and hMLH1/hMSH2 expression in Barrett esophagus-associated adenocarcinoma. Cancer. 2001;91:1451-1457. [PubMed] [DOI] |
| 4. | Manolagas SC, Jilka RL. Bone marrow, cytokines, and bone remodeling. Emerging insights into the pathophysiology of osteoporosis. N Engl J Med. 1995;332:305-311. [PubMed] [DOI] |
| 5. | Fishel R, Ewel A, Lee S, Lescoe MK, Griffith J. Binding of mismatched microsatellite DNA sequences by the human MSH2 protein. Science. 1994;266:1403-1405. [PubMed] [DOI] |
| 6. | Gras E, Catasus L, Arguelles R, Moreno-Bueno G, Palacios J, Gamallo C, Matias-Guiu X, Prat J. Microsatellite instability, MLH-1 promoter hypermethylation, and frameshift mutations at coding mononucleotide repeat microsatellites in ovarian tumors. Cancer. 2001;92:2829-2836. [PubMed] [DOI] |
| 7. | Correa P. Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res. 1992;52:6735-6740. [PubMed] |
| 8. | Leach FS, Hsieh JT, Molberg K, Saboorian MH, McConnell JD, Sagalowsky AI. Expression of the human mismatch repair gene hMSH2: a potential marker for urothelial malignancy. Cancer. 2000;88:2333-2341. [PubMed] [DOI] |
| 9. | Chung TK, Cheung TH, Wang VW, Yu MY, Wong YF. Microsatellite instability, expression of hMSH2 and hMLH1 and HPV infection in cervical cancer and their clinico-pathological association. Gynecol Obstet Invest. 2001;52:98-103. [PubMed] [DOI] |
| 10. | Yeh CC, Lee C, Dahiya R. DNA mismatch repair enzyme activity and gene expression in prostate cancer. Biochem Biophys Res Commun. 2001;285:409-413. [PubMed] [DOI] |
| 11. | Kakar S, Burgart LJ, Thibodeau SN, Rabe KG, Petersen GM, Goldberg RM, Lindor NM. Frequency of loss of hMLH1 expression in colorectal carcinoma increases with advancing age. Cancer. 2003;97:1421-1427. [PubMed] [DOI] |
| 12. | Baek MJ, Kang H, Kim SE, Park JH, Lee JS, Paik YK, Kim H. Expression of hMLH1 is inactivated in the gastric adenomas with enhanced microsatellite instability. Br J Cancer. 2001;85:1147-1152. [PubMed] [DOI] |
| 13. | Peiró G, Diebold J, Mayr D, Baretton GB, Kimmig R, Schmidt M, Löhrs U. Prognostic relevance of hMLH1, hMSH2, and BAX protein expression in endometrial carcinoma. Mod Pathol. 2001;14:777-783. [PubMed] [DOI] |
| 14. | Kruschewski M, Noske A, Haier J, Runkel N, Anagnostopoulos Y, Buhr HJ. Is reduced expression of mismatch repair genes MLH1 and MSH2 in patients with sporadic colorectal cancer related to their prognosis? Clin Exp Metastasis. 2002;19:71-77. [PubMed] [DOI] |