修回日期: 2009-10-27
接受日期: 2009-11-02
在线出版日期: 2009-11-28
目的: 探讨FHIT基因对胆管癌细胞的增殖与侵袭的影响.
方法: 将含FHIT基因的重组真核表达质粒转染入胆管癌细胞株QBC939, 采用MTT实验检测转染前后细胞增殖活性, Transwell小室侵袭实验检测肿瘤细胞侵袭力.
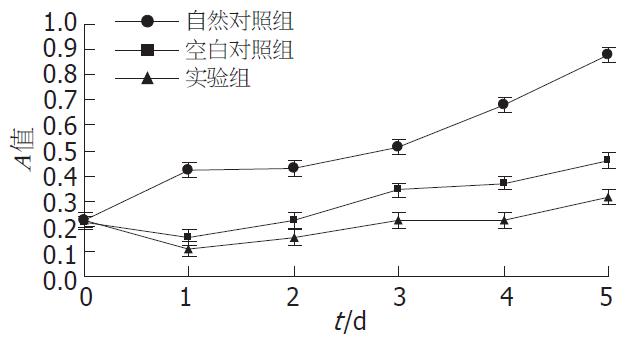
结果: 转染后QBC939细胞的MTT吸光度明显下降(P<0.05), 并且转移至小室滤膜下的细胞数明显减少(48±7 vs 109±14, 104±12, 均P<0.01).
结论: FHIT基因能抑制胆管癌细胞株QBC939的增殖并降低其侵袭力.
引文著录: 谢放, 黄强. FHIT基因转染对胆管癌细胞增殖与侵袭的影响. 世界华人消化杂志 2009; 17(33): 3437-3440
Revised: October 27, 2009
Accepted: November 2, 2009
Published online: November 28, 2009
AIM: To investigate the impact of fragile histidine triad (FHIT) gene transfection on the proliferation and invasiveness of human cholangiocarcinoma QBC939 cells.
METHODS: The recombinant FHIT eukaryotic expression plasmid was introduced into QBC939 cells by liposome-mediated transfection. Cell proliferation was tested by methyl thiazolyl tetrazolium (MTT) assay. Cell invasion was determined by Transwell chamber assay.
RESULTS: MTT assay showed that FHIT gene transfection significantly decreased the proliferation of QBC939 cells (P < 0.05). Transwell chamber assay showed that the number of transfected cells that passed the Transwell membrane was significantly less than those of blank control and normal control cells (48 ± 7 vs 109 ± 14 and 104 ± 12, respectively; both P < 0.01).
CONCLUSION: FHIT gene can inhibit the proliferation and invasiveness of human cholangiocarcinoma QBC939 cells.
- Citation: Xie F, Huang Q. FHIT gene transfection inhibits the proliferation and invasiveness of human cholangiocarcinoma QBC939 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3437-3440
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3437.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3437
肿瘤是一种基因性疾病, 原癌基因激活、抑癌基因功能丧失以及一些修饰基因功能的改变致使细胞增殖失控、细胞分化异常和肿瘤细胞凋亡失衡, 从而导致肿瘤的发生和发展. 本研究通过基因转染, 有限恢复胆管癌细胞抑癌基因的表达, 观察FHIT基因对胆管癌细胞增殖和侵袭的影响.
FHIT/pcDNA3.1由我室自行构建; 胆管癌细胞株QBC939购于ScienCell Research Labortories U.S.; 胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)购于美国Sigma公司; SYBR GreenⅠ、荧光定量RT-PCR试剂购于上海闪晶生物试剂公司; Transwell小室、Matrigel Matrix、Fibronection购于美国BD公司. XDS-1A倒置显微镜产于香港先达分析仪器有限公司; 紫外分光光度计产于美国GeneQuant Pro Amersham Biosciences; Biocell HT 1型全自动酶标仪产于奥地利Anthos Labtec Instru; 荧光定量PCR仪FTC2000产于加拿大Funglyn Biotech.
1.2.1 基因转染: 取经37 ℃, 50 mL/L CO2环境传代培养至3-5代之QBC939细胞, 将我室构建的FHIT/pcDNA3.1通过脂质体瞬时转染法转染细胞. 由于pcDNA3.1含有新霉素(Neomycin)抗性基因, 因此通过Neomycin筛选出成功转染的细胞.
1.2.2 FHIT基因表达检测: 转染后QBC939细胞的FHIT表达情况通过荧光定量RT-PCR进行检测. 根据GenBank所查询的序列, 使用Primer Express软件设计引物: 上游引物F 5'-GAGTCGGGACAGTGGTGGA-3'; 下游引物R 5'-GCTTCTGCTGCCATTTCCTC-3', 看家基因选择h_actin. 按试剂说明书设定荧光定量PCR反应体系及参数, 确定标准曲线后进行荧光定量PCR. 3个实验组各做6次重复实验, 每次目的基因和看家基因的Ct值相减得到ΔCt, 把未经处理的样品(自然对照组)作为参照因子(calibrator), 经看家基因均一化处理后, 通过2-ΔΔCt方法计算[1]. 目标基因表达差异通过经过处理的样本相对于未经处理的样本的倍数来表示.
1.2.3 细胞增殖检测: MTT法测定细胞增殖情况的原理是活细胞特别是增殖细胞通过线粒体脱氢酶将MTT(淡黄色)分解为蓝紫色的甲瓒(formaZan)结晶而显色, 甲瓒可以被DMSO等有机溶剂溶解, 测定其光吸收值能够反映细胞的增殖情况. 收集培养到对数生长期的QBC939细胞, 调整细胞悬液浓度, 用微量移液器加入96孔板中, 每孔100 μL, 未使用的边缘孔用无菌PBS填充. 按设计的3个观察组, 每组设4个重复孔, 共设6列, 从转染当天起每天检测一列.
1.2.4 Transwell小室侵袭实验: 构建Transwell小室系统, 自上而下依次为: 不含血清的上层培养液、细胞、基质胶、聚碳酸酯膜、含血清的下层培养液、培养板、纤维粘连蛋白. 上室种植肿瘤细胞, 下室加入含胎牛血清的培养基, 肿瘤细胞会向营养成分高的下室迁移, 在聚碳酸酯膜上室侧铺上一层基质胶, 用以模仿体内细胞外基质, 细胞欲进入下室, 先要分泌基质金属蛋白酶(matrix metalloproteinase, MMP)将基质胶降解, 方可通过聚碳酸酯膜. 于24孔板设置3组, 8列重复实验, 经结晶紫染色后, 随机取左上、左下、右上、右下及中心5个视野, 倒置显微镜下直接计数进入下室的细胞量可反映肿瘤细胞的侵袭能力.
1.2.5 实验分组: 本着实验需要, 保证随机性和对照原则, 将实验对象分为3组: 自然对照组(自然生长的QBC939细胞)、空白对照组(转染了pcDNA3.1空质粒的QBC939细胞)和实验组(转染了FHIT/pcDNA3.1重组质粒的QBC939细胞).
统计学处理 所得数据均以mean±SD表示, 采用单因素方差分析, 组间比较采用Bonfferoni检验. 所有数据录入SPSS17.0软件进行计算, 以P<0.05作为差异有显著的统计学意义.
荧光定量PCR显示, 实验组在质粒转染后, FHIT的表达比2个对照组有所升高, 表达量比自然生长的QBC929细胞高出2.53倍, 可见转染后的FHIT基因表达有限恢复(表1).
| ΔΔCt | ΔΔCt | 2-ΔΔCt | |
| 自然对照组 | 5.63±0.13 | 0.00±0.13 | 1.00(0.91-1.09) |
| 空白对照组 | 5.27±0.08 | -0.36±0.08 | 1.28(1.21-1.36) |
| 实验组 | 4.29±0.05 | -1.34±0.05 | 2.53(2.45-2.62) |
胆管癌是一种严重威胁生命健康的恶性肿瘤, 其起病隐匿、恶性程度高, 尤其体现在胆管癌细胞增殖能力和侵袭性较强等方面. 对胆管癌的相关研究发现, 胆管癌细胞的FHIT表达丢失, 且与癌基因的过表达呈线性相关[2], 因此该基因可能与胆管癌的发生、发展关系密切.
FHIT是由Ohta et al于1996年发现并命名[3]. 其主要特点是: 在脆性区域端检测有很多Alu序列, 富含AT, 可能是DNA复制的起点; 几乎所有外显子均以AC序列结束, 为通常所见基因剪接受体位点序列. FHIT基因在细胞凋亡和细胞周期调控中发挥重要作用[4-5]. FHIT基因编码的蛋白与微管蛋白结合, 可阻止细胞有丝分裂过程, 抑制细胞过度增殖, 从而发挥抑癌功能[6]; 此外, 还具有二腺苷酸三磷酸水解酶活性, 可以产生ATP, 虽然此活性的抑癌机制尚有争议, 但其作用已得到证实. 近年来的大量研究发现, 多种肿瘤组织中FHIT蛋白表达存在降低或丢失, 并发现这与FHIT基因转录及缺失有关, 提示FHIT基因为多种肿瘤的候选抑制基因[7]. FHIT转录产物异常及FHIT蛋白表达缺失或减少, 已在多种原发肿瘤及肿瘤细胞株中得到证实, 尤其在与环境致癌因素密切相关的肿瘤如胃癌、肺癌、食管癌、宫颈癌、肝癌等[8-11]更是如此. 而侵袭性是肿瘤细胞浸润和远处转移的主要表现, 尤其是恶性肿瘤最突出和致命的特点就是肿瘤转移. 肿瘤的浸润和转移给临床治疗带来的很大的难度.
那么是否可以通过分子生物学手段人工导入抑癌基因来影响肿瘤细胞的增殖和侵袭力呢? 为了探讨这种可能性, 本次研究通过构建FHIT真核表达质粒, 通过简便易行且效率较高的脂质体转染法, 在FHIT基因缺失的肿瘤细胞中导入FHIT cDNA, 由于瞬间转染在转染细胞培养数代后会出现稀释现象, 如采用稳定转染会可能更有效. 在检测基因的表达方面, 本研究运用更具特异性和更高准确度的荧光定量RT-PCR, 并采用MTT和小室侵袭实验等手段观察细胞生物学行为变化. 结果表明转染了含目的基因质粒的胆管癌细胞FHIT蛋白重新表达, 进而引起阻滞于S期和G0/G1期的细胞数增多, 而细胞周期的两个重要节点之一即位于G1-S处, 因此凋亡细胞数增多, 令致癌性下降. 同时, 研究发现抑癌基因的表达恢复, 可以降低肿瘤细胞的侵袭力, 从而可能减少其浸润和远处转移, 降低其恶性程度.
总之, FHIT基因能抑制胆管癌细胞增殖并降低其侵袭性, 但其具体作用的分子生物学机制还有待进一步研究. 但FHIT作为一种抑癌基因, 能影响肿瘤细胞增殖周期, 诱导其凋亡, 可以作为基因治疗的一种候选基因, 在将来的肿瘤临床中发挥重要作用.
FHIT基因是目前肿瘤研究的新兴领域和热点, 在多重肿瘤中的研究表明其可能成为基因治疗的一个靶点. 基因转染作为一种广泛应用且成熟的分子生物学实验技术, 使研究者可以通过导入目的基因来研究其对实验对象的影响, 探讨可能的作用机制.
沈柏用, 副教授, 上海市交通大学医学院瑞金医院肝胆胰外科中心
当前对FHIT基因的研究多见于乳腺癌、宫颈癌等少数几种肿瘤, 且国外研究较多, 对该基因在胆管癌的表达研究尚未引起重视.
赵坡 et al采用免疫组织化学和统计学分析方法研究发现胆管癌中FHIT低表达且其表达与癌基因Cyclin D1表达呈负相关. Maitra et al发现FHIT基因为多种肿瘤的候选抑制基因.
本文选题为该领域的研究热点, 有一定科学性和可读性, 但讨论不够深入, 有待完善.
编辑: 李军亮 电编: 何基才
| 1. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 3. | Ohta M, Inoue H, Cotticelli MG, Kastury K, Baffa R, Palazzo J, Siprashvili Z, Mori M, McCue P, Druck T. The FHIT gene, spanning the chromosome 3p14.2 fragile site and renal carcinoma-associated t(3;8) breakpoint, is abnormal in digestive tract cancers. Cell. 1996;84:587-597. [PubMed] [DOI] |
| 4. | Sard L, Accornero P, Tornielli S, Delia D, Bunone G, Campiglio M, Colombo MP, Gramegna M, Croce CM, Pierotti MA. The tumor-suppressor gene FHIT is involved in the regulation of apoptosis and in cell cycle control. Proc Natl Acad Sci USA. 1999;96:8489-8492. [PubMed] [DOI] |
| 5. | Roz L, Gramegna M, Ishii H, Croce CM, Sozzi G. Restoration of fragile histidine triad (FHIT) expression induces apoptosis and suppresses tumorigenicity in lung and cervical cancer cell lines. Proc Natl Acad Sci USA. 2002;99:3615-3620. [PubMed] [DOI] |
| 6. | Chaudhuri AR, Khan IA, Prasad V, Robinson AK, Ludueña RF, Barnes LD. The tumor suppressor protein Fhit. A novel interaction with tubulin. J Biol Chem. 1999;274:24378-24382. [PubMed] [DOI] |
| 7. | Maitra A, Wistuba II, Washington C, Virmani AK, Ashfaq R, Milchgrub S, Gazdar AF, Minna JD. High-resolution chromosome 3p allelotyping of breast carcinomas and precursor lesions demonstrates frequent loss of heterozygosity and a discontinuous pattern of allele loss. Am J Pathol. 2001;159:119-130. [PubMed] |
| 8. | Butler D, Collins C, Mabruk M, Barry Walsh C, Leader MB, Kay EW. Deletion of the FHIT gene in neoplastic and invasive cervical lesions is related to high-risk HPV infection but is independent of histopathological features. J Pathol. 2000;192:502-510. [PubMed] [DOI] |
| 9. | Yuan BZ, Keck-Waggoner C, Zimonjic DB, Thorgeirsson SS, Popescu NC. Alterations of the FHIT gene in human hepatocellular carcinoma. Cancer Res. 2000;60:1049-1053. [PubMed] |
| 11. | Zhao P, Song X, Nin YY, Lu YL, Li XH. Loss of fragile histidine triad protein in human hepatocellular carcinoma. World J Gastroenterol. 2003;9:1216-1219. [PubMed] |