修回日期: 2009-11-08
接受日期: 2009-11-16
在线出版日期: 2009-11-28
目的: 探讨结直肠癌中肿瘤浸润淋巴细胞(TIL)的临床病理和免疫组织化学特征, 及大量TIL与各病理因素的关系.
方法: 利用光镜和免疫组织化学法对370例结直肠癌中的肿瘤浸润淋巴细胞进行组织病理学观察, 并分析对比其与各临床病理因素的相关性.
结果: 81.9%的结直肠癌中可见淋巴细胞散在分布, 数量少, 18.1%却可见大量的淋巴细胞, 并有一定的临床病理特征. 大量的TIL部分侵入肿瘤实质而部分位于肿瘤组织周围. 免疫组织化学染色显示, 肿瘤浸润淋巴细胞主要是由CD3+ T细胞、CD20+、CD79α+B细胞、浆细胞和CD56+NK细胞构成, 其中细胞毒性TIA-1均有较高的表达, 并伴有大量淋巴细胞浸润与肿瘤组织的分化程度、浸润深度及淋巴结转移有关(χ2 = 4.954, 11.240及12.768; P = 0.026, 0.001及0.000).
结论: 结直肠癌组织中TIL的病理形态差异较大并与临床病理因素相关. 在结直肠癌中伴有大量肿瘤浸润淋巴细胞存在时有积极的意义.
引文著录: 秦誉, 耿敬姝, 张大川. 肿瘤浸润淋巴细胞在结直肠癌中的临床病理分析. 世界华人消化杂志 2009; 17(33): 3408-3413
Revised: November 8, 2009
Accepted: November 16, 2009
Published online: November 28, 2009
AIM: To investigate the clinicopathological characteristics and immunohistochemical features of tumor-infiltrating lymphocyte (TIL) in colorectal cancer, and analyze the correlations between the presence of massive TIL and various pathological parameters in colorectal cancer.
METHODS: The histopathological features of tumor-infiltrating lymphocytes in 370 cases of colorectal cancer were detected by light microscopy and immunohistochemistry. The correlations between the presence of massive TIL and various clinicopathological parameters in colorectal cancer were then analyzed.
RESULTS: Of 370 cases of colorectal cancer detected, 303 (81.9%) showed mild infiltration of scattered lymphocytes, and 67 (18.1%) showed massive lymphocyte infiltration. The majority of lymphocytes were infiltrated into both the stromal and epithelial components of carcinoma. TIL were often distributed around cancer tissue, and separated cancer tissue from normal tissue. Immunohistochemical staining showed that TIL were mainly composed of CD3+ T cells, CD20+ CD79α+ B cells, and CD56+ natural killer cells. T-cell-restricted intracellular antigen-1 (TIA-1) was strongly expressed in TIL. Massive lymphocyte infiltration was correlated with tumor differentiation, invasive depth and lymph node metastasis in colorectal cancer (χ2 = 4.954, 11.240, 12.768; P = 0.026, 0.001, 0.000, respectively).
CONCLUSION: The clinicopathological characteristics of tumor-infiltrating lymphocytes in colorectal cancer vary significantly. The presence of massive tumor-infiltrating lymphocytes is a positive prognostic factor for colorectal cancer.
- Citation: Qin Y, Geng JS, Zhang DC. Clinicopathological characteristics of tumor-infiltrating lymphocytes in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3408-3413
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3408.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3408
肿瘤的临床病理研究日益重要, 直接与疾病的诊断、治疗方案和预后相关. 在肿瘤的病理研究中发现病变部位有免疫细胞的存在. 曾推测淋巴细胞渗入到肿瘤组织内是体内免疫系统抵抗肿瘤的一种现象, 提出肿瘤浸润性淋巴细胞(tumor infiltrating lymphocyte, TIL)的初始概念. 此后, 经免疫组织化学研究证实TIL的存在. Rosenberg et al[1]在动物肿瘤模型上以及临床应用方面研究TIL的抗瘤活性, 使开展免疫生物疗法治疗临床恶性肿瘤患者具有可行性. 而在肿瘤的临床病理研究中, 不同的组织器官及不同的病理类型中免疫细胞特别是TIL存在着细胞成分及表型的差异性. 本研究通过对370例结直肠癌进行组织病理特征观察, 了解TIL的组织病理特点, 并分析各病理相关因素和肿瘤浸润性淋巴细胞的关系. 为肿瘤过继免疫治疗研究提供一些病理基础.
哈尔滨医科大学附属肿瘤医院2007-2008年结直肠癌370例, 所有病例均经HE染色证实为结直肠癌, 且术前均未接受过抗炎药治疗及放、化疗或其他抗肿瘤治疗. 其中男290例, 女80例, 年龄34-71岁. 所有标本均经40 g/L甲醛溶液固定24 h后取肿瘤中心部分制成蜡块, 连续4 μm切片. 分别用于HE和免疫组织化学染色. 鼠抗人mAb CD3、CD4、CD8、CD20、CD79α、CD56、TIA-1以及检测试剂盒和DAB显色试剂盒均来自北京中杉金桥生物技术有限公司.
1.2.1 HE染色和免疫组织化学染色步骤: 石蜡包埋, 4 μm切片, 常规脱蜡, 进行HE染色. 应用免疫组织化学MaxVisionTM法染色. 石蜡切片常规脱蜡和水化后, 浸于EDTA液(pH 9.5), 高压修复组织抗原20 min. PBS洗涤; 封闭内源性过氧化物酶; PBS洗涤; 第一抗体孵育过夜; PBS洗涤; 第二抗体MaxVisionTM试剂孵育10 min; PBS洗涤; DAB显色; 蒸馏水冲洗; 苏木素复染; 梯度乙醇脱水; 二甲苯透明; 中性树胶封片. 以PBS液代替一抗作为阴性对照. 用已知阳性淋巴结切片作阳性对照.
1.2.2 形态观察: 病理形态学观察和免疫组织化学检测. 每例首先在低倍镜下(×100)观察肿瘤组织的分化程度、浸润深度、淋巴结转移以及肿瘤浸润淋巴细胞分布情况等临床病理特征. 然后在高倍光镜下(×400), 观察肿瘤组织周围浸润淋巴细胞的组织病理特征及免疫表型.
统计学处理 全部资料均采用SPSS13.0统计软件进行分析, 计数资料采用χ2检验. P<0.05表示差异有显著意义.
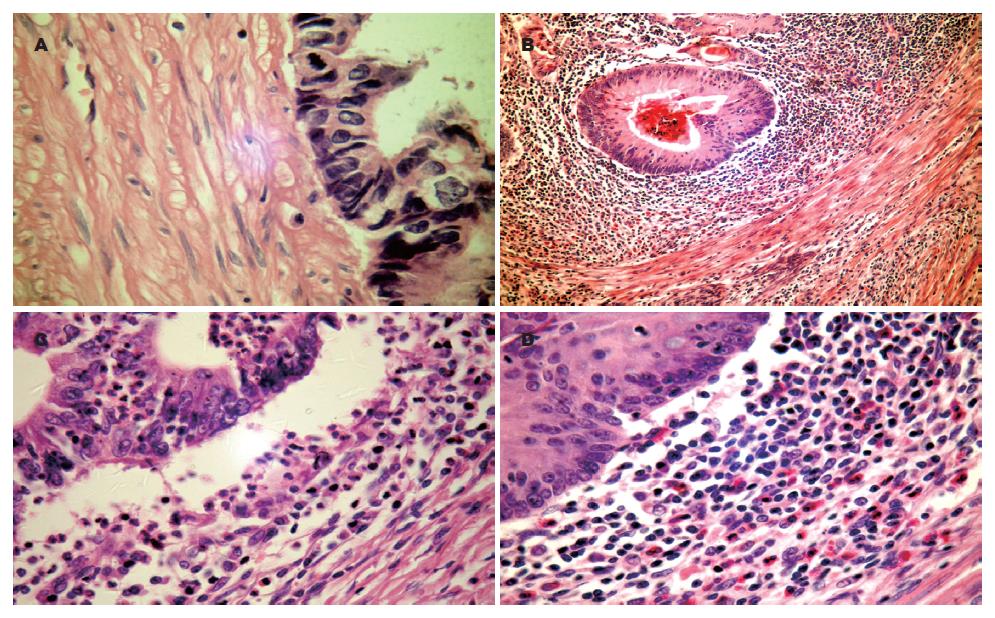
结直肠癌中浸润性免疫细胞以淋巴细胞为主(淋巴细胞核相对很大, 细胞质极少. 核内染色质多, 染色较深. 核圆形深染, 核周围浅染, 胞质蓝灰色. 在高倍镜下可以识别, 并且通过免疫组织化学CD3、CD20、CD79α、CD56确定和分类). 观察肿瘤浸润淋巴细胞的组织病理学特征, 发现肿瘤组织浸润淋巴细胞的数量和分布情况有很大的差异. 81.9%例病例(303/370)中可以看到淋巴细胞散在分布, 数量少, 有时在一个高倍视野甚至看不到淋巴细胞(图1A). 部分可以散在分布正常组织中或是肿瘤坏死组织里. 但有18.1%例病例(67/370)中却可以见到大量的淋巴细胞(TIL≥50淋巴细胞/100肿瘤细胞), 并有一定的临床病理特征. 大量的TIL存在有一部分侵入肿瘤实质而部分位于肿瘤组织周围, 浸润在肿瘤组织中和周围, 呈弥漫片状分布(图1B). 常围绕癌组织并将癌组织与正常组织分离, 空隙样存在, 与正常组织界线较清晰(图1C). 这种病理现象的形成不是单有TIL, 较多时候是TIL和大量的中性粒细胞、嗜酸性粒细胞共同完成(图1D). (中性粒细胞胞质淡红色, 胞核幼稚型的呈杆状或马蹄形, 成熟的呈分叶状, 三叶的较多见. 嗜酸性粒细胞直径13-15 μm, 胞质内充满粗大、整齐、均匀、紧密排列的砖红色或鲜红色嗜酸性颗粒, 遮光性强. 细胞核的形状与中性粒细胞相似, 通常有2-3叶). 与TIL在一起形成了一定特点的大量免疫细胞的病理分布.
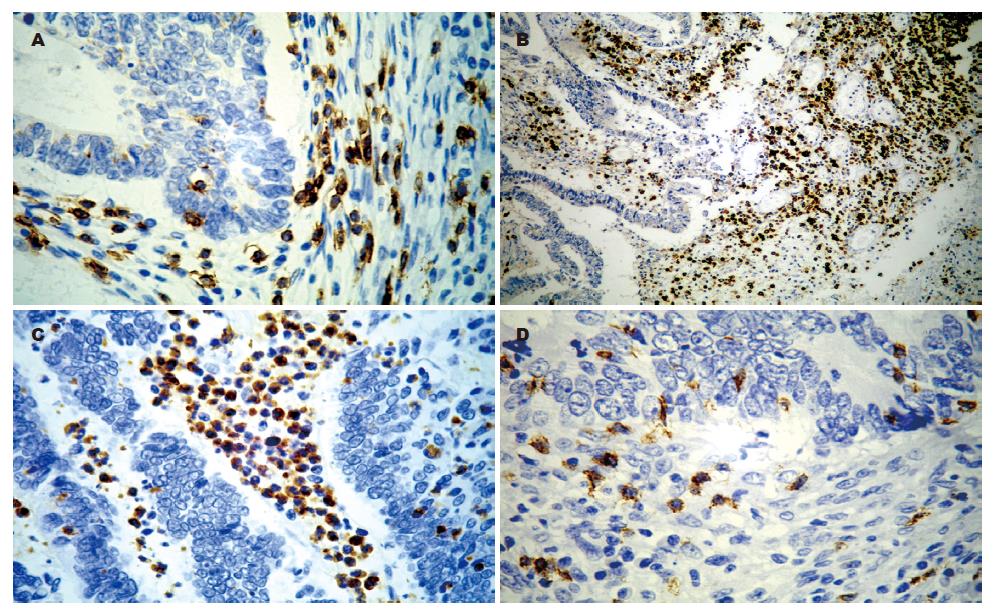
肿瘤浸润淋巴细胞主要是由CD3+ T细胞, CD20+、CD79α+B细胞、浆细胞和CD56+NK细胞构成. 其中细胞毒性TIA-1均见有较高表达. CD3+ T细胞以CD8+细胞为主, CD4+细胞较少(图2).
对370例结直肠癌组织的各种临床病理因素进行观察. 根据肿瘤浸润淋巴细胞的情况把病例分为伴有大量淋巴细胞浸润(TIL≥50淋巴细胞/100肿瘤细胞)和无大量淋巴细胞浸润(TIL<50淋巴细胞/100肿瘤细胞). 有无大量淋巴细胞浸润与肿瘤分化程度、淋巴结转移和浸润深度有统计学意义(P<0.05或0.01). 而与年龄和性别无统计学意义(P>0.05, 表1).
| 临床病理参数 | n | 伴有大量TIL浸润 | χ2值 | P值 | |
| 有 | 无 | ||||
| 年龄(岁) | |||||
| <60 | 234 | 45 | 189 | 0.541 | 0.462 |
| ≥60 | 136 | 22 | 114 | ||
| 性别 | |||||
| 男 | 290 | 50 | 240 | 0.679 | 0.410 |
| 女 | 80 | 17 | 63 | ||
| 浸润深度 | |||||
| 未及浆膜 | 133 | 36 | 97 | 11.240 | 0.001 |
| 浆膜或以外 | 237 | 31 | 206 | ||
| 组织分化 | |||||
| 高中 | 170 | 39 | 131 | 4.954 | 0.026 |
| 低 | 200 | 28 | 172 | ||
| 淋巴结转移 | |||||
| 有 | 149 | 14 | 135 | 12.768 | 0.000 |
| 无 | 221 | 53 | 168 | ||
| 合计 | 370 | 67 | 303 | ||
在许多疾病中均可以见到淋巴细胞等炎性细胞浸润. 是机体对内外因素影响的免疫反应, 其有保护也有破坏作用. 在免疫性疾病中起到重要作用. 随着肿瘤免疫治疗的研究, 发现TIL体外杀伤肿瘤细胞具有一定的特异性, 而且, TIL需要少量IL-2就可维持其体内抗肿瘤效应[2], 与LAK细胞比较TIL具有更强抗肿瘤活性. TIL具有较强的杀伤力, 主要是TIL更具有识别肿瘤细胞的能力. TIL细胞的临床应用是继LAK细胞疗法之后的杀伤自体瘤细胞的又一种免疫疗法. Rosenberg et al, Dudley et al应用TIL静脉回输并联合IL-2、CTX治疗恶性黑色素瘤, 达到部分或完全消退[1-3]. Rosenberg实验室采用TIL对化疗无效的晚期恶性黑色素瘤患者行免疫替代疗法治疗, 结果获得部分缓解和混合性疗效. 国内学者报道, 肝癌患者手术后, 采用TIL辅助治疗可以缓解病人临床症状. 王志勇 et al[4]发现TIL在细胞因子, 特别是IL-2协同下, 瘤灶内注射的局部免疫疗法, 具有较强的抗膀胱癌效应, 并显著提高了机体全身抗瘤免疫功能.
目前, 临床应用的TIL细胞主要来源于手术切除或活检所得的瘤体组织、癌性胸水、腹水中淋巴细胞及转移淋巴结. 国内外实验室分离培养TIL方法很多, 大多采用淋巴细胞分离液进行非连续密度梯度离心法.
肿瘤浸润淋巴细胞是继LAK细胞后的又一代高效抗瘤效应细胞. 尽管有着许多优点, 但是TIL的免疫治疗仍有诸多不足, 有效率仍不高. 这可能与肿瘤的免疫逃逸及个体差异有关. 在肿瘤的临床病理中发现的TIL的相关病理特征在不同组织器官、不同肿瘤来源及不同的病理分型均存在较大的差异性. 其存在的意义也有较大的争议.
本试验发现在结直肠癌组织TIL的病理形态同样差异很大, 大多数病例的病理中的只能见到少量或缺乏TIL. 370例中303例(81.9%)看到淋巴细胞散在分布, 数量少, 有时在一个高倍视野甚至看不到淋巴细胞. 部分可以散在分布正常组织中或是肿瘤坏死组织里. 这与恶性肿瘤患者的免疫系统在肿瘤局部和全身都处于耐受或缺陷状态相一致. 肿瘤在体内经历了多因素、多步骤长期发展变化过程, 其抗原也经历了人体免疫系统的筛选, 肿瘤相关抗原基本上被自体免疫系统默认为自身抗原, 形成严密的耐受[5]. 肿瘤细胞能直接使与之接触的T细胞朝着Th2方向极向化, 并促进遭遇的T细胞产生IL-4,下调IFN-γ的产生, 产生Th2样免疫. Sheu认为这种作用主要由IL-10介导, TGF-β仅起协同作用[6]. Fas/FasL系统: 近年的研究发现FasL在肿瘤细胞表达增加与肿瘤免疫抑制有密切关系[7-8].
但研究发现有些病例67例(18.1%)中却可以见到大量的淋巴细胞, 并有一定的临床病理特征. 有一部分侵入肿瘤组织内而另一部分位于肿瘤组织周围弥漫片状分布. 这种病理现象的形成不是单有TIL, 常常是由TIL和中性粒细胞、嗜酸性粒细胞共同完成. 浸润在肿瘤组织中和周围. 呈弥漫片状分布. 常围绕癌组织并将癌组织与正常组织分离, 空隙样存在. 与正常组织界线较清晰. 伴有大量淋巴细胞浸润与肿瘤组织的分化程度、浸润深度和淋巴结转移有关(P<0.05或0.01). 有其存在时肿瘤组织的分化程度较好, 浸润深度浅和淋巴结转移少. 此现象这也说明了TIL的抗肿瘤特性. 这与TIL中存在大量效应细胞有关. 而与年龄和性别无统计学意义(P>0.05), 这可能是受住院病例多已是中晚期影响. 免疫组织化学显示, 主要是由CD3+ T细胞, CD20+、CD79α+B细胞、浆细胞和CD56+NK细胞组成. 其中细胞毒性TIA-1均见有较高表达. 并且CD3+ T细胞以CD8+细胞为主, CD4+细胞较少. CD4+/CD8+ T细胞比值小于1. CD4+/CD8+ T细胞比值在机体免疫反应及免疫调节中具有重要作用, 其变化反映出机体免疫状态的变化[9]. 已有研究显示TIL中CD3+ T细胞与较好的临床预后有关, 尤其是在肿瘤实质中出现[10-11]. 特别是CD8+ T细胞亚群[12-15], 提示细胞毒性淋巴细胞在肿瘤免疫中起重要作用. 此外在病例中可以见到大量中性粒细胞和嗜酸性粒细胞, 他们一方面通过自身作用, 另一方面还可以通过调节淋巴细胞活性而发挥抗肿瘤效应[16]. 可见机体抗肿瘤是有多种免疫细胞共同来完成.
TIL细胞杀伤肿瘤细胞主要依赖其中的CTL细胞的有效激活和有效行使功能. T细胞转化为效应细胞, 需要有2个刺激信号, 第一激活信号由TCR与抗原肽-MHC分子复合物结合提供; 第二激活信号由T细胞上的CD28与抗原提呈细胞(APC)上B7分子结合提供[17]. 通过该途径杀伤肿瘤细胞机制目前已清楚, 另外研究证明TIL杀伤肿瘤还有3条途径: (1)Fas介导的细胞凋亡, 其主要机制为淋巴细胞通过表面的Fas配体(FasL)与靶细胞上的Fas结合, 引起细胞DNA片段化, 导致细胞发生凋亡; (2)穿孔素/颗粒酶B介导的细胞凋亡; (3)TIL分泌一些细胞因子如TNF-α、IFN-γ等介导的细胞溶解与凋亡, 该途径可通过释放颗粒或直接细胞接触杀伤靶细胞[18].
是否每个患者都适合TIL的免疫治疗有待进一步研究. 本试验研究在结直肠癌中伴有大量肿瘤浸润淋巴细胞存在(特别是形成一定的病理组织特点)时有积极的意义. 并发现大多的肿瘤组织中的浸润淋巴细胞较少, 细胞免疫显然已经不能对肿瘤细胞起到杀伤作用或者肿瘤细胞对TIL免疫逃逸, 此时提取的TIL体外培养回输治疗是否还会有效有待进一步临床试验研究. 是否要与临床相关病理因素结合有待探讨价值.
肿瘤浸润性淋巴细胞(TIL)是一种有效的抗肿瘤效应细胞. 且他在体外杀伤肿瘤细胞具有一定的特异性,而且, TIL需要少量IL-2就可维持其体内抗肿瘤效应, 是继LAK细胞后的又一代高效抗瘤效应细胞. 近年在动物肿瘤模型和临床应用研究中取得一定成就, 因而在肿瘤过继免疫治疗中的作用受到重视.
姜慧卿, 教授, 河北医科大学第二医院消化科
近年来, TIL与肿瘤的关系日益受到人们的重视, 应用TIL进行肿瘤免疫治疗的研究也成为热点.
近来关于TIL在肿瘤的临床试验和免疫治疗方面的研究较多. 而对其临床病理特征的研究及其意义较少并有分歧. 本研究针对结直肠癌中TIL进行组织病理及免疫组织化学特点分析研究, 并探讨了大量浸润淋巴细胞对肿瘤组织的影响和关系.
本研究提示, 结直肠癌组织中TIL的病理形态差异较大并与临床病理因素相关. 伴有大量肿瘤浸润淋巴细胞存在时有积极的意义. 为肿瘤的过继免疫治疗研究提供了一些病理基础.
本研究提出了TIL大多存在于肿瘤组织的分化程度较好, 浸润深度低和淋巴结转移少的结直肠癌组织中的研究结论, 具有一定的临床参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME. Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat Rev Cancer. 2008;8:299-308. [PubMed] [DOI] |
| 2. | Heemskerk B, Liu K, Dudley ME, Johnson LA, Kaiser A, Downey S, Zheng Z, Shelton TE, Matsuda K, Robbins PF. Adoptive cell therapy for patients with melanoma, using tumor-infiltrating lymphocytes genetically engineered to secrete interleukin-2. Hum Gene Ther. 2008;19:496-510. [PubMed] [DOI] |
| 3. | Rosenberg SA, Dudley ME. Adoptive cell therapy for the treatment of patients with metastatic melanoma. Curr Opin Immunol. 2009;21:233-240. [PubMed] [DOI] |
| 5. | Becher B, Bechmann I, Greter M. Antigen presentation in autoimmunity and CNS inflammation: how T lymphocytes recognize the brain. J Mol Med. 2006;84:532-543. [PubMed] [DOI] |
| 6. | Loose D, Van de Wiele C. The immune system and cancer. Cancer Biother Radiopharm. 2009;24:369-376. [PubMed] [DOI] |
| 7. | Ohta T, Elnemr A, Kitagawa H, Kayahara M, Takamura H, Fujimura T, Nishimura G, Shimizu K, Yi SQ, Miwa K. Fas ligand expression in human pancreatic cancer. Oncol Rep. 2004;12:749-754. [PubMed] |
| 9. | Piersma SJ, Jordanova ES, van Poelgeest MI, Kwappenberg KM, van der Hulst JM, Drijfhout JW, Melief CJ, Kenter GG, Fleuren GJ, Offringa R. High number of intraepithelial CD8+ tumor-infiltrating lymphocytes is associated with the absence of lymph node metastases in patients with large early-stage cervical cancer. Cancer Res. 2007;67:354-361. [PubMed] [DOI] |
| 10. | Tomsová M, Melichar B, Sedláková I, Steiner I. Prognostic significance of CD3+ tumor-infiltrating lymphocytes in ovarian carcinoma. Gynecol Oncol. 2008;108:415-420. [PubMed] [DOI] |
| 11. | Nelson BH. The impact of T-cell immunity on ovarian cancer outcomes. Immunol Rev. 2008;222:101-116. [PubMed] [DOI] |
| 12. | Sato E, Olson SH, Ahn J, Bundy B, Nishikawa H, Qian F, Jungbluth AA, Frosina D, Gnjatic S, Ambrosone C. Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci USA. 2005;102:18538-18543. [PubMed] [DOI] |
| 13. | Hamanishi J, Mandai M, Iwasaki M, Okazaki T, Tanaka Y, Yamaguchi K, Higuchi T, Yagi H, Takakura K, Minato N. Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer. Proc Natl Acad Sci USA. 2007;104:3360-3365. [PubMed] [DOI] |
| 14. | Clarke B, Tinker AV, Lee CH, Subramanian S, van de Rijn M, Turbin D, Kalloger S, Han G, Ceballos K, Cadungog MG. Intraepithelial T cells and prognosis in ovarian carcinoma: novel associations with stage, tumor type, and BRCA1 loss. Mod Pathol. 2009;22:393-402. [PubMed] [DOI] |
| 15. | Leffers N, Gooden MJ, de Jong RA, Hoogeboom BN, ten Hoor KA, Hollema H, Boezen HM, van der Zee AG, Daemen T, Nijman HW. Prognostic significance of tumor-infiltrating T-lymphocytes in primary and metastatic lesions of advanced stage ovarian cancer. Cancer Immunol Immunother. 2009;58:449-459. [PubMed] [DOI] |
| 16. | Jakóbisiak M, Lasek W, Golab J. Natural mechanisms protecting against cancer. Immunol Lett. 2003;90:103-122. [PubMed] [DOI] |
| 17. | Fan K, Wang H, Wei H, Zhou Q, Kou G, Hou S, Qian W, Dai J, Li B, Zhang Y. Blockade of LIGHT/HVEM and B7/CD28 signaling facilitates long-term islet graft survival with development of allospecific tolerance. Transplantation. 2007;84:746-754. [PubMed] [DOI] |