修回日期: 2009-10-26
接受日期: 2009-11-02
在线出版日期: 2009-11-18
目的: 探讨Tiam1和EMT在不同转移能力的大肠癌细胞中的关系.
方法: 用Real time-RT PCR法分析Tiam1 mRNA, Ecadherin mRNA和Vimentin mRNA在6种大肠癌细胞系中的表达; 通过免疫组织化学检测Tiam1, Ecadherin和Vimentin在LoVo和HT29中的表达. 通过考马斯亮蓝染色观察LoVo和HT29的细胞骨架.
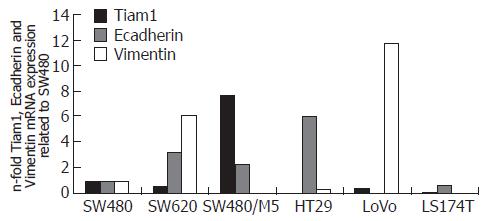
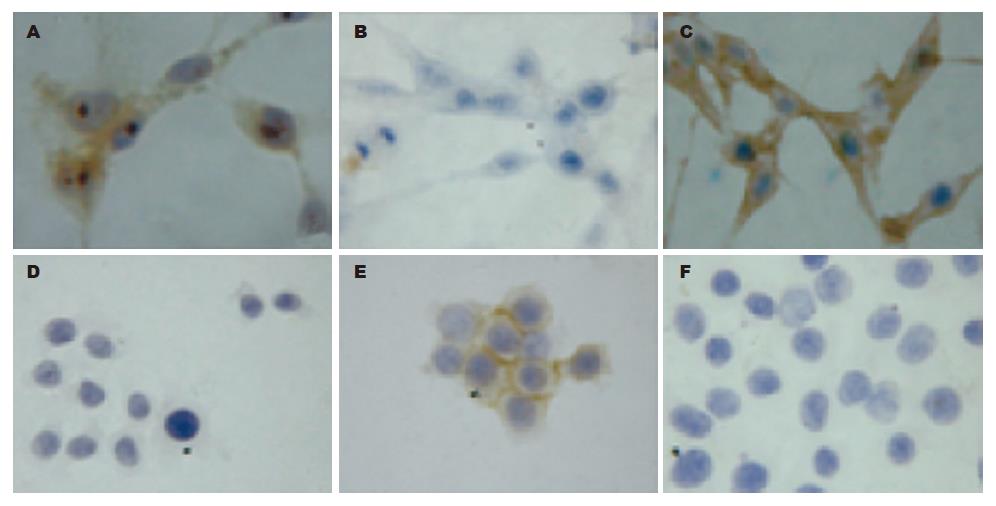
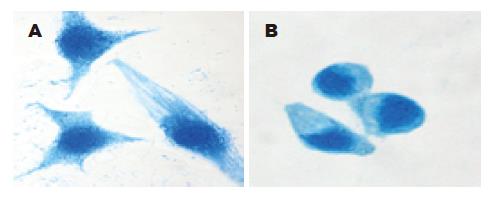
结果: 在SW620, SW480/M5, HT29, LoVo和LS174T中, Tiam1 mRNA的表达水平分别是SW480的0.51, 7.67, 0.00, 0.36, 0.06倍, 差异具有统计学意义(P<0.05); Ecadherin mRNA的表达水平分别是SW480的3.18, 2.27, 5.92, 0.00, 0.61倍, 差异具有统计学意义(P<0.05); Vimentin mRNA的表达水平分别是SW480的6.08, 0.02, 0.35, 11.72, 0.00倍, 差异具有统计学意义(P<0.05). 细胞免疫组织化学显示LoVo细胞的Tiam1表达呈阳性(++), Vimentin表达呈强阳性(+++), Ecadherin表达阴性(-); HT29细胞的Ecadherin表达呈阳性(++), Tiam1和Vimentin表达阴性(-). LoVo细胞质中丝网状的骨架蛋白结构及点状肌动蛋白小体比HT29多.
结论: Tiam1促进大肠癌转移的机制可能与EMT发生有关.
引文著录: 王雅娟, 胡洁, 赵海燕, 韩慧霞. Tiam1与大肠癌细胞EMT的关系. 世界华人消化杂志 2009; 17(32): 3337-3341
Revised: October 26, 2009
Accepted: November 2, 2009
Published online: November 18, 2009
AIM: To explore the correlation between Tiam1 (T-lymphoma invasion and metastasis-inducing protein 1) expression and epithelial-mesenchymal transition (EMT) in six colorectal cancer cell lines with different metastatic potential.
METHODS: The expression of Tiam1, E-cadherin and vimentin mRNAs in six human colorectal cancer cell lines was detected by real-time reverse transcription-polymerase chain reaction (RT-PCR). The expression of Tiam1, E-cadherin and vimentin proteins in LoVo and HT29 cells was detected by immunohistochemistry. The cytoskeleton of LoVo and HT29 cells was observed by Coomassie brilliant blue staining.
RESULTS: The expression levels of Tiam1, E-cadherin and vimentin mRNAs in SW620, SW480/M5, HT29, LoVo and LS174T cells were significantly different from those in SW480 cells (Tiam1: 0.51, 7.67, 0.00, 0.36 and 0.06 vs 1.00; E-cadherin: 3.18, 2.27, 5.92, 0.00 and 0.61 vs 1.00; vimentin: 6.08, 0.02, 0.35, 11.72 and 0.00 vs 1.00; all P < 0.05). E-cadherin protein was moderately expressed in the cytoplasm of HT29 cells, while Tiam1 and vimentin proteins were not detectable in HT29 cells. Tiam1 and vimentin proteins were moderately and strongly expressed in the nuclei of LoVo cells, respectively, while E-cadherin protein was undetectable in LoVo cells. HT29 cells had more surface projections, and less cytoskeletal structures and spot-like actin bodies than LoVo cells.
CONCLUSION: Tiam1 promotes the metastasis of colorectal carcinoma possibly by inducing EMT.
- Citation: Wang YJ, Hu J, Zhao HY, Han HX. Correlation between Tiam1 expression and epithelial-mesenchymal transition in human colorectal cancer cell lines. Shijie Huaren Xiaohua Zazhi 2009; 17(32): 3337-3341
- URL: https://www.wjgnet.com/1009-3079/full/v17/i32/3337.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i32.3337
Tiam1基因(T lymphoma invasion and metastasis)是从鼠T淋巴瘤中克隆出来的基因, 全称T淋巴瘤侵袭转移诱导因子1[1]. 近年有研究显示其在多种恶性肿瘤组织中呈阳性表达并与肿瘤侵袭转移密切相关, 结肠癌中高表达Tiam1的细胞也高表达Vimentin, 具有更多的转移表型, 同时Ecadherin的表达减少[2]. Ecadherin的表达减少时可破坏细胞间的黏附作用, 使细胞获得易于侵袭和转移的特性, 其表达的丢失已被认为是上皮细胞间质转化(epithelial-mesenchymal transition, EMT)最显著的特征[3]. 通过前期实验, 我们得出Tiam1与大肠癌的分化和转移有关, 其促进大肠癌转移的机制可能与EMT发生有关[4]. 在本研究中, 我们通过观察Tiam1, Ecadherin和间充质细胞标志Vimentin[5]在不同转移能力的大肠癌细胞系中的表达, 探讨Tiam1和EMT在不同转移能力的大肠癌细胞中的关系.
RPMI 1640培养基购自莱德尔生物公司; 新生牛血清购自吉泰公司; TRIzol试剂购自南京凯基公司; Reverse Transcription System试剂盒、SYBR Premix ExTaqTM试剂盒购自TaKaRa公司; Tiam1、Ecadherin、Vimentin和GAPDH引物由上海英骏公司合成; 浓缩型兔抗人Tiam1多克隆抗体购自Santa Cruz公司.
1.2.1 细胞培养: 人大肠癌细胞系SW480、SW620、SW480/M5、LoVo、HT29、LS174T为本室冷冻保存, 其中SW480/M5为本科室前期筛选的具有高选择性肝脏转移特性的SW480亚系[6]; 采用含20%新生牛血清的RPMI 1640培养基, 至37 ℃、50 mL/L CO2培养箱内培养.
1.2.2 Real-time RT-PCR检测大肠癌细胞系中Tiam1, Ecadherin, Vimentin表达: 参照说明书, 用TRIzol试剂常规提取细胞总RNA. 按照逆转录试剂盒操作程序进行逆转录反应. 反应总体系为20 μL, 其中样品总RNA 2 μL, 5×Prime Script 4 μL, PrimeScriptTM RT Enzyme MixⅠ1 μL, Random 6 mers 1 μL, Oligo dT Primer 1 μL, DEPC水11 μL. 37 ℃反应15 min, 85 ℃灭活5 s. 看家基因GAPDH为内对照. 通过相对荧光定量PCR方法, 同时对Tiam1, Ecadherin, Vimentin和GAPDH进行检测, 计算出不同样本的Tiam1, Ecadherin, Vimentin的相对表达量. 采用Primer 5.0设计引物, Tiam1的上游引物为5'-AAGACGTACTCAGGCCATGTCC-3', 下游引物为5'-GACCCAAATGTCGCAGTCAG-3', 产物长度为252 bp; Ecadherin的上游引物为5'-CGGTGGTCAAAGAGCCCTTA-3', 下游引物为5'-TGAGGGTTGGTGCAACGTCGTTA-3', 产物长度为170 bp; Vimentin的上游引物为5'-TGAGTACCGGAGACAGGTCGAG-3', 下游引物为5'-TAGCAGCTTCAACGCAAAGTTC-3', 产物长度为119 bp; GAPDH上游引物为5'-ACAGTCAGCCGCATCTTCTT-3', 下游引物为5'-GACAAGCTTCCCGTTCTCAG-3', 产物长度为259 bp. 应用Mx3000P定量PCR仪(Stratagene)进行Real-time PCR实验, 反应条件为95 ℃ 5 s, 60 ℃ 20 s, 72 ℃ 10 s, 40个循环. 以Folds = 2-ΔΔCt表示实验组与对照组目的基因表达的倍数比关系, 公式如下ΔΔCt = [Ct(target gene)-Ct(GAPDH)]实验组-[Ct(target gene)-Ct(GAPDH)]对照组[7]. 重复3次实验, 计算平均值. 我们发现SW480的各项指标表达量居中, 考虑到统计结果的直观性, 选择SW480为对照组, SW620, SW480/M5, LoVo, HT29, LS174T为实验组.
1.2.3 免疫组织化学方法检测大肠癌细胞Tiam1, Ecadherin, Vimentin的表达: 制作细胞爬片, 950 mL/L乙醇固定10 min, 余按试剂盒说明书操作. Tiam1, Ecadherin, Vimentin抗体工作浓度均为1:100, DAB显色, 苏木素复染, 中性树脂封固. 以PBS液取代一抗作阴性对照. 以棕黄色为阳性信号, 按照染色深浅, 分为阴性(-)、弱阳性(+)、阳性(++)和与强阳性(+++), 棕黄色越深代表阳性越强.
1.2.4 考马斯亮蓝染色观察大肠癌细胞骨架: 培养细胞爬片, PBS洗涤3次, 每次5 min, 950 mL/L乙醇固定10 min后PBS洗涤3次, 4 min/次, 1.5% Triton振荡洗涤3次, 每次8 min, PBS洗涤3次, 每次5 min, 考马斯亮蓝染液染色40 min, PBS洗去多余的染液, 空气干燥, 二甲苯透明, 中性树脂封片.
统计学处理 采用SPSS13.0统计软件包进行处理, Real-time RT-PCR的结果采用非参数Kruskal-Wallis H检验, P<0.05具有统计学意义.
细胞总RNA琼脂糖凝胶电泳可见清晰的28S、18S条带(图1).
细胞总mRNA经逆转录成cDNA后, 进行Real-time PCR检测. 通过对获得的样本Ct值进行相对定量计算分析, 结果发现SW620, SW480/M5, HT29, LoVo和LS174T中Tiam1 mRNA的表达水平分别是SW480的0.51, 7.67, 0.00, 0.36, 0.06倍, 差异具有统计学意义(P<0.05). SW620, SW480/M5, HT29, LoVo和LS174T中Ecadherin mRNA的表达水平分别是SW480的3.18, 2.27, 5.92, 0.00, 0.61倍, 差异具有统计学意义(P<0.05). SW620, SW480/M5, HT29, LoVo和LS174T中Vimentin mRNA的表达水平分别是SW480的6.08, 0.02, 0.35, 11.72, 0.00倍, 差异具有统计学意义(P<0.05, 图2).
LoVo细胞的Tiam1表达呈阳性(++), Vimentin表达呈强阳性(+++), 都定位于胞质, Ecadherin表达呈阴性(-); HT29细胞的Ecadherin表达呈阳性(++), 定位于胞膜上, Tiam1和Vimentin表达阴性(-)(图3).
LoVo细胞为长梭形或星芒状, 两端有较长较细的突起, 细胞质内可见骨架蛋白成蓝色丝网状结构, 胞核周围可见点状肌动蛋白小体, HT29细胞大多呈椭圆形, 细胞质少, 丝网状的骨架蛋白结构及点状肌动蛋白小体少(图4).
近年研究显示Tiam1对于控制细胞形态、黏附和运动以及信号传导都有重要作用, 并能够诱导肿瘤细胞的侵袭转移. 其在肺癌、乳腺癌、卵巢癌、喉癌、结肠癌等多种恶性肿瘤组织中呈阳性表达并与侵袭转移密切相关. 侵袭能力强的人大肠癌细胞株, 其Tiam1的表达高于侵袭能力弱的人大肠癌细胞株, Tiam1基因沉默的人大肠癌细胞株, 其体外生长及侵袭能力均被抑制, 肿瘤转移率明显降低, 大肠癌细胞向肺及肝转移的能力均被抑制[8-9].
EMT是指上皮细胞在特定的生理和病理情况下向间充质细胞转分化的现象, 2003年的第一届关于EMT的Boden国际会议提出形态学和侵袭运动方面的4个标准来判断细胞是否发生了EMT: (1)细胞极性的丧失; (2)伸长的细胞形态; (3)出现丝状伪足; (4)侵袭运动性[10]. EMT被看成导致癌症进展的病理过程, 特别是他与侵袭和转移有关系. 发生EMT时, 上皮细胞极性丧失, 与周围细胞和基质的接触减少, 细胞间的黏附和相互作用减少, 而细胞迁移和运动的能力增强, 同时细胞表型发生改变, 丧失了上皮表型, 如Cytokeratin, Ecadherin的逐渐丧失, 而获得间质表型, 如Vimentin, Fibronectin, α-SMA的表达等. 其中Ecadherin表达的丢失已被认为是EMT最显著的特征.
本研究通过Real-time RT-PCR检测6种大肠癌细胞Tiam1, Ecadherin, Vimentin的表达. 一般来源于肿瘤转移灶的细胞系, 其侵袭转移能力在体外高于原发灶来源的细胞系. 其中SW480, HT29和LS174T来源于肿瘤原发病灶, 其侵袭转移能力较弱; SW620和LoVo来源于大肠癌患者的淋巴结转移灶, 侵袭转移能力强; SW480\M5是本实验室前期利用裸鼠体内连续传代的方法从SW480细胞系中筛选出具有肝转移倾向的亚克隆细胞系SW480/M5, 也具有较强的侵袭转移能力.
结果发现LoVo细胞在高表达Vimentin的同时, Ecadherin的表达量是SW480的0.00倍, 表示几乎不表达, 符合细胞发生EMT时的特征. 在HT29和SW480/M5中, Vimentin表达很低, Ecadherin表达高, 与EMT的特征相反. 但是另3种细胞并不属于以上两种情况. EMT能促进肿瘤的侵袭转移, 我们推测LoVo细胞较强的侵袭转移能力可能与EMT有关, 虽然SW480/M5也具有较强的侵袭转移能力, 但是其表现出了与EMT相反的特征, Vimentin表达很低, 有文献报道Vimentin基因的甲基化有利于结肠癌细胞通过腹腔播散或是发生肝脏转移[11], SW480/M5出现这种情况可能与Vimentin甲基化有关, 其侵袭转移能力可能与EMT无关. HT29表现出了与EMT相反的特征, 符合非EMT细胞其侵袭转移能力较弱的观点. 那么, Tiam1与大肠癌细胞EMT有无关联呢? 我们发现LoVo高表达Tiam1, 而HT29几乎不表达Tiam1, 这与我们推测的Tiam1可能通过使肿瘤细胞发生EMT增强其运动能力, 促进其转移的观点相符合. 但是在另外的4种细胞中我们并没有发现这种现象. 因此, 我们推测Tiam1通过EMT促进LoVo和HT29这两种细胞的侵袭转移. 我们选择这两种细胞进一步行免疫组织化学检测, 结果与PCR检测结果一致. 同时我们通过考马斯染色观察这两种细胞的骨架蛋白, 发现LoVo细胞很符合细胞发生EMT时的形态特征, HT29正相反. 进一步证实LoVo的细胞形态利于其侵袭转移, HT29的细胞形态不利于其侵袭转移.
我们认为在LoVo和HT29中Tiam1促进大肠癌转移的机制可能与EMT发生有关. 但是, 在SW480, SW620, SW480/M5和LS174T这几种细胞中, 我们却没有发现这样的趋势, 我们推测, 只有一部分大肠癌细胞的侵袭转移是Tiam1通过EMT促进的, 还有一部分与此并没有关联. 文献报道Tiam1是Rac1的特异性鸟苷酸转换因子(GEF), 被活化后通过促进GDP释放而促进GTP结合到Rho家族成员中[12-13], Rac1被激活, Rho样小GTP酶通过改变肌动蛋白细胞骨架的组成而参与大量的细胞活动. 例如促进细胞运动和迁移, 参与基因表达调控、细胞增殖与凋亡等[14-15]. 至于Tiam1是不是通过Rho通路促进肿瘤细胞EMT的发生, 这尚需要进一步的研究. 然而近年有研究指出, Tiam1通过调节Rac的活性维持AJ, 癌蛋白Src可诱导AJ分解进而发生EMT, 导致细胞运动, 但这个过程需要Rac活化剂Tiam1的局部磷酸化及分解[16]. 本实验只发现在LoVo和HT29这2种大肠癌细胞中Tiam1可能是通过EMT促进肿瘤侵袭转移, 其余的大肠癌细胞会不会是Tiam1的局部磷酸化及分解后, Src诱导的AJ分解进而发生EMT也需要进一步研究.
大肠癌是发病率非常高的恶性肿瘤, 其侵袭和转移是一个复杂过程. 近年研究Tiam1与肿瘤的侵袭转移有关, 而EMT被看成导致肿瘤进展的病理过程, 特别是他与侵袭和转移有关系. 本文探讨了Tiam1和EMT在不同转移能力的大肠癌细胞中的关系.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
在大肠癌侵袭研究领域, Tiam1基因和上皮细胞间质转化(EMT)成为近年研究热点. 大肠癌中高表达Tiam1的细胞也高表达Vimentin, 具有更多的转移表型, 同时Ecadherin的表达减少, 发生了EMT.
Tiam1和EMT与肿瘤的侵袭转移有关已被广泛认识, 以往的研究显示侵袭能力强的人大肠癌细胞株, 其Tiam1的表达高于侵袭能力弱的人大肠癌细胞株, 发生EMT时, 肿瘤细胞侵袭转移能力更强.
本研究中首次报道Tiam1, Ecadherin和Vimentin在不同转移能力的大肠癌细胞中的表达, 探讨关于Tiam1和EMT在大肠癌侵袭转移中的共同作用.
Tiam1与大肠癌细胞EMT的关系目前相关研究不多见, 本文有一定的研究价值, 具有一定的科学性和可读性.
编辑: 李军亮 电编: 何基才
| 1. | Habets GG, Scholtes EH, Zuydgeest D, van der Kammen RA, Stam JC, Berns A, Collard JG. Identification of an invasion-inducing gene, Tiam-1, that encodes a protein with homology to GDP-GTP exchangers for Rho-like proteins. Cell. 1994;77:537-549. [PubMed] [DOI] |
| 2. | Minard ME, Ellis LM, Gallick GE. Tiam1 regulates cell adhesion, migration and apoptosis in colon tumor cells. Clin Exp Metastasis. 2006;23:301-313. [PubMed] [DOI] |
| 3. | Wu Y, Zhou BP. New insights of epithelial-mesenchymal transition in cancer metastasis. Acta Biochim Biophys Sin (Shanghai). 2008;40:643-650. [PubMed] [DOI] |
| 5. | Fraga CH, True LD, Kirk D. Enhanced expression of the mesenchymal marker, vimentin, in hyperplastic versus normal human prostatic epithelium. J Urol. 1998;159:270-274. [PubMed] [DOI] |
| 7. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 8. | Liu L, Wu DH, Ding YQ. Tiam1 gene expression and its significance in colorectal carcinoma. World J Gastroenterol. 2005;11:705-707. [PubMed] |
| 9. | Liu L, Zhang Q, Zhang Y, Wang S, Ding Y. Lentivirus-mediated silencing of Tiam1 gene influences multiple functions of a human colorectal cancer cell line. Neoplasia. 2006;8:917-924. [PubMed] [DOI] |
| 10. | Ahmed S, Nawshad A. Complexity in interpretation of embryonic epithelial-mesenchymal transition in response to transforming growth factor-beta signaling. Cells Tissues Organs. 2007;185:131-145. [PubMed] [DOI] |
| 11. | Shirahata A, Sakata M, Sakuraba K, Goto T, Mizukami H, Saito M, Ishibashi K, Kigawa G, Nemoto H, Sanada Y. Vimentin methylation as a marker for advanced colorectal carcinoma. Anticancer Res. 2009;29:279-281. [PubMed] |
| 12. | Habets GG, van der Kammen RA, Stam JC, Michiels F, Collard JG. Sequence of the human invasion-inducing TIAM1 gene, its conservation in evolution and its expression in tumor cell lines of different tissue origin. Oncogene. 1995;10:1371-1376. [PubMed] |
| 13. | Hoshino M, Sone M, Fukata M, Kuroda S, Kaibuchi K, Nabeshima Y, Hama C. Identification of the stef gene that encodes a novel guanine nucleotide exchange factor specific for Rac1. J Biol Chem. 1999;274:17837-17844. [PubMed] [DOI] |
| 14. | Mertens AE, Roovers RC, Collard JG. Regulation of Tiam1-Rac signalling. FEBS Lett. 2003;546:11-16. [PubMed] [DOI] |
| 15. | Minard ME, Kim LS, Price JE, Gallick GE. The role of the guanine nucleotide exchange factor Tiam1 in cellular migration, invasion, adhesion and tumor progression. Breast Cancer Res Treat. 2004;84:21-32. [PubMed] [DOI] |