修回日期: 2009-10-10
接受日期: 2009-10-19
在线出版日期: 2009-11-08
目的: 探讨上海人群中TNF-α、TGF-β1及IL-10单核苷酸多态性与乙型肝炎后肝硬化的关联.
方法: 运用PCR-RFLP结合测序的方法, 测定119例健康对照者与169例肝硬化患者TNF-α基因-308G/A、TGF-β1基因-509T/C、IL-10基因-592A/C的多态性, 并确定其基因型与等位基因频率的分布.
结果: 乙型肝炎后肝硬化患者TNF-α的GG基因型和G等位基因出现的频率明显高于健康对照者(P<0.001, OR>3); TGF-β1-509位点的3种基因型整体间没有差异, 但T等位基因出现的频率明显高于健康对照者(P<0.05); IL-10-592A/C的多态性在乙型肝炎后肝硬化患者与健康对照者之间差异没有统计学意义.
结论: TNF-α-308G/A与TGF-β1-509T/C的多态性可能与乙型肝炎后肝硬化的遗传易感性有关.
引文著录: 姜在来, 张玮, 张辉, 刘一博, 苏式兵. TNF-α、TGF-β1和IL-10基因多态性与乙型肝炎后肝硬化的关系. 世界华人消化杂志 2009; 17(31): 3263-3268
Revised: October 10, 2009
Accepted: October 19, 2009
Published online: November 8, 2009
AIM: To investigate the relationship between single nucleotide polymorphisms (SNPs) of the tumor necrosis factor-α (TNF-α), transforming growth factor-β1 (TGF-β1) and interleukin-10 (IL-10) genes and post-hepatitis B cirrhosis in the Shanghai Chinese population.
METHODS: The TNF-α-308G/A, TGF-β1-509T/C and IL-10-592A/C SNPs were determined by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) in combination with sequence analysis in 169 patients with post-hepatitis B cirrhosis and 119 healthy controls. The genotypes and allele frequency distribution of these SNPs were then analyzed.
RESULTS: TNF-α-308 GG genotype and G allele frequency in patients with post-hepatitis B cirrhosis were significantly higher than those in healthy controls (P < 0.001, OR > 3). Although there were no significant differences in TGF-β1-509 genotypes between post-hepatitis B patients and healthy controls, the T allele frequency was significantly higher in post-hepatitis B patients than in healthy controls (P < 0.05). There were also no significant differences in IL-10-592 genotypes and allele frequencies between post-hepatitis B patients and healthy controls.
CONCLUSION: The TNF-α-308G/A and TGF-β1-509T/C SNPs may be related to the susceptibility to post-hepatitis B cirrhosis.
- Citation: Jiang ZL, Zhang W, Zhang H, Liu YB, Su SB. Relationship between TNF-α, TGF-β1 and IL-10 genetic polymorphisms and post-hepatitis B cirrhosis. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3263-3268
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3263.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3263
肝硬化是一种严重危害人们健康的疾病, 在我国乙型肝炎病毒(hepatitis B virus, HBV)慢性感染是引起肝硬化的主要原因[1]. 健康者感染HBV后是否会进展成肝硬化, 可能与个人的体质不同或与患者的遗传易感性有关. 因为不同人群和不同个体DNA序列的差异, 即基因多态性常反映了慢性疾病发病的遗传易感性, 所以, 研究肝硬化患者的基因多态性有助于了解肝硬化的产生、发展以及对药物治疗的反应. 已有研究表明, 单核苷酸多态性(single nucleotide polymorphisms, SNPs)与肝硬化的发生及严重程度等密切相关[2-4]. 因此, 本研究旨在探讨上海人群中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)和白介素-10(interleukin-10, IL-10)SNPs与乙型肝炎后肝硬化的关联.
收集上海市龙华医院住院和门诊患者乙型肝炎后肝硬化患者169例, 年龄为18-65岁, 其中男97例, 女72例, 均排除其他肝炎病毒感染和酒精、药物等其他原因引起的肝硬化. 肝硬化诊断标准参考"病毒性肝炎防治方案"[5]. 献血中心献血员和健康志愿者119例, 男80例, 女39例, 年龄18-50岁. DNA提取试剂盒(Tianamp Blood DNA Kit)购自上海TIANGEN公司. RNase A、Taq聚合酶和限制性内切酶NcoⅠ购自上海生工公司. LA Taq聚合酶、限制性内切酶Eco81Ⅰ和限制性内切酶AfaⅠ购自上海宝生物公司. 超低温冰箱(-70 ℃ Termo)用来储存DNA. DNA循环合成仪(Ampgene9700)、水平电泳仪和电泳槽(Tanon EPs 300)、紫外透射仪(Tanon UV-2000)、凝胶成像分析系统(Alpha Innotech)以及测序仪(ABI3730)用来做基因型鉴定. 本研究经上海中医药大学伦理委员会批准.
1.2.1 标本采集: 分别抽取乙型肝炎后肝硬化患者和正常献血者全血1 mL, 以EDTA抗凝. 在4 ℃条件下3000 r/min, 离心5 min, 分离去除上清液(血清). 沉淀物(血细胞)用于基因组DNA的提取.
1.2.2 模板DNA的提取: 采用Tianamp Blood DNA Kit提取基因组DNA, 具体操作按其说明书进行.
1.2.3 基因型鉴定: 采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)结合测序的方法. (1)PCR扩增: 分别扩增包含308位点的TNF-α、包含509位点的TGF-β和包含592位点的IL-10. PCR反应总体积为20 μL, 基因组DNA 2 μL, 上、下游引物(表1)各1 μL, LA Taq酶1 U, 10×PCR Buffer 2 μL、25 mmol/L MgCl2 2 μL、25 mmol/L dNTPs 2 μL、去离子水9.8 μL; 先94 ℃ 5 min; 再94 ℃ 30 s、60 ℃ 30 s及72 ℃ 45 s, 35个循环; 72 ℃延伸10 min. IL-10退火温度为58 ℃, 其他条件同上. (2)PCR扩增产物经含EB替代品的10 g/L琼脂糖凝胶上电泳, 于紫外灯下观察结果, 与Marker相对照若为所需要的扩增片段则进行下一步酶切试验. (3)直接用PCR产物作为酶切底物, 具体反应体积配置参照各内切酶(表1)的说明书. 酶切后于30 g/L的琼脂糖凝胶上电泳2 h, 在凝胶成像分析系统下拍照. (4)为确保试验结果的可靠性, 我们从肝硬化患者和健康对照者中随机抽取5%的样本, 委托生物芯片上海国家工程研究中心试验室进行了测序.
| 引物序列 | PCR产物(bp) | 内切酶 | |
| TNF-α-308 | 上游引物: 5'-AGGCAATAGGTTTTGAGGGCCAT-3' | 346 | NcoⅠ(24 bp/322 bp) |
| 下游引物: 5'-GAGCGTCTGCTGGCTGGGTG-3' | |||
| TGF-β1-509 | 上游引物: 5'-CTCCATTTCCAGGTGTGGTCCCA-3' | 865 | Eco81Ⅰ(237 bp/628 bp) |
| 下游引物: 5'-CACCAAAGCGGGTGATCCAGAT-3' | |||
| IL-10-592 | 上游引物: 5'-GGTGAGCACTACCTGACTAGC-3' | 412 | AfaⅠ(176 bp/236 bp) |
| 下游引物: 5'-CCTAGGTCACAGTGACGTGG-3' |
统计学处理 所有数据运用SPSS15.0进行计算, 两组间的差异用四格表χ2检验, 设定P<0.05为有统计学意义, 并认为组间存在显著性差异.
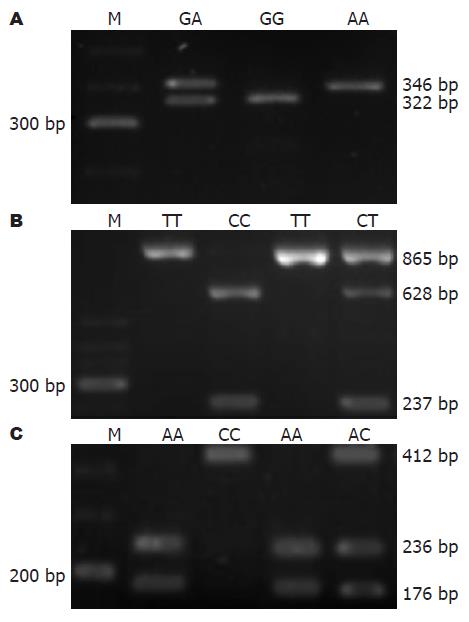
扩增含有-308位点的TNF-α, PCR产物大小为346 bp, 如果-308位点为G则会被内切酶NcoⅠ切成2个片段24 bp和322 bp, 由于24 bp片段太小, 在琼脂糖凝胶上看不到, 所以只显示有一条322 bp的片段; 如果-308位点为A则不会被内切酶NcoⅠ切开, 只显示有一条346 bp的片段. 纯合子GG基因型为1条带(322 bp), 突变杂合子GA基因型为2条带(322 bp/346 bp), 突变纯合子AA基因型应为1条带(346 bp)(图1A).
在169例乙型肝炎后肝硬化患者和119例健康对照者中3种基因型GA、AA、GG出现的频率分别是11%和32%, 3%和8%及86%和60%, 3组数据整体之间存在显著性差异(均P<0.001, 表2). 乙型肝炎后肝硬化患者中突变杂合子GA出现的频率低于健康对照者, 二者之间存在显著性差异(11% vs 32%, P<0.001); 突变纯合子AA出现的频率也低于健康对照者(3% vs 8%), 但没有统计学意义; 而纯合子GG基因型出现的频率高于健康对照者(86% vs 60%), 将GG基因型与含有A等位基因的基因型进行四格表检验, 发现二者之间存在显著性差异(OR = 4.085, P<0.001, 表3). 乙型肝炎后肝硬化患者和健康对照者中等位基因G和A出现的频率分别是91%和77%, 9%和23%, 有统计学意义(OR = 3.308, P<0.001, 表4).
| 基因型 | 健康者n(%) | 肝硬化患者n(%) | P值 | OR值 | 95%CI |
| TNF-α-308G/A | 0.000 | ||||
| GA | 38(32) | 18(11) | 0.000 | 2.998 | 1.632-5.506 |
| AA | 10(8) | 6(3) | 0.095 | 2.367 | 0.837-6.690 |
| GG | 71(60) | 145(86) | 0.053 | 1.438 | 0.995-2.078 |
| TGF-β1-509T/C | 0.121 | ||||
| CC | 39(33) | 38(22) | 0.142 | 1.458 | 0.880-2.414 |
| CT | 52(44) | 79(47) | 0.754 | 0.935 | 0.613-1.425 |
| TT | 28(23) | 52(31) | 0.307 | 0.765 | 0.457-1.281 |
| IL-10-592A/C | 0.821 | ||||
| AA | 51(43) | 75(44) | 0.873 | 0.966 | 0.631-1.479 |
| AC | 56(47) | 74(44) | 0.736 | 1.075 | 0.707-1.634 |
| CC | 12(10) | 20(12) | 0.677 | 0.852 | 0.401-1.810 |
| 基因型 | 健康者n(%) | 肝硬化患者n(%) | P值 | OR值 | 95%CI |
| GA+AA | 48(40) | 24(14) | 0.000 | 2.840 | 1.650-4.890 |
| GG | 71(60) | 145(86) | 0.000 | 4.085 | 2.318-7.196 |
| 等位基因频率 | P值 | OR值 | 95%CI | ||
| 健康者n(%) | 肝硬化患者n(%) | ||||
| TNF-α-308G/A | |||||
| G | 180(77) | 308(91) | 0.000 | 3.308 | 2.052-5.333 |
| A | 58(23) | 30(9) | |||
| TGF-β1-509T/C | |||||
| C | 130(55) | 155(46) | 0.038 | 1.421 | 1.019-1.983 |
| T | 108(45) | 183(54) | |||
| IL-10-592A/C | |||||
| A | 158(67) | 224(66) | 0.977 | 0.995 | 0.700-1.413 |
| C | 80(33) | 114(34) | |||
扩增含有-509位点的TGF-β1, PCR产物大小为865 bp, 如果-509位点为C则会被内切酶Eco81Ⅰ切成2个片段237 bp和628 bp; 如果-509位点为T则不会被内切酶Eco81Ⅰ切开, 只显示有一条865 bp的片段. 突变纯合子CC基因型应为2条带(237 bp/628 bp), 纯合子TT基因型为1条带(865 bp), 突变杂合子CT基因型为3条带(237 bp/628 bp/865 bp), 3种基因型见图1B. 乙型肝炎后肝硬化患者和健康对照者的3种基因型CC、CT、TT出现的频率分别是22%和33%、47%和44%及31%和23%, 3组数据间整体差异没有统计学意义(表1), 但是等位基因C和T在这两组中出现的频率分别是46%和55%, 54%和45%, 有统计学意义(OR = 1.421, P<0.05, 表4).
扩增含有-592位点的IL-10, PCR产物大小为412 bp, 如果592位点为A则会被内切酶AfaⅠ切成2个片段176 bp和236 bp; 如果-592位点为C则不会被内切酶AfaⅠ切开, 只显示有1条412 bp的片段. 纯合子AA基因型为2条带(176 bp/236 bp), 突变纯合子CC基因型应为1条带(412 bp), 突变杂合子AC基因型为3条带(176 bp/236 bp/412 bp), 3种基因型见图1C. 在此位点对乙型肝炎后肝硬化患者和健康对照者的基因型和等位基因出现的频率进行统计分析, 未发现有统计学差异(表2, 表4).
乙型肝炎后肝硬化的发病主要是由HBV的感染和侵袭引起, 同时还与患者的遗传易感性及其免疫功能等相关. SNPs是遗传易感性研究的主要生物学标志之一, 他与感染性疾病的进展有关[6-7]. 患者通过SNPs表现出来的遗传易感性, 既可能成为HBV的持续存在而不发生乙型肝炎或某些乙型肝炎患者更易进展成肝硬化的原因, 也可能是影响药物治疗的效果的缘由. 研究表明IL-10[2]和TGF-β1[3-4]启动子区某些位点的多态性与乙型肝炎的进展有关, 因此有必要研究乙型肝炎后肝硬化的候选基因, 探讨这些基因对肝硬化的影响以及某些位点的基因型是否为该病易感基因的生物学标志.
HBV的清除主要依赖细胞免疫, 特别是细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL), CTL通过清除HBV感染的细胞和分泌细胞因子而清除HBV[8]. IL-10主要是由巨噬细胞分泌, 他能下调Thl型细胞因子的表达, 是一种强有力的免疫抑制因子和协调刺激分子[9], 从而影响机体对HBV的清除. 本试验研究了119例健康对照者和169例肝硬化患者, 探讨IL-10-592A/C位点SNPs与乙型肝炎后肝硬化的关系, 没有发现该位点的多态性与肝硬化的易感性有关, 这与Miyazoe et al[2]的报道一致. 另外, Edwards-Smith et al[10]研究IL-10(-1082/-819/-592)3个位点多态性与药物治疗的关系, 发现单倍体ATA与丙型病毒性肝炎患者抵抗干扰素α治疗有关.
TGF-β1和TNF-α可以通过不同途径影响肝纤维化的进程, 其中TGF-β1是促进肝纤维化形成的一个重要的细胞因子, 该细胞因子可以通过刺激细胞外基质的表达和沉积、抑制细胞外基质的降解等多种机制参与肝纤维化的形成[11]; 而TNF-α的产生是受遗传控制的, 他是机体针对炎症应答过程中产生的第一个细胞因子[12]. TNF-α主要由单核细胞、枯否氏细胞产生, 可促进肝星状细胞增生和纤维增生, 并与其他细胞因子一起对抗肝细胞生长, 阻止延缓肝细胞的再生, 参与肝硬化的形成和发展. 持续高诱导水平的TNF-α, 可加速病情的进展. 体外研究表明, TNF-α基因启动子-308A等位基因与TNF-α基因转录活性升高有关[13], 因此-308A等位基因常被选为肝硬化易感基因的遗传标记.
本试验没有发现TGF-β1-509位点基因型与乙型肝炎后肝硬化的发生有关, 这与杨再兴 et al[3-4]和Kim et al[14]所报道的结果一致, 但是我们发现T等位基因在乙型肝炎后肝硬化患者中出现的频率明显高于健康对照者, 同时OR>1说明T等位基因的危险性高, 推测T等位基因可能是乙型肝炎后肝硬化的易感标记. 另外杨再兴 et al[4]还发现TGF的-509位点和codon10位点等位基因存在连锁不平衡, 其单倍型形式主要是C-T和T-C, 其中单倍型C-T影响TGF-β1的血浆浓度, 并且与肝硬化的发生有关. 对TNF-α-308位点的研究报道不一, 程元桥 et al[15]和林菊生 et al[16]研究表明肝硬化患者TNF-α-308GA基因型频率明显高于对照组, 并且携带TNF-α-308A等位基因的危险性也高于对照组; Miyazoe et al[2]研究了TNF-α-308位点在日本人群中的多态性, 对213例HBV携带者和52例健康对照着进行检测, 结果表明肝硬化患者(包括乙型肝炎)与HBV无症状携带者之间没有差异; 本试验与以上学者的研究结果均不同, 我们发现GG基因型和G等位基因在乙型肝炎后肝硬化患者中出现的频率明显高于健康对照组, 并且OR>3表明GG基因型和G等位基因的危险性比较高, 推测GG基因型和G等位基因可能与乙型肝炎后肝硬化的易感性有关. 程元桥 et al[15]和林菊生 et al[16]的报道中没有发现-308AA基因型, 可能是由于所选样本的偏倚引起, 而本试验中AA基因型在乙型肝炎后肝硬化患者和健康对照着中出现的频率分别是3%和8%, 这可能是导致试验结果差异的主要原因. Miyazoe et al[2]的报道是针对日本人群, 而本试验是针对上海人群的, 种族差异也可能是引起结果不同的原因.
总之, 我们针对上海人群, 研究了TNF-α-308G/A、TGF-β1-509T/C和IL-10-592A/C这3个位点多态性与肝硬化的关系, 发现TNF-α GG基因型和G等位基因以及TGF-β1-509T等位基因在乙型肝炎后肝硬化患者中出现的频率明显高于健康对照者, 推测TNF-α GG基因型和G等位基因以及TGF-β1-509T等位基因可能是乙型肝炎后肝硬化的易感标志. 试验结果与已报道的有所异同, 这可能是由于所选的样本例数以及地域和种族的不同所引起的. 乙型肝炎后肝硬化与SNPs的相关性及其发病机制仍需进一步研究.
乙型肝炎后肝硬化的发病主要是由HBV感染和侵袭引起, 同时还与患者的遗传易感性及免疫功能等相关. SNPs是遗传易感性研究的主要生物学标志之一, 他与感染性疾病的进展有关.
高润平, 教授, 吉林大学第一医院肝病科
Miyazoe et al研究了TNF-α-308位点在日本人群中的多态性, 对213例HBV携带者和52例健康对照着进行检测, 结果表明肝硬化患者(包括乙型肝炎)与HBV无症状携带者之间没有差异.
本研究针对上海人群, 研究了TNF-α-308G/A、TGF-β1-509T/C和IL-10-592A/C这3个位点多态性与肝硬化的关系, 发现TNF-α GG基因型和G等位基因以及TGF-β1-509T等位基因在乙型肝炎后肝硬化患者中出现的频率明显高于健康对照者, 推测TNF-α GG基因型和G等位基因以及TGF-β1-509T等位基因可能是乙型肝炎后肝硬化的易感标志.
本研究设计合理, 方法先进, 从某些细胞因子基因多态性的角度来研究和探讨HBV感染后肝硬化的遗传易感性, 具有实际意义和较好的参考价值.
编辑: 李军亮 电编: 何基才
| 1. | 王 吉耀, 廖 二元, 胡 品津. 内科学. 第1版. 北京: 人民卫生出版社 2005; 496. |
| 2. | Miyazoe S, Hamasaki K, Nakata K, Kajiya Y, Kitajima K, Nakao K, Daikoku M, Yatsuhashi H, Koga M, Yano M. Influence of interleukin-10 gene promoter polymorphisms on disease progression in patients chronically infected with hepatitis B virus. Am J Gastroenterol. 2002;97:2086-2092. [PubMed] [DOI] |
| 6. | Helminen M, Lahdenpohja N, Hurme M. Polymorphism of the interleukin-10 gene is associated with susceptibility to Epstein-Barr virus infection. J Infect Dis. 1999;180:496-499. [PubMed] [DOI] |
| 7. | Mozzato-Chamay N, Mahdi OS, Jallow O, Mabey DC, Bailey RL, Conway DJ. Polymorphisms in candidate genes and risk of scarring trachoma in a Chlamydia trachomatis--endemic population. J Infect Dis. 2000;182:1545-1548. [PubMed] [DOI] |
| 9. | Redpath S, Ghazal P, Gascoigne NR. Hijacking and exploitation of IL-10 by intracellular pathogens. Trends Microbiol. 2001;9:86-92. [PubMed] [DOI] |
| 10. | Edwards-Smith CJ, Jonsson JR, Purdie DM, Bansal A, Shorthouse C, Powell EE. Interleukin-10 promoter polymorphism predicts initial response of chronic hepatitis C to interferon alfa. Hepatology. 1999;30:526-530. [PubMed] [DOI] |
| 11. | Gewaltig J, Mangasser-Stephan K, Gartung C, Biesterfeld S, Gressner AM. Association of polymorphisms of the transforming growth factor-beta1 gene with the rate of progression of HCV-induced liver fibrosis. Clin Chim Acta. 2002;316:83-94. [PubMed] [DOI] |
| 12. | Warzocha K, Ribeiro P, Bienvenu J, Roy P, Charlot C, Rigal D, Coiffier B, Salles G. Genetic polymorphisms in the tumor necrosis factor locus influence non-Hodgkin's lymphoma outcome. Blood. 1998;91:3574-3581. [PubMed] |
| 13. | Wilson AG, Symons JA, McDowell TL, McDevitt HO, Duff GW. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc Natl Acad Sci USA. 1997;94:3195-3199. [PubMed] [DOI] |
| 14. | Kim YJ, Lee HS, Im JP, Min BH, Kim HD, Jeong JB, Yoon JH, Kim CY, Kim MS, Kim JY. Association of transforming growth factor-beta1 gene polymorphisms with a hepatocellular carcinoma risk in patients with chronic hepatitis B virus infection. Exp Mol Med. 2003;35:196-202. [PubMed] |