修回日期: 2009-10-09
接受日期: 2009-10-22
在线出版日期: 2009-11-08
目的: 探讨河南省食管癌高发区居民食管鳞癌组织中DAPK mRNA和蛋白的表达特征及意义.
方法: 应用原位杂交和免疫组织化学法检测50例食管鳞癌组织、17例癌旁不典型增生组织及20例正常食管黏膜组织中DAPK mRNA和蛋白的表达, 并分析DAPK表达与临床病理特征的关系.
结果: 在食管鳞癌癌变过程中DAPK在正常黏膜组织、癌旁不典型增生组织及癌组织中mRNA及蛋白的表达组间比较有明显差异(χ2 = 14.655, 7.998, 均P<0.05); 不同TNM分级及有无淋巴结转移的食管鳞癌组织之间DAPK mRNA及蛋白表达差异均有统计学意义(均P<0.05). DAPK mRNA及蛋白食管鳞癌组织中的表达呈正相关关系(γ = 0.743, P = 0.000).
结论: 食管鳞癌组织中DAPK mRNA与蛋白表达均降低, 其表达降低或者缺失可能与食管鳞癌发生发展有关; 检测DAPK mRNA及蛋白的表达有望成为食管鳞癌早期诊断和判断预后的分子指标之一.
引文著录: 刘莺, 李克, 刘文静, 王居峰, 樊青霞. DAPK mRNA和蛋白在食管鳞癌组织中的表达及意义. 世界华人消化杂志 2009; 17(31): 3218-3222
Revised: October 9, 2009
Accepted: October 22, 2009
Published online: November 8, 2009
AIM: To explore the significance of death-associated protein kinase (DAPK) expression in esophageal squamous cell carcinoma (ESCC) derived from a high-incidence area in Henan Province.
METHODS: Fifty ESCC samples, 17 tumor-adjacent samples and 20 normal esophageal mucosa samples were used in the study. The expression of DAPK mRNA and protein was detected by in situ hybridization and immunohistochemistry, respectively. The correlations of DAPK expression with clinicopathological features were analyzed.
RESULTS: There were significant differences in the relative contents of DAPK mRNA and protein among normal mucosa tissue, tumor-adjacent tissue and cancer tissue (χ2 = 14.655 and 7.998, respectively; both P < 0.05). The relative contents of DAPK mRNA and protein were significantly correlated with TNM stage and lymph node metastasis (both P < 0.05). In addition, a positive correlation was also noted in the expression of DAPK mRNA and protein in esophageal squamous cell carcinoma (γ = 0.743, P = 0.000).
CONCLUSION: The expression of DAPK mRNA and protein is downregulated in ESCC, suggesting that DAPK may be related to the oncogenesis of ESCC. Combined detection of the expression of DAPK mRNA and protein may be used for early diagnosis and prognosis of ESCC.
- Citation: Liu Y, Li K, Liu WJ, Wang JF, Fan QX. Significance of death-associated protein kinase expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3218-3222
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3218.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3218
死亡相关蛋白激酶(death associated protein kinase, DAPK)[1]是在基因组中扫描启动细胞凋亡的基因和抑制肿瘤基因时发现的一种促凋亡蛋白. 研究显示, DAPK参与了多条细胞凋亡信号转导途径, 导致细胞增殖与细胞凋亡之间的动态失衡, 变异基因积累, 细胞生长周期延长致使肿瘤发生[2-4]. 本研究采用原位杂交及免疫组织化学2种方法联合检测了食管癌高发区河南省安阳市的食管癌患者手术切除的癌组织DAPK mRNA和蛋白的表达情况, 旨在进一步探讨DAPK在食管癌发生发展中的作用, 寻找检测食管癌的新的分子生物学指标.
所有标本均取自食管癌高发区河南省安阳市肿瘤医院, 所有病例术前均无化疗、放疗及免疫治疗史. 其中男37例, 女13例, 年龄41-72(平均59.3±8.1)岁.
1.2.1 免疫组织化学和原位杂交染色: 50例标本分别取自无坏死癌灶、癌旁3 cm以内及远端正常黏膜组织(经HE染色证实, 癌旁组织中17例有中-重度以上不典型增生或原位癌), 经40 g/L多聚甲醛固定, 常规脱水, 石蜡包埋, 连续切片, 切片厚度4-6 μm, 分别用于HE、免疫组织化学及原位杂交染色. 50例均经组织学证实为鳞状细胞癌. 其中组织学分级Ⅰ级17例, Ⅱ级11例, Ⅲ级22例; 伴淋巴结转移者18例, 无淋巴结转移者32例; 浸润黏膜下层或浅肌层者19例, 浸润深肌层或外膜层者31例; TNM分期(按1997年UICC的TNM分期):Ⅰ-Ⅱ期16例, Ⅲ-Ⅳ期34例. 兔抗人多克隆抗体DAPK购自武汉博士德公司, SP免疫组织化学试剂盒购自北京中杉金桥生物技术开发公司. 采用SP法, DAPK单抗稀释, 稀释倍数均为1:150, DAB显色, 苏木素复染. 染色步骤严格按说明书进行, 以PBS液代替一抗作为阴性对照. 原位杂交预杂交液、SA-Bio-AP、BCIP/NBT均购自武汉博士德生物技术有限公司. 原位杂交5'端生物素标记、全硫代修饰探针由北京奥科生物技术有限公司合成. DAPK探针序列: CAGCTCGCCACCTGCAACGA. 标本经新鲜配制二甲苯脱蜡, 梯度酒精脱水后, 用新鲜配制的0.5% H2O2室温处理30 min, 以灭活内源性过氧化物酶; 3%柠檬酸新鲜配制蛋白酶(0.01 g/L), 37 ℃, 10 min, 消化标本DNA结合蛋白; 每张玻片滴加20 μL不含探针的预杂交液(42 ℃), 预杂交4 h; 加含探针(1 ng/L)的杂交液, 42 ℃湿盒内杂交12 h; 0.1×标准柠檬酸盐(SSC)42 ℃洗后, 加SA-Bio-AP 37 ℃, 10 min; 漂洗后加BCIP/NBT, 避光显色2-4 h. 以不含探针的标本作阴性对照.
1.2.2 免疫组织化学及原位杂交染色结果判定: DAPK蛋白阳性信号呈浅黄色至棕黄色颗粒, 位于细胞质内; mRNA阳性信号呈棕紫蓝色颗粒样物质, 也位于细胞质内. 高倍镜下随机选取5个视野(每个视野观察细胞数不少于200个), 按阳性细胞所占百分比及着色深浅进行结果判定[5-6]. 采用9分评分制: 按照阳性细胞比例≤10%为1分, 10%-50%为2分, >50%为3分; 按染色强弱: 阴性为0分; 淡黄(蓝)色染色为1分; 中度黄(蓝)色染色为2分, 棕黄(紫蓝)色染色为3分. 然后按照"阳性细胞得分×染色强弱得分"计总分, 总分<3为阴性, 总分≥3为阳性.
统计学处理 应用SPSS13.0统计学软件, 行χ2检验和Spearman相关系数分析, 检验水准α = 0.05.
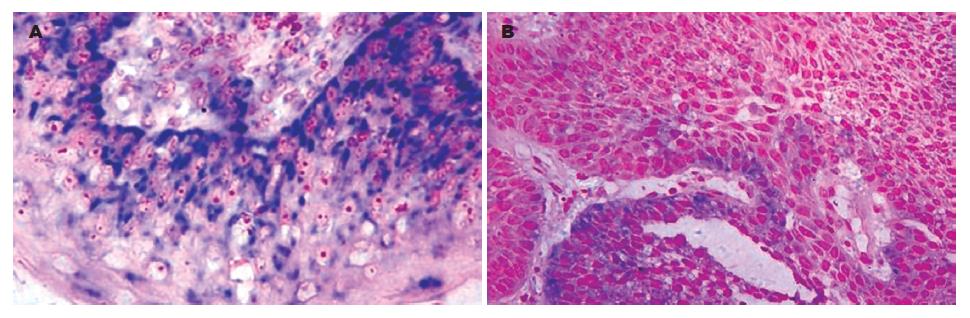
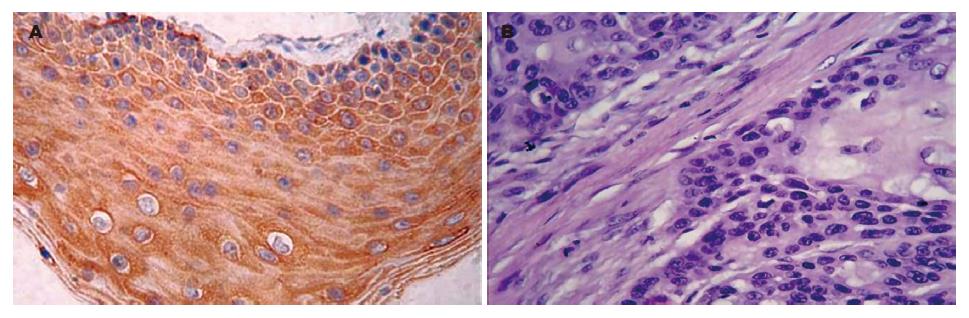
DAPK mRNA定位于细胞胞质中, 呈蓝紫色颗粒. 对照组标本中无阳性信号显示(表1, 图1). DAPK蛋白定位于细胞胞质中, 呈浅黄色至棕黄色颗粒. 对照组标本中无阳性信号显示(表1, 图2).
| 分组 | DAPK蛋白 | DAPK mRNA | |||||
| n | 阳性n(%) | χ2值 | P值 | 阳性n(%) | χ2值 | P值 | |
| 正常黏膜上皮 | 20 | 17(85.0) | 14(70.0) | ||||
| 非典型增生 | 17 | 11(64.7) | 14.655 | 0.001 | 9(52.9) | 7.998 | 0.018 |
| 鳞癌 | 50 | 19(38.0) | 17(34.0) | ||||
在食管鳞癌癌变过程中DAPK蛋白及mRNA表达与食管鳞癌患者的性别、年龄、组织学分级及浸润深度无关(P>0.05), 与淋巴结转移及TNM分期有关(均P<0.05, 表2).
| 病理特征 | DAPK蛋白 | DAPK mRNA | |||||
| n | 阳性n(%) | χ2值 | P值 | 阳性n(%) | χ2值 | P值 | |
| 组织学级 | |||||||
| Ⅰ | 17 | 7(41.2) | 0.714 | 0.700 | 4(23.5) | ||
| Ⅱ | 11 | 3(27.0) | 5(45.5) | 1.554 | 0.460 | ||
| Ⅲ | 22 | 9(40.9) | 8(36.4) | ||||
| 浸润深度 | |||||||
| 浅层 | 19 | 5(26.3) | 1.066 | 0.302 | 4(21.1) | 1.453 | 0.228 |
| 深层 | 31 | 14(45.2) | 13(41.9) | ||||
| 淋巴结转移 | |||||||
| 无 | 32 | 16(50.0) | 4.110 | 0.043 | 15(46.9) | 5.069 | 0.024 |
| 有 | 18 | 3(16.7) | 2(11.1) | ||||
| TNM分期 | |||||||
| Ⅰ、Ⅱ | 16 | 11(68.8) | 7.621 | 0.006 | 10(62.5) | 6.752 | 0.009 |
| Ⅲ、Ⅳ | 34 | 8(23.5) | 7(20.6) | ||||
DAPK定位于人类染色体9q34.1, 相对分子质量160 kDa[7]. 是一种钙离子/钙调蛋白调节的丝氨酸/ 苏氨酸蛋白激酶, 具有调节细胞的生存和凋亡及抑制肿瘤的作用[8-10]. DAPK在多种肿瘤细胞和组织中出现表达丢失, 而且该表达缺失也与其CpG的甲基化改变密切相关. DAPK的结构包括一个核心的激酶区、钙离子/钙调蛋白结合区、锚蛋白重复序列区、P-环、细胞骨架结合区、死亡区和富含丝氨酸的尾部7个部分. 核心激酶区位于钙离子/钙调蛋白结合区与N-端之间, 由11个丝/苏氨酸结构组成, 还含有一个保守的赖氨酸残基, 该残基与ATP的结合有关, 若发生突变(K42W或K42A)会引起凋亡作用的消失[11-12].
由于DAPK具有促细胞凋亡、抑制细胞黏附、抑制细胞迁移等作用, 因而在肿瘤的发生、发展及转移中发挥重要作用[13-16]. DAPK基因启动子甲基化后, 表达降低, 抑制细胞移动和促进凋亡的作用降低或消失, 从而影响肿瘤的病理类型、分期、及转移状态. 其在不同的细胞中的影响也有所不同[17-18]. 本试验研究结果显示, DAPK基因在正常食管组织、食管癌旁不典型增生组织及癌组织中均有表达, 但在癌组织中的表达水平显著降低, 其表达差异有统计学意义. 说明DAPK低表达的肿瘤具有更强的侵袭能力. 研究结果还显示, DAPK基因的异常表达还与食管鳞癌的不同TNM分级及有无淋巴结转移密切相关, 这就提示了DAPK的异常表达可能与预后有关, 可作为判断预后的一项指标, 有利于我们进一步的了解食管癌的生物学行为, 为食管癌的早期诊断和治疗提供一个新的途径. 进一步分析试验结果, 我们发现采用原位杂交和免疫组织化学两种方法检测DAPK mRNA与蛋白在食管癌组织中的阳性表达是一致的, DAPK蛋白表达阳性率与DAPK mRNA的表达结果之间呈正相关(P<0.01), 但DAPK mRNA在食管癌中表达率较DAPK蛋白低, 这可能与实验过程中的mRNA被部分降解有关, 而DAPK mRNA与蛋白表达一致性提示应用简易的免疫组织化学法检测食管癌组织中DAPK蛋白表达水平可能可以间接反映出DAPK的mRNA水平.
总之, 我们采用了原位杂交及免疫组织化学法检测了食管鳞癌细胞中DAPK mRNA及蛋白的表达, 初步证明了DAPK表达的降低或者缺失可能是导致食管癌发生发展的作用机制之一, 但DAPK的确切功能目前尚不完全清楚. 因此对DAPK基因进行深入、广泛的研究, 了解其抑制肿瘤浸润和转移的具体机制, 可为肿瘤的预后评估及临床治疗提供理论依据.
死亡相关蛋白激酶(DAPK)具有促细胞凋亡、抑制细胞黏附、抑制细胞迁移等作用, 在肿瘤的发生、发展及转移中发挥着重要作用.
黄晓东, 副主任医师, 武汉市中心医院消化内科
目前DAPK和肿瘤细胞浸润、转移机制的研究已成为热点. 有关DAPK异常表达与食管鳞癌浸润、转移关系的研究, 迄今国内外均未见报道.
本研究首次采用免疫组织化学及原位杂交技术联合检测DAPK在50例食管鳞癌组织、17例癌旁不典型增生组织及20例正常食管黏膜组织的表达情况, 探讨DAPK在食管癌发生、发展中的作用.
本研究提示, DAPK可作为食管癌早期诊断和判断预后的分子指标, 为食管癌的早期诊断和治疗提供了一个新的发展方向.
本研究采用原位杂交及免疫组织化学法检测食管鳞癌细胞中DAPK mRNA及蛋白的表达, 为该领域的研究提供了充足的有意义的信息, 具有一定新颖性和可读性.
编辑: 李军亮 电编: 何基才
| 1. | Deiss LP, Feinstein E, Berissi H, Cohen O, Kimchi A. Identification of a novel serine/threonine kinase and a novel 15-kD protein as potential mediators of the gamma interferon-induced cell death. Genes Dev. 1995;9:15-30. [PubMed] [DOI] |
| 2. | Brabender J, Arbab D, Huan X, Vallböhmer D, Grimminger P, Ling F, Neiss S, Bollschweiler E, Schneider PM, Hölscher AH. Death-associated protein kinase (DAPK) promoter methylation and response to neoadjuvant radiochemotherapy in esophageal cancer. Ann Surg Oncol. 2009;16:1378-1383. [PubMed] [DOI] |
| 3. | Tong A, Lynn G, Ngo V, Wong D, Moseley SL, Ewbank JJ, Goncharov A, Wu YC, Pujol N, Chisholm AD. Negative regulation of Caenorhabditis elegans epidermal damage responses by death-associated protein kinase. Proc Natl Acad Sci USA. 2009;106:1457-1461. [PubMed] [DOI] |
| 4. | Li H, Ray G, Yoo BH, Erdogan M, Rosen KV. Down-regulation of death-associated protein kinase-2 is required for beta-catenin-induced anoikis resistance of malignant epithelial cells. J Biol Chem. 2009;284:2012-2022. [PubMed] [DOI] |
| 5. | 高 冬玲, 李 晟磊, 陈 奎生, 赵 志华, 赵 秋民, 刘 宗文, 张 云汉. 金属蛋白酶抑制基因RECK在食管鳞癌中的表达及生物学意义. 世界华人消化杂志. 2008;16:1634-1638. [DOI] |
| 7. | Lou C, Yang B, Gao YT, Wang YJ, Nie FH, Yuan Q, Zhang CL, Du Z. [Aberrant methylation of multiple genes and its clinical implication in hepatocellular carcinoma]. Zhonghua Zhongliu Zazhi. 2008;30:831-836. [PubMed] |
| 8. | Xu NR, Liu CX, Zheng SB, Li HL, Xu YW, Xu K. [Reversion transcriptional expression of DAPK in bladder cancer T24 cells 5-aza-2'-deoxycytidine.]. Nanfng Yike Daxue Xuebao. 2009;29:1882-1886. [PubMed] |
| 9. | Bajbouj K, Poehlmann A, Kuester D, Drewes T, Haase K, Hartig R, Teller A, Kliche S, Walluscheck D, Ivanovska J. Identification of phosphorylated p38 as a novel DAPK-interacting partner during TNFalpha-induced apoptosis in colorectal tumor cells. Am J Pathol. 2009;175:557-570. [PubMed] [DOI] |
| 10. | Zalckvar E, Berissi H, Eisenstein M, Kimchi A. Phosphorylation of Beclin 1 by DAP-kinase promotes autophagy by weakening its interactions with Bcl-2 and Bcl-XL. Autophagy. 2009;5:720-722. [PubMed] [DOI] |
| 11. | Zhao XL, Meng ZY, Qiao YH, Zhang HL. [Promoter methylation of DAPK gene in cervical carcinoma]. Ai Zheng. 2008;27:919-923. [PubMed] [DOI] |
| 12. | Yanagawa N, Osakabe M, Hayashi M, Tamura G, Motoyama T. Detection of HPV-DNA, p53 alterations, and methylation in penile squamous cell carcinoma in Japanese men. Pathol Int. 2008;58:477-482. [PubMed] [DOI] |
| 13. | Hoffmann AC, Vallböhmer D, Prenzel K, Metzger R, Heitmann M, Neiss S, Ling F, Hölscher AH, Schneider PM, Brabender J. Methylated DAPK and APC promoter DNA detection in peripheral blood is significantly associated with apparent residual tumor and outcome. J Cancer Res Clin Oncol. 2009;135:1231-1237. [PubMed] [DOI] |
| 14. | Fendri A, Masmoudi A, Khabir A, Sellami-Boudawara T, Daoud J, Frikha M, Ghorbel A, Gargouri A, Mokdad-Gargouri R. Inactivation of RASSF1A, RARbeta2 and DAP-kinase by promoter methylation correlates with lymph node metastasis in nasopharyngeal carcinoma. Cancer Biol Ther. 2009;8:444-451. [PubMed] [DOI] |
| 15. | Mukhopadhyay R, Ray PS, Arif A, Brady AK, Kinter M, Fox PL. DAPK-ZIPK-L13a axis constitutes a negative-feedback module regulating inflammatory gene expression. Mol Cell. 2008;32:371-382. [PubMed] [DOI] |
| 16. | Gozuacik D, Bialik S, Raveh T, Mitou G, Shohat G, Sabanay H, Mizushima N, Yoshimori T, Kimchi A. DAP-kinase is a mediator of endoplasmic reticulum stress-induced caspase activation and autophagic cell death. Cell Death Differ. 2008;15:1875-1886. [PubMed] [DOI] |