修回日期: 2009-09-23
接受日期: 2009-10-12
在线出版日期: 2009-11-08
目的: 探讨塞来昔布对大鼠重症急性胰腺炎(severe acute pancreatitis, SAP)治疗效果及机制.
方法: SD大鼠共135只, 其中75只随机平均分为SAP组, 低剂量及高剂量塞来昔布组, 观察其生存率; 60只SD大鼠随机平均分为对照组(假手术组), SAP组, 低剂量及高剂量塞来昔布组. 胆胰管内注射牛磺胆酸钠溶液造模, ELISA法检测大鼠血清TNF-α、IL-1β及IL-6的表达; RT-PCR检测胰腺组织COX-2 mRNA的表达; HE染色、胰腺组织半定量积分评价胰腺病理学改变.
结果: 塞来昔布可降低大鼠SAP的病理损害积分, 高剂量组在造模后的24 h可显著减低组织水肿(2.28±0.30 vs 2.73±0.22, P<0.05); 在12和24 h均可显著降低腺泡坏死(2.03±0.15 vs 2.48±0.24, 2.09±0.10 vs 2.65±0.25, 均P<0.05)及炎性细胞浸润(1.80±0.22 vs 2.51±0.17, 1.57±0.26 vs 2.20±0.22, 均P<0.05). 造模后COX-2 mRNA表达及TNF-α、IL-1β及IL-6产生增加, 塞来昔布治疗组上述检测指标明显低于SAP组(均P<0.05), 且随塞来昔布剂量的增加其抑制作用逐渐增强. 塞来昔布高剂量治疗组可显著提高大鼠SAP的生存率(16% vs 52%, P<0.05).
结论: 塞来昔布可能通过抑制TNF-α、IL-1β及IL-6的表达, 改善胰腺局部病理改变及预后.
引文著录: 薛翠华, 高振军, 李秋萍, 许亚平, 周春锁, 姚俊, 付白清. 塞来昔布对大鼠重症急性胰腺炎的治疗作用. 世界华人消化杂志 2009; 17(31): 3197-3202
Revised: September 23, 2009
Accepted: October 12, 2009
Published online: November 8, 2009
AIM: To investigate the efficacy of celecoxib in the treatment of severe acute pancreatitis (SAP) in rats and explore potential mechanisms involved.
METHODS: A total of 135 Sprague-Dawley rats were used in this study, of which 75 were randomly and equally divided into three groups (SAP model control group, low-dose and high-dose celecoxib treatment groups) to investigate the survival rate, and 60 were randomly and equally divided into four groups (sham operation group, SAP model control group and low-dose and high-dose celecoxib treatment groups) to detect pancreatic histopathological changes, serum tumor necrosis factor-α (TNF-α), interleukin-1β (IL-1β) and interleukin-6 (IL-6) levels, and pancreatic expression of cyclooxygenase-2 (COX-2). SAP was induced in rats by retrograde injection of sodium taurocholate into the biliopancreatic duct. The histopathological changes in the pancreas of rats were evaluated using a semi-quantitative scoring method. The changes in serum TNF-α, IL-1β and IL-6 levels at different time points were measured by enzyme-linked immunosorbent assay (ELISA). The expression of COX-2 mRNA in the pancreas was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Celecoxib ameliorated pancreatic pathological damage in SAP rats. High-dose celecoxib could significantly mitigate edema at 24 hours (2.28 ± 0.30 vs 2.73 ± 0.22, P < 0.05), acinar necrosis at 12 and 24 hours (2.03 ± 0.15 vs 2.48 ± 0.24 and 2.09 ± 0.10 vs 2.65 ± 0.25, respectively; both P < 0.05), and inflammatory cell infiltration at 12 and 24 hours (1.80 ± 0.22 vs 2.51 ± 0.17 and 1.57 ± 0.26 vs 2.20 ± 0.22, respectively; both P < 0.05). The levels of serum TNF-α, IL-1β and IL-6 in SAP rats were significantly higher than those in normal control mice at all time points. After celecoxib treatment, the levels of serum TNF-α, IL-1β and IL-6 significantly decreased in SAP rats, especially prominent in the high-dose group (P < 0.05). Celecoxib treatment could also improve the survival rate of SAP rats (16% vs 52%, P < 0.05).
CONCLUSION: Celecoxib can ameliorate pathological damage in the pancreas of SAP rats possibly by inhibiting the production of serum TNF-α, IL-1β and IL-6 and the expression of COX-2 in the pancreas.
- Citation: Xue CH, Gao ZJ, Li QP, Xu YP, Zhou CS, Yao J, Fu BQ. Efficacy of celecoxib in the treatment of severe acute pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3197-3202
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3197.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3197
重症急性胰腺炎(severe acute pancreatitis, SAP)是一种发病急、进展快、并发症多、死亡率高凶险的内外科急症[1]. 胰腺的自身消化和微循环的破坏是急性胰腺炎病理生理学重要的2个部分[2], 胰腺炎局部的严重性和系统的复杂性与炎性细胞因子的过度上调及一些次级调控因子, 如组胺、前列腺素、血栓素、白三烯、NO和血小板活化因子等密切相关[3-6]. 前列腺素被认为是急性胰腺炎发病的重要调控因子, 前列腺素类因子的失衡是急性胰腺炎相关微循环紊乱的重要因素, 前列腺素还具有保护内脏器官及维持膜的完整性的作用[5,7-8]. 环氧合酶(cyclooxygenase, COX)是由花生四烯酸合成前列腺素的关键限速酶, 目前已知有2种亚型, COX-1属结构型酶, 在多种组织中呈微量表达, 其催化产物只要参与维持细胞结构的完整性, COX-2属诱生型酶, 正常组织中很少表达, 在各种刺激因素如炎性细胞因子等作用下, 表达上调. COX-2是SAP中重要的致病因子, 有研究认为COX-2抑制剂有可能成为新的重症胰腺炎的治疗途径[9-10]. 塞来昔布(Celecoxib)是新一代的非甾体类化合物, 可选择性抑制COX-2而阻止炎性PGs类物质的产生, 达到抗炎、镇痛及退热的作用. 本研究旨在探讨炎性因子和COX-2在大鼠SAP发病机制中的作用, 并观察塞来昔布对SAP大鼠的胰腺病理组织学、生存率等方面的变化来揭示COX-2抑制剂在SAP治疗中可能的治疗作用.
♂SD大鼠135只, 体质量230-280 g, 清洁级, 购自中国科学研究院上海动物中心, 其中75只分为3组进行生存率实验, 其余60只分为4组进行血清细胞因子、病理学及COX-2检测. 所有大鼠均给予普通颗粒饲料喂养, 自由饮水, 人工光循环12 h/12 h, 温度为21 ℃±2.0 ℃, 湿度为55%±2%, 喂养1 wk后进行实验. 牛磺胆酸钠、戊巴比妥钠购自Sigma公司、COX-2抑制剂塞来昔布(辉瑞药厂提供)、TNF-α、IL-1β及IL-6检测试剂盒购自R&D公司.
1.2.1 造模: 实验前禁食不禁水12 h, 10 g/L巴比妥钠溶液腹腔麻醉. 严格消毒、铺巾, 正中线剖腹, 置管于胆胰管内, 在微量输液泵的控制下向胆胰管内注射5%牛磺胆酸钠溶液, 剂量1 mL/kg, 0.2 mL/min, 留置导管10 min后拔管, 术后皮下注射生理盐水(2 mL/100 g), 术后自由饮水, 对照组大鼠仅作剖腹术. 治疗组将塞来昔布溶解于2 mL生理盐水, 并在造模后即腹腔注射. SAP组和对照组注射等剂量生理盐水.
1.2.2 生存率测定: 75只大鼠随机平均分为SAP组、SAP+塞来昔布低剂量(10 g/L)治疗组和SAP+塞来昔布高剂量(30 g/L)治疗组, 观察24 h, 每隔6 h观察1次.
1.2.3 胰腺组织病理学评分: 取胰腺组织经常规脱水、包埋、切片、HE染色, 由专一病理医师观察切片. 胰腺组织半定量积分参照Schmidt et al[11]的方法.
1.2.4 血清TNF-α、IL-1β及IL-6浓度测定: 60只大鼠随机平均分为对照组(假手术组)、SAP组、SAP+塞来昔布低剂量治疗组和SAP+塞来昔布高剂量治疗组, 分别于术后6、12、24 h分批处死动物, 每次每组处死5只. 留取血液检测血清血清TNF-α、IL-1β、IL-6采用ELISA方法检测, 按说明书要求操作. 同时取少量新鲜胰腺组织-70 ℃冻存, 行RT-PCR检测; 其余组织置于4%甲醛溶液固定, 行胰腺组织病理学评分.
1.2.5 RT-PCR: 用TRIzol按说明书要求提取组织总RNA, 行RT-PCR, 以GAPDH为内参照, 引物序列: COX-2上游为5'-GTTGAAAGCCCTCTACCATGACA-3'; 下游为5'-TTGAGGCAGTGTTGATGATCCT-3'; GADPH上游为5'-GGTGAAGGTCGGTGTGAACGGA-3', 下游为5'-TGTTAGTGGGGTCTCGCTCCTG-3'; 引物由上海生工合成. 扩增产物置20 g/L琼脂糖电泳, 紫外灯下观察, 凝胶分析系统拍照.
统计学处理 实验结果以mean±SD表示, 采用SASS6.12统计软件分析, 采用ANOVA单因素方差分析. 以P<0.05为差异有统计学意义.
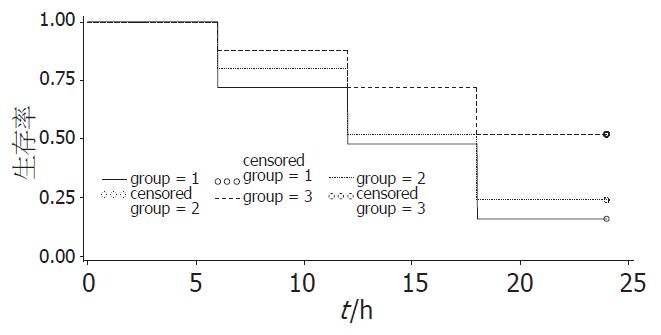
观察24 h, SAP组生存率为16%, SAP+低剂量塞来昔布组为24%, 与SAP组相比无显著差异(P = 0.505); SAP+高剂量塞来昔布组为52%, 与SAP组相比差异有显著性(P = 0.009, 图1).
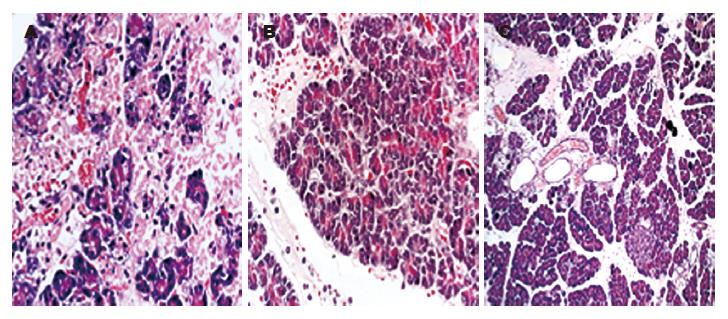
光镜下见SAP模型组大鼠胰腺组织间质明显水肿, 导致叶间隔、小叶间隔甚至腺泡间隔增宽, 血管扩张充血, 并见出血区域, 腺泡坏死呈灶性、小叶性分布, 可见多个大片坏死区域, 血管周围见单核、中性粒细胞积聚, 胰腺间质中见大量单核及中性粒细胞浸润. 塞来昔布低剂量(10 g/L)治疗组炎性细胞浸润程度较SAP模型组显著减轻, 塞来昔布高剂量治疗组胰腺组织水肿、坏死和炎性细胞浸润程度较SAP模型组均显著减轻, 尤以12 h和24 h为明显, 但出血程度3组相比无明显变化(表1, 图2).
| 水肿 | 腺泡坏死 | 出血 | 炎症细胞浸润 | |
| SAP组 | ||||
| 6 h | 2.55±0.23 | 2.15±0.25 | 0.32±0.07 | 2.83±0.31 |
| 12 h | 3.08±0.27 | 2.48±0.24 | 0.39±0.07 | 2.51±0.17 |
| 24 h | 2.73±0.22 | 2.65±0.25 | 0.50±0.03 | 2.20±0.22 |
| SAP+塞来昔布低剂量治疗组 | ||||
| 6 h | 2.39±0.14 | 2.04±0.18 | 0.34±0.06 | 2.26±0.16a |
| 12 h | 2.77±0.16 | 2.29±0.06 | 0.35±0.06 | 2.08±0.26a |
| 24 h | 2.59±0.23 | 2.54±0.31 | 0.46±0.05 | 1.87±0.19a |
| SAP+塞来昔布高剂量治疗组 | ||||
| 6 h | 2.26±0.22 | 1.94±0.11 | 0.35±0.05 | 2.15±0.17a |
| 12 h | 2.61±0.12 | 2.03±0.15a | 0.35±0.06 | 1.80±0.22a |
| 24 h | 2.28±0.30a | 2.09±0.10a | 0.42±0.03 | 1.57±0.26a |
SAP大鼠血清中, TNF-α、IL-1β及IL-6水平均较对照组(假手术组)明显增高, 在24 h内随时间延长有增加的趋势, 应用塞来昔布治疗后, TNF-α、IL-1β及IL-6水平均显著降低, 塞来昔布高剂量治疗组降低更为明显(表2).
| 分组 | 时间点 | ||
| 6 h | 12 h | 24 h | |
| 对照组 | |||
| TNF-α | 11.28±3.27 | 12.54±3.93 | 11.83±2.85 |
| IL-1β | 1.58±0.35 | 2.06±0.56 | 1.89±0.44 |
| IL-6 | 38.42±6.54 | 50.80±11.20 | 45.63±9.78 |
| SAP组 | |||
| TNF-α | 98.65±15.49 | 156.78±22.3 | 178.86±23.12 |
| IL-1β | 45.82±7.87 | 58.60±9.06 | 62.91±8.31 |
| IL-6 | 134.69±18.52 | 142.54±21.97 | 160.47±23.86 |
| SAP+塞来昔布低剂量治疗组 | |||
| TNF-α | 89.54±13.93 | 122.65±22.3a | 133.27±23.12a |
| IL-1β | 27.80±5.84a | 33.5±11.04a | 38.58±9.74a |
| IL-6 | 119.33±24.56 | 121.70±35.31a | 152.53±31.69a |
| SAP+塞来昔布高剂量治疗组 | |||
| TNF-α | 54.65±8.62a | 87.56±10.59a | 86.65±7.76a |
| IL-1β | 11.83±2.63a | 13.42±3.59a | 18.50±5.03a |
| IL-6 | 64.52±13.72a | 67.80±20.07a | 68.02±18.55a |
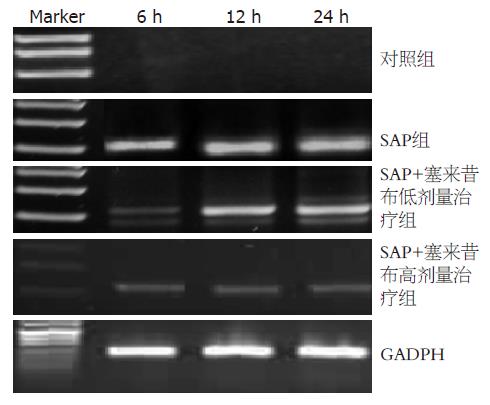
对照组大鼠胰腺组织COX-2无表达, SAP模型组明显表达, 用塞来昔布治疗后, COX-2 mRNA表达显著降低(P<0.05, 图3).
COX是花生四烯酸代谢过程中前列腺素合成的限速酶, 目前已经知道其至少存在2种亚型, COX-1属结构型酶, 在多种组织中呈微量表达, 其催化产物只要参与维持细胞结构的完整性, COX-2属诱导型酶, 正常组织中很少表达, 在各种刺激因素如细胞因子, 炎性递质以及促癌剂等作用下, 表达迅速. COX-2自身受某些炎症因子的调节, 其在SAP发生发展中的具有重要的作
用[10,12-18]. 在本研究中发现, COX-2在对照组无表达, 但在SAP组6 h即有明显表达, 提示COX-2有可能参与了SAP的发展. 目前认为SAP实质上是细胞因子及炎性介质大量释放所致的严重的全身炎症反应综合征. 近年来大量的研究表明, 炎性细胞因子在导致全身炎症反应中发挥着主要作用, SAP早期过度的炎症反应也是造成SIRS和MODS的主要原因[3]. 炎症反应涉及炎症性细胞因子和抗炎症性细胞因子. 炎症性细胞因子包括TNF-α、IL-1β、IL-6、血小板活化因子等, 抗炎性细胞因子包括TGF-β和IL-10等[19-26]. 在本研究中发现, 造模6 h, TNF-α、IL-1β、IL-6等炎症性细胞因子也明显增加, 随时间延长进一步增加, 并与病理改变相一致, 证实TNF-α、IL-1β、IL-6等炎症性细胞因子参与了胰腺炎发展的过程.
非甾体类消炎药(non-steroid anti-inflammation drugs, NSAIDs)是一类广泛应用于消炎、止痛的药物, 主要不良反应为消化系反应, 尤其是出血及穿孔, 但亦有少量个案报道认为认为NSAIDs与急性胰腺炎发病有关, 但缺乏流行病学调查[27-29]. 近来的研究认为, 塞来昔布诱发急性胰腺炎的可能性要显著低于其他NSAIDs药物[30]. 前列腺素和胰腺炎的关系已被研究过[8], 有一些前列腺素衍生物对急性胰腺炎发病中具有保护作用, 但应用消炎痛抑制前列腺素对急性胰腺炎无效[5], 这种情况最近被认为是消炎痛同时抑制了COX-1和COX-2的表达所致, 这是因为在急性胰腺炎时COX-2表达上调, 而COX-1表达并无明显变化[31]. 近来有少量研究在选择性COX-2抑制剂对胰腺炎的治疗中发现, 在造模前和造模后应用COX-2抑制剂均可抑制全身并发症的发生[7,9-10,32], 有报道认为应用COX-2抑制剂可抑制胰腺组织水肿及坏死[10,32], 但亦有报道认为应用COX-2抑制剂对胰腺组织水肿及坏死无明显影响[7,9], 这有可能与用药方式及观察时间的长短有一定关系, 在本研究中发现, 塞来昔布低剂量(10 g/L)治疗组炎性细胞浸润程度较SAP模型组显著减轻, 塞来昔布高剂量治疗组胰腺组织水肿、坏死和炎性细胞浸润程度较SAP模型组均显著减轻, 尤以12 h和24 h为明显, 但出血程度3组相比无明显变化, 实验中也发现塞来昔布治疗可改善大鼠生存率, 提示塞来昔布在适当剂量时可改善SAP的局部病理表现及预后, 实验中证实, 塞来昔布尤其是高剂量时可显著抑制TNF-α、IL-1β及IL-6的产生, 在局部抑制了炎性细胞的浸润, 从而抑制了炎症的级联放大效应.
总之, 本研究证实, 选择性COX-2抑制剂塞来昔布在一定剂量时可改善SAP的局部病理表现, 降低死亡率, 有可能成为SAP的辅助治疗药物.
目前认为SAP实质上是细胞因子及炎性介质大量释放所致的严重的全身炎症反应综合征. 近年来大量的研究表明, 炎性细胞因子在导致全身炎症反应中发挥着主要作用. COX-2是SAP中重要的致病因子, 有研究认为COX-2抑制剂有可能成为新的重症胰腺炎的治疗途径.
李国威, 教授, 西安交通大学医学院第二附属医院普通外科; 谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
Song et al证实COX-2自身受某些炎症因子的调节, 其在SAP发生发展中的具有重要的作用. Lankisch et al报道, 有一些前列腺素衍生物对急性胰腺炎发病中具有保护作用, 但应用消炎痛抑制前列腺素对急性胰腺炎无效.
本研究通过探讨炎性因子和COX-2在大鼠SAP发病机制中的作用, 并观察塞来昔布对SAP大鼠的胰腺病理组织学、生存率等方面的变化来揭示COX-2抑制剂在SAP治疗中可能的治疗作用, 为COX-2抑制剂在SAP治疗中的应用提供理论依据.
本研究证实, 选择性COX-2抑制剂塞来昔布在一定剂量时可改善SAP的局部病理表现, 降低死亡率, 有可能成为SAP的辅助治疗药物.
本文研究了塞来昔布对大鼠重症急性胰腺炎治疗作用, 有一定的实用价值和可读性.
编辑: 李军亮 电编: 何基才
| 3. | Papachristou GI. Prediction of severe acute pancreatitis: current knowledge and novel insights. World J Gastroenterol. 2008;14:6273-6275. [PubMed] [DOI] |
| 4. | Alhan E, Cicek R, Erçin C, Orem A, Vanizor B, Cinel A. Effects of the tyrosine kinase inhibitor tyrphostin AG 556 on acute necrotising pancreatitis in rats. Eur J Surg. 2002;168:557-562. [PubMed] |
| 5. | Lankisch PG, Koop H, Winckler K, Kunze H, Vogt W. Indomethacin treatment of acute experimental pancreatitis in the rat. Scand J Gastroenterol. 1978;13:629-633. [PubMed] |
| 7. | Alhan E, Kalyoncu NI, Ercin C, Kural BV. Effects of the celecoxib on the acute necrotizing pancreatitis in rats. Inflammation. 2004;28:303-309. [PubMed] [DOI] |
| 8. | Yücel K, Alhan E, Küçüktülü U, Piri M, Erçin C, Deger O. The effects of prostaglandin E1 on the microperfusion of the pancreas during acute necrotizing pancreatitis in rats. Hepatogastroenterology. 2002;49:544-548. [PubMed] |
| 9. | Foitzik T, Hotz HG, Hotz B, Wittig F, Buhr HJ. Selective inhibition of cyclooxygenase-2 (COX-2) reduces prostaglandin E2 production and attenuates systemic disease sequelae in experimental pancreatitis. Hepatogastroenterology. 2003;50:1159-1162. [PubMed] |
| 10. | Song AM, Bhagat L, Singh VP, Van Acker GG, Steer ML, Saluja AK. Inhibition of cyclooxygenase-2 ameliorates the severity of pancreatitis and associated lung injury. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1166-G1174. [PubMed] |
| 11. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] |
| 12. | Yang R, Shaufl AL, Killeen ME, Fink MP. Ethyl pyruvate ameliorates liver injury secondary to severe acute pancreatitis. J Surg Res. 2009;153:302-309. [PubMed] [DOI] |
| 13. | Lankisch PG. Indomethacin may reduce the incidence and severity of acute pancreatitis after ERCP. Am J Gastroenterol. 2008;103:244. [PubMed] |
| 14. | Mennecier D, Ceppa F, Sinayoko L, Corberand D, Harnois F, Thiolet C, Farret O. [Acute pancreatitis after treatment by celecoxib]. Gastroenterol Clin Biol. 2007;31:668-669. [PubMed] [DOI] |
| 15. | Chan YC, Leung PS. Angiotensin II type 1 receptor-dependent nuclear factor-kappaB activation-mediated proinflammatory actions in a rat model of obstructive acute pancreatitis. J Pharmacol Exp Ther. 2007;323:10-18. [PubMed] [DOI] |
| 16. | Seo SW, Jung WS, Piao TG, Hong SH, Yun KJ, Park RK, Shin MK, Song HJ, Park SJ. Selective cyclooxygenase-2 inhibitor ameliorates cholecystokinin-octapeptide-induced acute pancreatitis in rats. World J Gastroenterol. 2007;13:2298-2304. [PubMed] |
| 17. | Zhou YJ, Xiong YX, Zhou T, Fan W, Wu XT. [Role of cyclooxygenase-2 in pulmonary microcirculation disorder in rats with acute pancreatitis]. Sichuan Daxue Xuebao Yixueban. 2007;38:250-254. [PubMed] |
| 18. | Chan YC, Leung PS. Acute pancreatitis: animal models and recent advances in basic research. Pancreas. 2007;34:1-14. [PubMed] [DOI] |
| 19. | Zhang X, Wu D, Jiang X. Icam-1 and acute pancreatitis complicated by acute lung injury. JOP. 2009;10:8-14. [PubMed] |
| 20. | Viterbo D, Bluth MH, Mueller CM, Zenilman ME. Mutational characterization of pancreatitis-associated protein 2 domains involved in mediating cytokine secretion in macrophages and the NF-kappaB pathway. J Immunol. 2008;181:1959-1968. [PubMed] |
| 21. | Viterbo D, Bluth MH, Lin YY, Mueller CM, Wadgaonkar R, Zenilman ME. Pancreatitis-associated protein 2 modulates inflammatory responses in macrophages. J Immunol. 2008;181:1948-1958. [PubMed] |
| 22. | Hartwig W, Schimmel E, Hackert T, Fortunato F, Bergmann F, Baczako A, Strobel O, Büchler MW, Werner J. A novel animal model of severe pancreatitis in mice and its differences to the rat. Surgery. 2008;144:394-403. [PubMed] [DOI] |
| 23. | de-Madaria E, Martínez J, Sempere L, Lozano B, Sánchez-Payá J, Uceda F, Pérez-Mateo M. Cytokine genotypes in acute pancreatitis: association with etiology, severity, and cytokine levels in blood. Pancreas. 2008;37:295-301. [PubMed] [DOI] |
| 24. | Martín Alonso MA, Santamaría A, Saracíbar E, Arranz E, Garrote JA, Almaraz A, Caro-Patón A. [Cytokines and other immunological parameters as markers of distant organ involvement in acute pancreatitis]. Med Clin (Barc). 2007;128:401-406. [PubMed] [DOI] |
| 25. | Kazbay K, Tarnasky PR, Hawes RH, Cotton PB. Increased transforming growth factor beta in pure pancreatic juice in pancreatitis. Pancreas. 2001;22:193-195. [PubMed] [DOI] |
| 26. | 钟 荣德, 周 杰, 廖 柳清, 符 方勇, 李 湘竑, 林 艺雄. 脂质体介导核因子-κB诱捕物寡聚脱氧核苷酸对重症急性胰腺炎大鼠胰腺炎症因子mRNA表达和胰腺损伤的影响. 世界华人消化杂志. 2007;15:813-819. [DOI] |
| 27. | Cobb TK, Pierce JR Jr. Acute pancreatitis associated with ketoprofen. South Med J. 1992;85:430-431. [PubMed] [DOI] |
| 28. | Guerra M. Toxicity of indomethacin. Report of a case of acute pancreatitis. JAMA. 1967;200:552-553. [PubMed] [DOI] |
| 29. | McArthur KE. Review article: drug-induced pancreatitis. Aliment Pharmacol Ther. 1996;10:23-38. [PubMed] |
| 30. | Sørensen HT, Jacobsen J, Nørgaard M, Pedersen L, Johnsen SP, Baron JA. Newer cyclo-oxygenase-2 selective inhibitors, other non-steroidal anti-inflammatory drugs and the risk of acute pancreatitis. Aliment Pharmacol Ther. 2006;24:111-116. [PubMed] [DOI] |
| 31. | Zabel-Langhennig A, Holler B, Engeland K, Mössner J. Cyclooxygenase-2 transcription is stimulated and amylase secretion is inhibited in pancreatic acinar cells after induction of acute pancreatitis. Biochem Biophys Res Commun. 1999;265:545-549. [PubMed] [DOI] |
| 32. | Ethridge RT, Chung DH, Slogoff M, Ehlers RA, Hellmich MR, Rajaraman S, Saito H, Uchida T, Evers BM. Cyclooxygenase-2 gene disruption attenuates the severity of acute pancreatitis and pancreatitis-associated lung injury. Gastroenterology. 2002;123:1311-1322. [PubMed] [DOI] |