修回日期: 2009-10-26
接受日期: 2009-11-02
在线出版日期: 2009-11-08
目的: 观察室旁核及中缝大核微注射5-羟色胺(5-hydroxytryptamine, 5-HT)及其各种阻断剂和电刺激对家兔胃电活动的影响, 探讨室旁核影响胃肠运动的中枢地位.
方法: 注射5-HT及其各种阻断剂和电刺激家兔室旁核, 然后采用胃浆膜双极4导联同步记录, 分析其胃体、胃窦部胃电的平均频率、相位差、负相位比率、波形对应率、幅度等指标, 考察室旁核及中缝大核微量注射5-HT及各种阻断剂和电刺激对家兔胃电活动的影响.
结果: 室旁核注射2 μg 5-HT后, 除胃体3外胃电频率均加快, 其中胃体2差异显著(4.44±0.09 vs 4.24±0.09, P = 0.034), 再注射5 μg丹司琼后胃电频率均减慢, 其中胃体2、3差异显著(P = 0.032, 0.043); 室旁核注射2 μg 5-HT再注射5 μg赛庚啶后, 胃电频率加快, 胃体2差异显著(P = 0.044); 室旁核电刺激后, 除胃体2外胃电频率均减慢, 胃体1和胃体3差异显著(P = 0.03, 0.029); 中缝大核注射10 μg 5-HT后, 胃体2胃电频率明显减慢(4.13±0.11 vs 4.33±0.09, P = 0.021), 再注射10 μg赛庚啶后, 胃体2胃电频率则加快(P = 0.034); 注射10 μg 5-HT再室旁核电刺激后, 除胃体1外胃电频率均减慢, 胃窦部位差异显著(3.93±0.14 vs 4.46±0.14, P = 0.006).
结论: 室旁核微量注射5-HT对胃电活动主要为激动作用, 可能是通过5-HT3受体途径发挥作用; 而中缝大核注射5-HT则为抑制作用, 可能是通过5-HT2受体途径发挥作用; 中缝大核微量注射5-HT的同时室旁核电刺激对胃电的抑制似具协同作用, 进一步证实了中枢同时存在"下行性抑制"和"下行性兴奋"两个系统共同调控消化道功能的概念.
引文著录: 张慧, 欧阳守, 黄伟锋. 5-HT及其阻断剂脑内微注射和微电刺激对家兔胃电活动的影响. 世界华人消化杂志 2009; 17(31): 3189-3196
Revised: October 26, 2009
Accepted: November 2, 2009
Published online: November 8, 2009
AIM: To observe the effects of microinjection of 5-hydroxytryptamine (5-HT) and its blocking agents into the paraventricular nucleus (PVN) and nucleus raphe magnus (RM) and microelectric stimulation of the PVN on gastric electrical activity (GEA) in rabbits, and explore the central role of the PVN in controlling gastrointestinal movement.
METHODS: The stereopositioning of the PVN and RM was performed using a stereo positioner (model SN-2). Microinjection of 5-HT and its blocking agents ondansetron and cyproheptadine into the PVN and RM and electrical stimulation of the PVN were then performed. GEA was measured using four bipolar serosal electrodes (gastric body I-III and gastric antrum) in a rabbit. The parameters of GEA detected included average frequency, phase difference, the ratio of negative phase, amplitude, etc.
RESULTS: Paraventricular injection of 2 μg of 5-HT accelerated the electric frequencies of gastric body I-II and gastric antrum, and the change in the electric frequency of gastric body II was statistically significant (4.44 ± 0.09 vs 4.24 ± 0.09,P = 0.034). Subsequent microinjection of 5 μg of ondansetron slowed down the frequencies of gastric body I-III and gastric antrum, and the changes in the frequencies of gastric body II-III were statistically significant (P = 0.032 and 0.043, respectively). Microinjection of 5 μg of cyproheptadine following 5-HT injection accelerated the electric frequencies of gastric body I-II and gastric antrum, and the change in the electric frequency of gastric body II was statistically significant (P = 0.044). Elelctric stimulation of the PVN slowed down the frequencies of gastric body I and III and gastric antrum, and the changes in the frequencies of gastric body I and III were statistically significant (P = 0.030 and 0.029, respectively). Microinjection of 10 μg of 5-HT into the RM significantly slowed down the frequency of gastric body II (4.13 ± 0.11 vs 4.33 ± 0.09, P = 0.021), while subsequent injection of 10 μg of cyproheptadine accelerated the frequency of gastric body II (P= 0.034). Electrical stimulation of the PVN following microinjection of 10 μg of 5-HT into the RM slowed down the frequencies of II-III and gastric antrum, and the change in the frequency of gastric antrum was statistically significant (3.93 ± 0.14 vs 4.46 ± 0.14, P = 0.006).
CONCLUSION: Microinjection of 5-HT into the PVN mainly exerts stimulating effects on GEA, in which the 5-HT3 receptor pathway may play an important role. Microinjection of 5-HT into the RM exerts inhibitory effects on GEA, in which 5-HT2 receptor may play an important role. There is a synergistic effect between microinjection of 5-HT into the RM and microelectric stimulation of the PVN. These results further demonstrate the existence of "a descending inhibitory system and a descending exciting system" in the central nervous system, both of which modulate GEA together.
- Citation: Zhang H, Ouyang S, Huang WF. Effects of intracerebral microinjection of 5-hydroxytryptamine and its blocking agents and intracerebral microelectric stimulation on gastric electrical activity in rabbits. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3189-3196
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3189.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3189
室旁核(paraventricular nucleus, PVN)位于视上核的后上方第三脑室两侧, 其细胞功能复杂, 具有神经和体液双重调控功能, 是调节内脏活动的较高级中枢. PVN和胃之间存在敏感的神经联系, 他对生理及应激状态下的胃酸分泌、胃电及胃运动及各种原因所致的胃黏膜损伤具有广泛的调节作用[1-2]. 一些资料证实, PVN和脑内5-羟色胺(5-hydroxytryptamine, 5-HT)主要来源的中缝背核(dorsal raphe nucleus, DRN)间有往返纤维联系[3], 离体脑片的研究表明, PVN上存有5-HT受体, 可被5-HT激活[4]. 中缝大核(nucleus raphe magnus, Rm)是延脑后部中缝处的一个重要核团. 许多研究表明Rm参与了动物胃运动和胃电的调节, 该核团内的胃泌素, 5-HT[5]和P物质与此调节作用有关.
目前对PVN在应激高血压发病中的作用[6]、外周5-HT对胃肠道的作用[7]等[8-9]方面做了较深入研究, 但关于5-HT在PVN对胃肠道的影响中的作用还未有报道, 因此本实验希望通过研究下丘脑PVN微注射5-HT对胃电活动的影响, 发现中枢神经系统中5-HT的新功能.
健康新西兰白兔, 雌雄不限, 体质量2.0±0.2 kg; 中国生旺实验动物养殖有限公司, 生产许可证号: SCXK(沪)2002- 0011; 5-HT、西沙必利购自Sigma公司; 昂丹司琼购自齐鲁制药有限公司; 赛庚定购自Aldrich公司; 纳洛酮购自北京四环医药科技股份有限公司; 脑立体定位仪购自日本.
1.2.1 手术: 健康新西兰白兔, 术前禁食18 h以上, 自由饮水. 兔耳缘静脉注射40 mg/kg氯醛糖与0.5 g/kg乌拉坦混合液. 兔腹部剪毛后, 从剑突下2 cm沿腹白线作1个约10 cm的纵行切口, 尽量避开血管, 钝性分离, 暴露大部分胃. 在胃浆膜下植入双极电极, 共埋4对记录电极: 为Ag-AgCl针形电极, 直径1 mm, 分别埋在胃起步点下方(胃体1)、胃大弯处(胃体2)、胃大弯与胃窦之间(胃体3)和胃窦(胃体4). 每对电极的双极间距离大约3-5 mm, 沿着胃环形肌方向与纵形肌相垂直, 用缝线作2点固定. 连接4对胃体记录电极到MP100WSW 16导生物信号采集分析系统, 动物术后恢复2-3 h.
1.2.2 脑定位: 将兔头部固定于脑立体定位仪上, 剪去颅顶毛. 按脑立体定位图谱定位室旁核PVN(坐标: AP 0.0 mm, L(R)±0.5 mm, H 13.5 mm)和P9(坐标: AP 9.0 mm, L(R) 0.0 mm , H颅底上2 mm处). 用微型电钻在颅顶延人字缝, 分别在PVN和Rm(P9)钻出2个小洞(尽量不要弄破脑膜, 使脑部少出血)以备刺激电极与微注射器的插入. 部分动物采用开颅、吸小脑、直接暴露第Ⅳ脑室的方法, 直观直接定位. 颅顶钻孔的动物, 实验结束时, 开颅吸除小脑, 以观察证实脑电极的真实定位.
1.2.3 实验记录: 待动物胃电恢复正常后, PVN插入注射器作为对照胃电, 再注射5-HT, 观察并记录胃电变化. 在5-HT的有效作用时间内PVN注射分别注射昂丹司琼、西沙必利、纳洛酮、赛庚啶继续观察并记录胃电变化. 待动物胃电恢复正常后, PVN插入注射器记录正常胃电, 再注射生理盐水观察并记录胃电变化. P9同上.
PVN插入电极, 待动物胃电恢复正常后记录对照胃电, 再PVN电刺激(八通道数码触摸式液晶显示刺激器: 刺激波形为连续方波串,每串10个刺激、串长200 ms、波宽2 ms、间隔18 ms、频率50 Hz、强度1-4 μA、时间5 min), 记录胃电变化.
P9插入注射器, 待动物胃电恢复正常后记录对照胃电, 再注射5-HT记录胃电变化, 再PVN脑刺激记录胃电变化.
观察并记录: 相位差、波形对应率、负相位比率、平均频率、幅度(峰-峰, P-P)值.
统计学处理 各组实验数据以mean±SD表示, 差异显著性检验用配对t检验, P<0.05为差异有统计学意义.
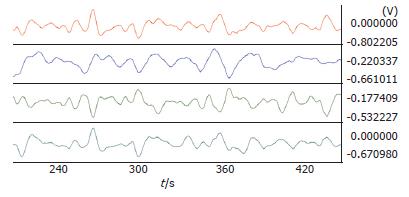
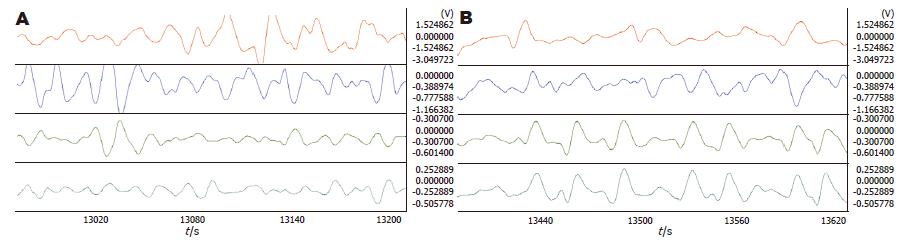
术后2 h恢复后的正常胃电频率为3.48-3.77 cpm, 与以往的实验相同. 相位差均为正值, 各项指标均正常(图1, 表1).
| 分组 | 频率 | 相位差(s) | 负相位比率 | 波形对应率 |
| 胃体1 | 3.60±0.36 | - | - | 0.91±0.08 |
| 胃体2 | 3.69±0.48 | 0.46±2.50 | 0.41±0.30 | 0.86±0.09 |
| 胃体3 | 3.48±0.33 | 1.03±3.89 | 0.37±0.32 | 0.84±0.11 |
| 胃窦 | 3.77±0.45 | 0.25±2.55 | 0.42±0.27 | 0.87±0.09 |
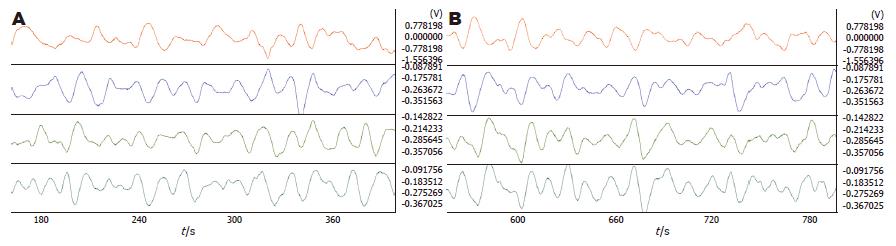
2.2.1 5-HT对PVN的影响: PVN注射2 μg 5-HT后胃体2频率明显加快(4.44±0.09 vs 4.24±0.09, P = 0.034). 相位差有变大的趋势但差异不显著、负相位比率及波形对应率变化均不明显(图2, 表2).
| 分组 | 频率 | 相位差(s) | 负相位比率 | 波形对应率 | ||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 4.04±0.13 | 4.07±0.10 | - | - | - | - | 0.87±0.02 | 0.87±0.02 |
| 胃体2 | 4.24±0.09 | 4.44±0.09a | -0.05±0.45 | 0.27±0.37 | 0.48±0.05 | 0.47±0.04 | 0.73±0.02 | 0.77±0.02 |
| 胃体3 | 4.48±0.10 | 4.39±0.07 | 0.11±0.35 | 0.26±0.34 | 0.49±0.04 | 0.47±0.04 | 0.73±0.03 | 0.78±0.03 |
| 胃窦 | 4.24±0.10 | 4.26±0.13 | 0.42±0.30 | 0.73±0.34 | 0.45±0.04 | 0.40±0.03 | 0.72±0.03 | 0.74±0.03 |
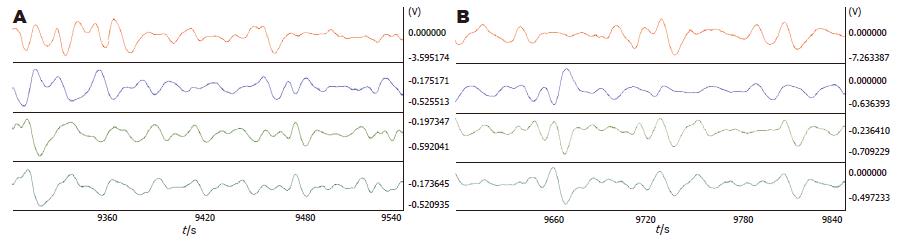
2.2.2 PVN注射昂丹司琼对5-HT的影响: PVN注射2 μg 5-HT后再注射5 μg昂丹司琼, 胃体2、3的频率明显减慢(3.98±0.10 vs 4.28±0.09; 4.13±0.09 vs 4.38±0.08, P = 0.032, 0.043). 胃体3(2.50±0.65 vs 1.54±0.47, P = 0.049)、胃窦(2.47±0.53 s vs 1.19±0.51 s, P = 0.001)相位差增大. 负相位比率减小, 胃窦差异显著(0.33±0.03 vs0.41±0.04, P = 0.025)(图3, 表3).
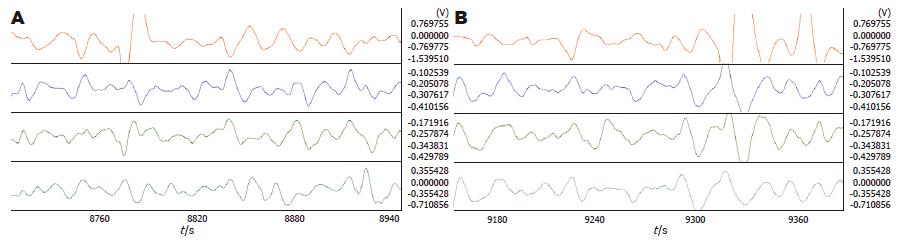
2.2.3 PVN注射赛庚啶对5-HT的影响: PVN注射2 μg 5-HT后再注射5 μg赛庚啶, 胃体2的频率明显加快(4.50±0.07 vs 4.32±0.08, P = 0.044), 胃窦的负相位比率明显升高(0.47±0.03 vs 0.38±0.03, P = 0.037). 相位差及波形对应率变化不明显(图4, 表4).
2.2.4 PVN注射西沙必利、纳洛酮对5-HT的影响: PVN注射5-HT后再注射西沙必利、纳洛酮, 频率、相位差、负相位比率及波形对应率均无明显变化. 说明西沙必利、纳洛酮对5-HT的阻断作用不明显.
2.2.5 PVN注射生理盐水: PVN注射生理盐水后, 频率、相位差、负相位比率及波形对应率变化均不明显.
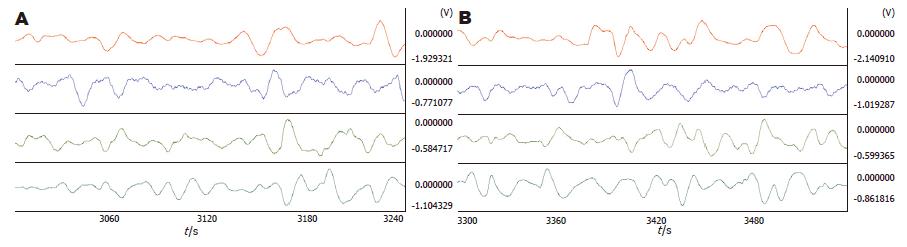
2.2.6 PVN电刺激: PVN脑刺激后, 胃体1(3.81±0.12 vs 4.10±0.11, P = 0.030)和胃体3(4.06±0.07 vs 4.27±0.07, P = 0.029)频率均明显减慢. 相位差、负相位比率及波形对应率变化均不明显(图5, 表5).
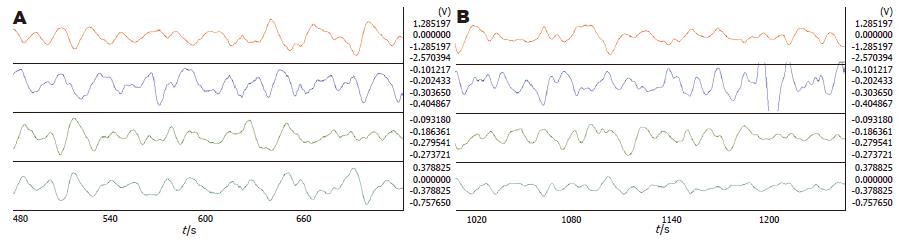
2.3.1 5-HT对Rm的影响: Rm注射10 μg 5-HT后, 胃体2频率明显减慢(4.13±0.11 vs 4.33±0.09, P = 0.021). 相位差、负相位比率及波形对应率变化均不明显(图6, 表6).
| 频率 | 相位差(s) | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.88±0.08 | 3.90±0.07 | - | - | - | - | 0.86±0.02 | 0.89±0.02 |
| 胃体2 | 4.33±0.09 | 4.13±0.11a | 0.11±0.23 | 0.32±0.32 | 0.52±0.02 | 0.47±0.04 | 0.78±0.02 | 0.75±0.02 |
| 胃体3 | 4.20±0.08 | 4.06±0.07 | 0.60±0.34 | 0.59±0.33 | 0.44±0.04 | 0.42±0.04 | 0.73±0.02 | 0.73±0.02 |
| 胃窦 | 4.12±0.12 | 4.01±0.09 | 0.71±0.32 | 0.71±0.37 | 0.41±0.04 | 0.40±0.04 | 0.72±0.03 | 0.76±0.02 |
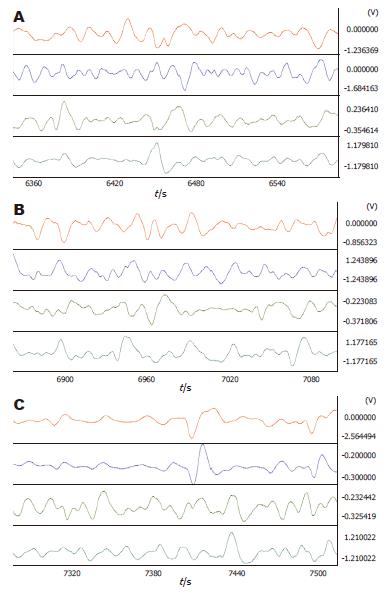
2.3.2 Rm注射赛庚啶对5-HT的影响: Rm注射10 μg 5-HT后再注射10 μg赛庚啶, 胃体2频率明显加快(4.41±0.09 vs 4.19±0.11, P = 0.034), 能翻转注射5-HT对胃体2胃电的影响. 相位差、负相位比率及波形对应率变化均不明显(图7, 表7).
| 频率 | 相位差(s) | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.91±0.09 | 3.92±0.08 | - | - | - | - | 0.87±0.02 | 0.86±0.02 |
| 胃体2 | 4.19±0.11 | 4.41±0.09a | 0.29±0.31 | 0.16±0.32 | 0.46±0.04 | 0.50±0.04 | 0.74±0.02 | 0.78±0.02 |
| 胃体3 | 4.12±0.07 | 4.17±0.06 | 0.71±0.28 | 0.64±0.28 | 0.42±0.03 | 0.43±0.03 | 0.72±0.03 | 0.76±0.02 |
| 胃窦 | 4.11±0.07 | 4.08±0.08 | 0.45±0.26 | 0.45±0.30 | 0.45±0.03 | 0.46±0.02 | 0.74±0.02 | 0.74±0.03 |
2.3.3 Rm注射昂丹司琼、西沙必利对5-HT的影响: Rm注射5-HT后再注射昂丹司琼、西沙必利, 频率、相位差、负相位比率、波形对应率变化不明显.
2.3.4 Rm注射生理盐水: Rm注射生理盐水后, 频率、相位差、负相位比率及波形对应率变化均不明显.
2.3.5 PVN电刺激对Rm注射5-HT的影响: Rm注射5-HT后再刺激PVN, 胃窦频率明显减慢(3.93±0.14 vs 4.46±0.14, P = 0.006). 相位差、负相位比率及波形对应率均无明显变化(图8, 表8).
| 频率 | 相位差(s) | 负相位比率 | 波形对应率 | |||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | |
| 胃体1 | 3.75±0.17 | 3.82±0.17 | - | - | - | - | 0.89±0.02 | 0.87±0.03 |
| 胃体2 | 4.28±0.12 | 4.04±0.11 | 0.69±0.36 | 1.13±0.41 | 0.37±0.05 | 0.34±0.05 | 0.74±0.02 | 0.77±0.02 |
| 胃体3 | 4.43±0.10 | 4.28±0.16 | 0.01±0.25 | 0.20±0.54 | 0.49±0.05 | 0.47±0.06 | 0.77±0.02 | 0.75±0.04 |
| 胃窦 | 4.46±0.14 | 3.93±0.14a | 0.04±0.46 | 0.10±0.45 | 0.48±0.04 | 0.51±0.05 | 0.72±0.03 | 0.71±0.04 |
实验中兔正常胃电频率为3.48-3.77 cpm, 与以往实验结果相同, 说明在胃体埋植双极电极记录家兔胃电的方法是可靠的. 相位差可能是表示胃电传导(扩布)的一个较好的指标. 4导同时记录胃体起步点(胃体1)、胃体2、胃体3及胃窦部胃电, 如果远端波形先于起步点者即为负相位差, 说明胃电传导(扩布)异常, 相位差若由负转正则说明胃电传导转向正常. 欧阳守 et al有关胃肠起步点和胃肠起搏的研究证实, 胃肠各部都存在自主的、但接受中枢与肠神经系统(脑-肠轴)调控的起步点活动及其相位差[10-11]. 周吕 et al[12]在"延髓最后区(area postrema, AP)"的研究中证实, AP调控周期性发放的消化间期复合肌电锋电位的移行, 其作用途径是通过胃动素等实现的. 许多实验都表明胃电传导(扩布)接受中枢胆碱能、肾上腺能或肽能神经元下行性抑制或下行性兴奋的调控[13-14]. 欧阳守 et al有关胃肠平滑肌细胞离子通道的实验证明, 钙、钾通道胃肠动力有着不可忽视的作用[15-16], 以Cajal间质细胞(interstitial cells of Cajal, ICC)为原动力的肠肌丛在胃电传导(扩布)中起决定性的作用. 可以肯定脑-肠轴共同对胃肠电的起源、传导(扩布)的精细调节, 是胃肠道正常功能活动的保障.
5-HT又称为血清素, 是重要的神经递质, 人体内95%的5-HT在胃肠道的肠嗜铬细胞及肠神经元中合成. 5-HT通过与其受体相互作用, 在胃肠动力、感觉及分泌中发挥重要作用. 进一步研究表明5-HT是在"脑-肠轴"中具有重要意义的单胺神经递质. 大脑通过交感神经或副交感神经的传入或传出调节肠神经系统的活动. 双向的脑肠互动包含可通过5-HT通路影响效应器系统. 姜敏 et al[17]也认为近年来的研究提示5-HT广泛分布在于中枢神经和胃肠道, 5-HT在中枢神经系统的降低可导致精神方面的障碍, 而其在肠道的降低则可影响肠道的运动和分泌; 同时5-HT与肠道动力学和肠道敏感性的改变也有一定的关系. De Ponti et al[18]研究发现5-HT可促进胃肠道运动, 使移行性复合运动波(migrating motor complex, MMC)出现次数增多, 并可导致内脏痛觉敏感. 故深入开展5-HT及其相关药物的研究, 对临床上寻求更安全有效的药物具有重要临床意义.
本实验PVN注射昂丹司琼(5-HT3受体拮抗剂) 可翻转5-HT对胃电的效应. 说明5-HT可能是通过5-HT3受体途径发挥作用. PVN注射5-HT后再注射赛庚啶, 胃体2的频率也明显加快, 但胃窦的负相位比率明显升高. 赛庚啶是5-HT2受体阻断剂, 能改善中枢水平调控, 治疗具有中枢因素的周期性呕吐患者及其胃肠动力障碍. 本实验PVN注射5-HT可能不是通过5-HT2受体途径发挥作用的. PVN注射赛庚啶后波形变差, 可能跟频率过快导致的节律紊乱有关.
PVN脑刺激后, 胃体1与胃体3频率均明显减慢, 可能跟脑刺激后PVN内递质的改变有关.
PVN注射5-HT后再注射纳洛酮或西沙必利(非选择性5-HT4受体激动剂)无显著变化. 说明5-HT在PVN可能不是通过肽能及5-HT4受体途径发挥作用.
近年来的研究表明, Rm是内源性镇痛系统中实现下行抑制的关键核团之一, 并与血压、呼吸等功能调节有关. 在胃肠功能调节方面, 欧阳守 et al[14]的实验表明, 电流刺激Rm对猫胃电基本电节律的影响以抑制为主, 切断猫双侧迷走神经或内脏大、小神经后, 刺激Rm对猫胃电的抑制作用大为减弱, 提示下行抑制的传出途径可能与自主神经有某种联系. 欧阳守的实验首次提出与下行性抑制并存的"下行性兴奋系统", 并解释了电刺激中枢某些核团能兴奋胃肠功能.
Rm微量注射5-HT可抑制家兔的胃运动. Rm微量注射赛庚啶后可使家兔的胃运动增强, 胃电传导转向正常, 与何建华 et al[5]的实验结果相符. 据Couch报道[19], 5-HT对Rm的神经元多数引起兴奋效应. 本实验中, Rm内微量注射5-HT后可能是5-HT增强了Rm的活动, 并通过中缝-脊髓下行通路, 直接兴奋了交感节前神经元, 进而抑制了胃运动和胃电. 赛庚啶是5-HT2受体阻断剂, 本实验结果表明Rm内的5-HT2受体可能参与了胃运动胃电的调节作用. Rm注射5-HT后再注射昂丹司琼、西沙必利, 无显著变化.
Rm注射5-HT后频率减慢, PVN脑刺激后可进一步减慢胃电频率. 已知Rm与PVN有密切的纤维联系, Rm可能作为PVN的下级中枢, 传达或执行更高中枢的指令, 共同调控胃肠的功能活动.
总之, PVN微量注射5-HT对胃电主要为激动作用, 可能是通过5-HT3受体途径发挥作用. 而Rm注射5-HT则为抑制作用, 可能是通过5-HT2受体途径发挥作用; 进一步证实本实验室先前提出的中枢同时存在"下行性抑制"和"下行性兴奋"两个系统共同调控消化道功能的概念. PVN脑刺激抑制胃电活动, 并可进一步加强Rm注射5-HT对胃电的抑制作用. 下级中枢可能传达或执行更高中枢的指令, 共同调控胃肠的功能活动. 本实验还发现每当胃电频率发生变化的同时, 相位差通常发生紊乱、波形对应率较差, 频率是影响相位差及波形的一个重要因素. 胃电活动的"跟随"可能有一个"调整"与"适应"的过程, 对临床电起搏治疗功能性胃肠道疾病具有很好的指导意义.
5-HT又称为血清素, 是重要的神经递质, 近年来的研究提示5-HT广泛分布在于中枢神经和胃肠道, 并通过与其受体相互作用, 在胃肠动力、感觉及分泌中发挥重要作用. 研究表明5-HT是"脑-肠轴"中具有重要意义的单胺神经递质, 在"脑-肠轴"功能中起重要作用.
任超世, 研究员, 中国医学科学院生物医学工程研究所
Deponti et al研究发现5-HT可促进胃肠道运动, 使移行性复合运动波(MMC)出现次数增多, 并可导致内脏痛觉敏感.
本研究通过考察室旁核及中缝大核微量注射5-HT及各种阻断剂和电刺激对家兔胃电活动的影响, 进一步证实本实验室所提出的中枢同时存在"下行性抑制"和"下行性兴奋"两个系统共同调控消化道功能的概念.
本研究提示, PVN微量注射5-HT对胃电主要为激动作用, 可能是通过5-HT3受体途径发挥作用. 而Rm注射5-HT则为抑制作用, 可能是通过5-HT2受体途径发挥作用. 胃电活动的"跟随"可能有一个"调整"与"适应"的过程, 对临床电起搏治疗功能性胃肠道疾病具有很好的指导意义.
本研究方法合理,为兔胃电活动及其影响因素的研究提供了很好的参考, 具有较好的学术价值.
编辑: 李瑞敏 电编: 吴鹏朕
| 1. | Guth PH, Aures D, Paulsen G. Topical aspirin plus HCl gastric lesions in the rat. Cytoprotective effect of prostaglandin, cimetidine, and probanthine. Gastroenterology. 1979;76:88-93. [PubMed] [DOI] |
| 2. | Flanagan LM, Dohanics J, Verbalis JG, Stricker EM. Gastric motility and food intake in rats after lesions of hypothalamic paraventricular nucleus. Am J Physiol. 1992;263:R39-R44. [PubMed] [DOI] |
| 11. | Ouyang S, Zhang YP, Lin YB, Lin JJ, Li SY. Analysis of Phase Difference of Electrogastro-graphy. Program of Eighth International Workshop on Electrogastrography. San Diago, USA. May 2000: 41. . |