修回日期: 2009-09-29
接受日期: 2009-10-12
在线出版日期: 2009-10-28
目的: 探讨胰腺实性-假乳头状瘤(SPTP)的临床病理形态特征以及免疫组织化学特点.
方法: 回顾性总结分析14例SPTP的临床病理资料及免疫组织化学结果, 并以5例胰岛细胞瘤为对照(其中3例为非功能性, 2例为功能性).
结果: 14例SPTP患者中男女比例1:6, 平均年龄28岁, 瘤体平均直径7.25 cm, 包膜均完整, 组织学显示肿瘤细胞大小一致, 排列成实性片状区和假乳头状区, 围绕纤维血管复层排列而形成的假乳头状突起为特征性组织学改变. E-Cadherin、嗜铬素A均为阴性; β-Catenin在细胞核100%表达阳性, 胞质阳性率为78.5%(11/14), 细胞膜均为阴性; CD10表达阳性.
结论: SPTP是好发年轻女性的低度恶性肿瘤, 有特征性的假乳头结构; β-Catenin与E-Cadherin的异常表达可能与肿瘤的发生相关.
引文著录: 易敏, 王嵘, 王建国, 周世英, 张淑坤, 刘红明. 胰腺实性-假乳头状瘤临床病理观察14例. 世界华人消化杂志 2009; 17(30): 3155-3159
Revised: September 29, 2009
Accepted: October 12, 2009
Published online: October 28, 2009
AIM: To analyze the clinicopathological and immunohistochemical features of solid-pseudopapillary tumors of the pancreas (SPTP).
METHODS: The clinicopathological and immunohistochemical data of 14 SPTP patients and 5 islet cell tumor patients (including 3 cases of non-functional islet cell tumors and 2 cases of functional islet cell tumors) were analyzed retrospectively.
RESULTS: The ratio of male to female in 14 SPTP patients was 1:6. Their median age was 28 years old. The median diameter of the tumors was 7.25 cm. Histologically, the tumors were composed of pseudopapillary and solid structures. The solid areas were composed of uniform cells. The pseudopapillary structure with a fibrovascular core was remarkable. Immunohistochemically, the tumors were negative for E-cadherin and chromogranin A, but positive for β-catenin and CD10. The positive rates of nuclear and cytoplasmic β-catenin staining in SPTP were 100% and 78.5% (11/14), respectively. In contrast, no membrane β-catenin staining was detected.
CONCLUSION: SPTP is a rare type of tumor that has low malignant potential and remarkable pseudopapillary and is predominantly found in young women. Abnormal E-cadherin and β-catenin expression may be related to the tumorigenesis of SPTP.
- Citation: Yi M, Wang R, Wang JG, Zhou SY, Zhang SK, Liu HM. Clinicopathological features of solid-pseudopapillary tumor of the pancreas: an analysis of 14 cases. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3155-3159
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3155.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3155
胰腺实性-假乳头状瘤(solid-pseudopapillary tumor of pancreas, SPTP)是一种较罕见的肿瘤, 近年来随着发病率的增加逐渐被认识. 该肿瘤占胰腺外分泌肿瘤的0.17%-2.7%[1], 其生物学行为属于低度恶性, 组织学起源不明, 临床表现无特殊, 多数患者外科手术切除后预后良好, 但有10%-15%的患者可有复发、转移等恶性行为, 死亡率极低[2]. 本研究分析青海省肿瘤医院(5例)、青海省人民医院(6例)及西宁市第一人民医院(3例)病理科1998-2008年SPTP临床病理资料, 并进行β-Catenin、E-Cadherin、CD10等12项免疫组织化学检测, 对比5例胰岛细胞瘤, 旨在探讨其临床病理学特点及鉴别诊断要点.
复习1998-2008年胰腺肿瘤手术切除标本切片, 其中确诊为SPTP 14例, 女12例, 男2例, 男:女为1:6, 年龄14-42(平均28)岁. 并选择5例胰岛细胞瘤为对照, 其中3例为非功能性, 2例为功能性.
14例SPTP病例均挑选典型病变蜡块, 常规病理切片行HE染色, 免疫组织化学染色采用EnVision法. 抗体选用β-Catenin、E-Cadherin、CD10、CK18、AAT、NSE、嗜铬素A、突触素、波形蛋白、PR、Ki-67、CD56等12项. 所有抗体均购自北京中杉金桥生物技术有限公司, 使用PV-9000试剂盒及DAB显色系统显色. 并以5例胰岛细胞瘤进行对比.
14例SPTP病例中, 所有患者发病前无明显诱因, 无烟酒等不良嗜好, 无肿瘤家族史. 其中8例无临床症状, 因体检发现上腹部包块而就诊, 6例表现为上腹部不适或疼痛, 病程1 wk-6 mo. 影像学表现为界限清楚的低密度肿块, 常伴囊性变. 8例患者术前检查包括癌胚抗原、糖链抗原、甲胎蛋白、CA125、CA242、肝肾功能及血淀粉酶等, 仅1例患者出现轻度血清淀粉酶升高, 余均无异常. 术后大体标本检查发现, 肿瘤位于胰头部4例, 胰尾部4例, 胰颈体部2例, 胰体尾部2例, 胰头颈交界区1例, 胰旁1例. 随访1.6-9.7年, 患者均健在, 且无复发及转移. 具体情况见表1.
| 序号 | 性别 | 年龄(岁) | 肿瘤直径(cm) | 肿瘤部位 | 手术方式 | 随访时间(年) | 随访结果 |
| 1 | 女 | 14 | 6.0 | 胰头 | 胰十二指肠切除术+胆囊切除 | 1.6 | 正常 |
| 2 | 女 | 32 | 8.0 | 胰体尾 | 胰体尾+脾切除 | 2.9 | 正常 |
| 3 | 男 | 36 | 7.2 | 胰尾 | 胰体尾切除+脾切除+胃后壁切除 | 3.0 | 正常 |
| 4 | 女 | 42 | 2.3 | 胰头 | 胰十二指肠切除术 | 3.1 | 正常 |
| 5 | 女 | 16 | 5.5 | 胰尾 | 胰体尾+脾切除 | 3.2 | 正常 |
| 6 | 女 | 28 | 4.0 | 胰头 | 胰头肿瘤切除术 | 4.3 | 正常 |
| 7 | 女 | 19 | 4.6 | 腹腔 | 腹腔肿瘤切除术 | 4.3 | 正常 |
| 8 | 女 | 26 | 12.0 | 胰尾 | 胰体尾切除+脾切除 | 6.9 | 正常 |
| 9 | 女 | 23 | 5.3 | 胰头 | 胰十二指肠切除术 | 7.4 | 正常 |
| 10 | 女 | 39 | 3.6 | 胰尾 | 胰体尾切除+脾切除 | 7.9 | 正常 |
| 11 | 女 | 28 | 5.0 | 胰颈体交界区 | 胰腺肿瘤切除 | 8.2 | 正常 |
| 12 | 女 | 27 | 12.0 | 胰头颈 | 胰头肿物切除, 胰肠吻合, 空肠-空肠Rewx-en-Y吻合术 | 8.6 | 正常 |
| 13 | 男 | 15 | 6.0 | 胰颈体 | 胰颈体切除术 | 8.8 | 正常 |
| 14 | 女 | 15 | 20.0 | 胰体尾 | 胰尾肿瘤及脾切除 | 9.7 | 正常 |
2.2.1肉眼观察: 瘤体直径2.3-20 cm(表1), 平均7.25 cm, 均有完整包膜, 呈圆形、椭圆形, 边界清楚, 切面呈囊实性. 囊性区呈多房状, 内壁常附有松软暗红色絮状物; 实性区呈灰白及灰黄色, 质地松软.
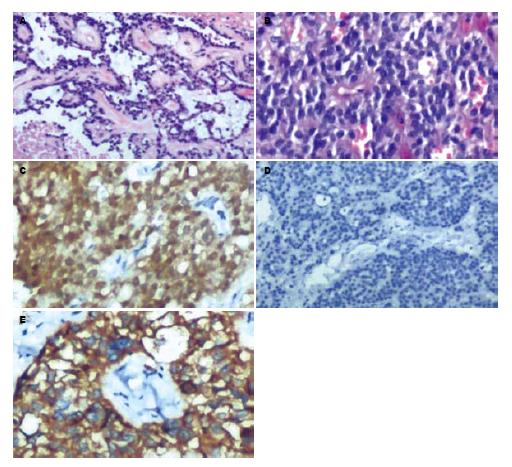
2.2.2 光镜观察: 14例SPTP组织学表现相似, 肿瘤由实性区、假乳头状区及囊性区构成. 实性区肿瘤细胞排列成片状、巢状, 被纤细的小血管分隔, 形态较一致, 呈圆形或卵圆形, 中等大小, 胞质嗜酸性, 细胞核的异型性小, 呈卵圆形, 位于中心, 染色质细腻, 部分细胞有核沟, 核分裂像罕见. 假乳头状区显示特征性分支状乳头,含纤维血管轴心, 乳头表面肿瘤细胞排列整齐, 形成假小梁, 乳头轴心内胶原纤维部分黏液变性(图1A), 其间有大量薄壁血管或血窦. 间质可见泡沫组织细胞聚集及胆固醇裂隙. 囊性区常可见出血、坏死. 其中2例肿瘤细胞之间及胞质内可见典型的嗜酸性小体(图1B); 3例间质内可见散在的钙化.
14例病例中SPTP肿瘤细胞E-Cadherin均为阴性(图1D); β-Catenin均为阳性, 且定位表现明显的特异性, 细胞核100%的表达阳性, 胞质阳性率为78.5%(11/14), 而细胞膜均为阴性(图1C); Vimentin均呈弥漫强阳性表达, 假乳头区表达程度较实性区强; NSE呈较强阳性表达(12/14); AAT表达阳性程度为可疑至++; CD10、CD56表达+至+++(图1E); CK18不同程度表达阳性; ChrA几乎全部为阴性表达, 仅1例为弱阳性; Syn部分阳性; PR呈强阳性表达; Ki-67指数在0.05%-1.50%, 实性区较假乳头区稍强(表2). 在胰岛细胞瘤对照组中, 肿瘤细胞均表达E-Cadherin, 阳性定位在细胞膜及细胞质; β-Catenin的阳性表达则定位在细胞膜及胞质, 核均为阴性; CD10均不表达(表3).
| 序号 | β-Cat | E-Cad | CD10 | Vim | PR | ChrA | NSE | AAT | CK18 | Syn | CD56 | Ki-67(%) |
| 1 | 核/浆 | - | ++ | ++ | +++ | - | + | ++ | + | - | + | 0.05 |
| 2 | 核 | - | +++ | ++ | ++ | - | +++ | ++ | 弱+ | + | + | 1.00 |
| 3 | 核/浆 | - | + | ++ | + | - | + | ++ | 弱+ | ± | + | 0.30 |
| 4 | 核/浆 | - | ++ | +++ | +++ | - | - | + | + | + | 灶状+ | 0.02 |
| 5 | 核/浆 | - | +++ | ++ | +++ | 弱+ | ++ | + | + | + | + | 4.00 |
| 6 | 核/浆 | - | + | + | + | - | + | + | + | - | ++ | 6.00 |
| 7 | 核/浆 | - | + | +++ | +++ | - | ++ | + | + | - | + | 0.05 |
| 8 | 核/浆 | - | + | +++ | +++ | - | +++ | ± | + | - | ++ | 0.01 |
| 9 | 核/浆 | - | +++ | +++ | +++ | - | +++ | ++ | + | + | + | 1.50 |
| 10 | 核/浆 | - | + | +++ | + | - | ++ | + | + | - | + | 0.02 |
| 11 | 核 | - | + | +++ | ++ | - | ++ | + | + | - | + | 0.05 |
| 12 | 核 | - | + | +++ | + | - | ++ | + | ± | ± | + | 0.10 |
| 13 | 核/浆 | - | ++ | ++ | +++ | - | - | - | + | + | + | 0.02 |
| 14 | 核/浆 | - | + | ++ | + | - | ++ | + | + | + | + | 1.20 |
| 序号 | β-Cat | E-Cad | CD10 | Vim | PR | ChrA | NSE | AAT | CK18 | Syn | CD56 | Ki-67(%) |
| 1 | 膜 | 膜 | - | + | + | +++ | +++ | - | + | ++ | + | 1.0 |
| 2 | 浆 | 膜/浆 | - | - | ++ | +++ | +++ | + | ++ | +++ | +++ | 1.0 |
| 3 | 膜/浆 | 浆 | - | - | - | + | ++ | - | - | + | ± | 7.0 |
| 4 | 膜 | 膜 | - | ++ | - | + | + | +++ | +++ | ++ | - | 20.0 |
| 5 | 膜/浆 | 浆 | - | +++ | + | ++ | ± | ++ | - | - | ++ | 0.9 |
SPTP是一种较少见的胰腺非内分泌源性肿瘤, 占胰腺所有外分泌肿瘤的0.17%-2.70%[1], 最早由Frantz在1959年描述. 近10年来随着对该病认识加深, 发病率逐渐升高[2]. 该病主要发生在青春期及青年女性, 男性罕见, 10岁以下儿童极少见, 40岁以上发病者也不超过10%, 无明显种族倾向[3]. 临床表现可无症状或仅上腹部不适, 影像学(如CT、B超等)表现为界限清楚的低密度肿块, 常伴囊性变, 不易将其与非功能胰岛细胞瘤鉴别[4]. 大体上胰腺SPTP多为包膜完整、境界清楚的肿块, 圆形、囊实性, 可触及波动感, 直径3-20(平均8-10) cm; 可见于胰腺的任何部位, 以胰头尾部多见, 也可发生在胰腺旁或胰腺以外的腹腔或腹膜后. 本组中有1例位于胰腺旁, 仅与胃壁轻微粘连(有学者认为可能起源于异位胰腺). 肿物切面多为半囊半实性, 囊性区常见坏死和出血, 实性区较少见.
SPTP的组织起源一直备受争议. 目前多数学者认为SPTP的细胞源于胰腺的潜能干细胞, 具有多向分化的能力, 主要以外分泌为特征, 部分伴有神经内分泌分化[5]. 本组研究SPTP中14例均可见到β-Catenin在细胞核和/或细胞质中沉积, E-Cadherin均为阴性, 这结果提示β-Catenin及E-Cadherin的基因突变可能与SPTP的发生密切相关. β-Catenin是Wnt信号转导通路的下游元件, 介导信号从胞膜至胞质再到细胞核的传递. 糖原合成酶激酶-3β的磷酸化作用引起β-Catenin降解, 使后者在正常细胞胞质中的游离量保持较低水平. 在SPTP肿瘤细胞中, 异常的Wnt信号抑制糖原合成酶激酶-3β磷酸化, 从而抑制β-Catenin降解, 导致β-Catenin在胞质中积累, β-Catenin转位入核增多, 与T细胞转录因子形成复合物, 促进下游靶基因, 如细胞周期蛋白D1、c-Myc等表达增多, 从而引起增生[6-8]. E-Cadherin为上皮细胞之间及细胞与细胞外基质黏附的重要黏附因子, 是位于染色体16q12.1上的基因编码的钙依赖性跨膜糖蛋白, 与其细胞内可溶性连环素(α、β、γ-连环素)结合形成复合体, 与相邻细胞的E-Cadherin相互连接, 参与细胞黏附和信号的传递, E-Cadherin的功能抑制或表达下降, 可使细胞间黏附能力下降[9]. 据本组研究结果, SPTP独特的组织形态学及侵袭性行为可能与此相关. 同时, 本研究14例PR阳性表达提示SPTP的发生、发展可能与PR水平有一定相关性. 上皮标志物(CK18)、腺泡标志物(AAT)、神经内分泌标志物(Syn、ChrA、NSE)和间叶标志物(Vim、CD10、CD56)均有阳性表达, 支持SPTP来源于潜能干细胞, 具有多向分化能力的学说.
SPTP组织学上可见细胞有实性片状和假乳头状2种排列方式. 肿瘤细胞胞质嗜伊红或透亮空泡状, 细胞核圆形或卵圆形, 染色质细腻, 可见核沟, 核分裂像罕见. 细胞质内及细胞外均可见嗜酸性小体, 经淀粉酶消化后PAS阳性. 实性区域肿瘤细胞中等大小, 并以小血管间隔. 远离小血管的肿瘤细胞逐步退变, 血管旁细胞围绕纤维血管复层排列而形成假乳头状突起, 成为SPTP特征性改变. 邻近囊性区域可见泡沫组织细胞、胆固醇裂隙、钙化、异物巨细胞和出血. 肿瘤大多有部分或完整包膜, 且肿瘤也可侵犯包膜. 如果肿瘤出现血管浸润、侵犯神经及周围组织、血管内见瘤栓、核分裂像增多, 则考虑肿瘤出现恶性变[5,10-11].
该病需与以下肿瘤鉴别: (1)非功能性胰岛细胞瘤, 也好发于青年女性, 实性区组织形态与SPTP相似, 但其有菊形团排列, 无假乳头结构, 免疫组织化学显示β-Catenin表达在细胞膜及胞质, 细胞核为阴性, E-Cadherin均为阳性, Vim、CD10均为阴性, 可资鉴别; (2)胰母细胞瘤, 常好发于年幼男孩, 组织学特征为腺泡结构伴有鳞状小体, 无纤维血管轴心及假乳头排列, insulinase(+)而Vim(-); (3)腺泡细胞癌, 该病更常见于老年男性, 癌组织与周围分界不清, 切面呈结节状, 镜下癌组织呈腺泡或小梁状排列而无假乳头状结构, CK(+), insulinase(+), 而AAT(-)[12-14].
手术切除是SPTP首选治疗方法, 常用手术方式包括肿瘤摘除、局部切除、胰十二指肠切除术等, 只要肿瘤可完整切除, 几种手术方式的预后情况无显著差异[3,10]. 某些直接侵犯而不能完全切除的病例可应用放疗. 2000年WHO肿瘤组织分类中认为, 虽然SPTP具良性形态学表现, 但必须将其归为未定的恶性潜能肿瘤, 预后较好. 据国内外报道显示, 仅有极少数病例术后复发或发生远处转移, 且即便局部复发或远处转移(如转移到肝及腹膜)的患者经再次手术, 其术后存活期仍可达几年甚至十几年[15]. SPTP的免疫组织化学Ki-67指数通常很低, 也提示SPTP是一种具有低度恶性潜能的肿瘤, 其预后良好及存活期较长也成为该病的一大特点. 该肿瘤的恶性程度与血管的浸润, 周围神经的浸润, 核异型性, 核分裂及显著的渐进性坏死相关[11]. 本研究14例患者随访2-10年, 均无复发及转移.
特别感谢中国医学科学院肿瘤医院苏勤教授对本研究最初设计构思所作贡献.
SPTP是一种较为罕见的胰腺肿瘤, 组织学起源不明, 生物学行为属于低度恶性, 好发于年轻女性, 临床表现不典型, 影像学及病理镜下观察易与非功能性胰岛细胞瘤相混淆. 本文旨在探讨SPTP临床病理学特点及鉴别诊断要点.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
仲韦霞 et al认为, SPTP的细胞源于胰腺的潜能干细胞, 具有多向分化的能力, 主要以外分泌为特征, 部分伴有神经内分泌分化.
在本研究中首次使用免疫标志物E-Cadherin对SPTP肿瘤细胞进行检测, 标记均为阴性, 分析可能与SPTP独特的组织形态学(围绕纤维血管复层排列而形成的假乳头结构)及侵袭性行为相关.
本研究提示, 在SPTP与非功能性胰岛细胞瘤组织形态学检查鉴别困难时, 可联合应用免疫标志物β-Catenin、E-Cadherin、CD10、AAT、NSE、嗜铬素A、突触素、波形蛋白、PR及CD56相鉴别, 以提高对SPTP的诊断率.
本文采用回顾性分析的方法, 对于SPTP的临床病理、免疫组织化学特征等进行了详细的对比研究, 对于临床上更好地鉴别诊断SPTP有较大的指导意义.
编辑: 李军亮 电编:何基才
| 1. | Klimstra DS, Wenig BM, Heffess CS. Solid-pseudopapillary tumor of the pancreas: a typically cystic carcinoma of low malignant potential. Semin Diagn Pathol. 2000;17:66-80. [PubMed] |
| 4. | Thambugala GM, Pereira J, Sugo E, Henry G, Cohn RJ. Solid and cystic papillary epithelial neoplasm of the pancreas in an 11-year-old girl: imaging features with pathological correlation. Australas Radiol. 2006;50:373-376. [PubMed] [DOI] |
| 5. | 仲 伟霞, 宋 化著, 郭 玲玲, 穆 殿斌, 孙 兰萍, 杨 爱清, 战 雪梅, 李 俞慧, 李 胜. 胰腺实性假乳头状瘤临床病理特征及预后的研究. 中华普通外科杂志. 2006;21:244-247. |
| 6. | Tanaka Y, Kato K, Notohara K, Hojo H, Ijiri R, Miyake T, Nagahara N, Sasaki F, Kitagawa N, Nakatani Y. Frequent beta-catenin mutation and cytoplasmic/nuclear accumulation in pancreatic solid-pseudopapillary neoplasm. Cancer Res. 2001;61:8401-8404. [PubMed] |
| 7. | Min Kim S, Sun CD, Park KC, Kim HG, Lee WJ, Choi SH. Accumulation of beta-catenin protein, mutations in exon-3 of the beta-catenin gene and a loss of heterozygosity of 5q22 in solid pseudopapillary tumor of the pancreas. J Surg Oncol. 2006;94:418-425. [PubMed] [DOI] |
| 8. | Nishimori I, Kohsaki T, Tochika N, Takeuchi T, Minakuchi T, Okabayashi T, Kobayashi M, Hanazaki K, Onishi S. Non-cystic solid-pseudopapillary tumor of the pancreas showing nuclear accumulation and activating gene mutation of beta-catenin. Pathol Int. 2006;56:707-711. [PubMed] [DOI] |
| 11. | 陈 柯, 丁 敏, 胡 闻, 王 晓秋. 胰腺实性-假乳头状肿瘤的超微结构研究. 临床与实验病理学杂志. 2006;22:681-683. |
| 12. | 刘 彤华, 刘 复生. 疑难外科病理诊断与鉴别诊断. 第1版. 北京: 科学技术文献出版社 2006; 210-211. |
| 13. | Zhang H, Liang TB, Wang WL, Shen Y, Ren GP, Zheng SS. Diagnosis and treatment of solid-pseudopapillary tumor of the pancreas. Hepatobiliary Pancreat Dis Int. 2006;5:454-458. [PubMed] |
| 15. | Martin RC, Klimstra DS, Brennan MF, Conlon KC. Solid-pseudopapillary tumor of the pancreas: a surgical enigma? Ann Surg Oncol. 2002;9:35-40. [PubMed] [DOI] |