修回日期: 2009-09-02
接受日期: 2009-09-21
在线出版日期: 2009-10-28
目的: 探讨人源乳酸杆菌对H. pylori诱导SGC7901细胞分泌IL-8及p38MAPK磷酸化水平的影响.
方法: 实验分为空白对照组、H. pylori刺激组、SB203580干预H. pylori刺激组和Lac15干预H pylori刺激组. 采用免疫细胞化学法观察该人源乳酸杆菌Lac15对H. pylori致SGC7901细胞p38MAPK磷酸化的影响. ELISA法观察该人源乳酸杆菌对H. pylori致SGC7901细胞分泌IL-8的影响.
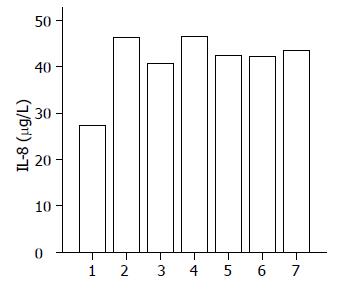
结果: H. pylori能诱导细胞的p38MAPK磷酸化水平增高(IA: 1.90±0.36 vs 14.01±1.12, P<0.01)以及IL-8分泌量明显增高(27.2616±0.27 ng/L vs 46.3691±0.33 ng/L, P<0.01). 预先使用一定浓度(3.0×1011 cfu/L, 3.0×1010 cfu/L, 3.0×109cfu/L)的人源乳酸杆菌Lac15干预后, p38MAPK磷酸化水平明显降低(IA: 4.61±1.13, 6.11±0.19, 8.25±0.56 vs14.01±1.12, 均P<0.01), IL-8分泌量明显降低(42.3209±0.24 ng/L, 42.1046±0.23 ng/L, 43.4636±0.25 ng/L vs46.3691±0.33 ng/L, 均P<0.05或0.01), 与H. pylori刺激组比较, 具有统计学意义.
结论: p38MAPK磷酸化参与H. pylori诱导的SGC7901细胞分泌IL-8, 人源乳酸杆菌Lac15可能通过抑制p38MAPK磷酸化途径抑制IL-8的分泌, 从而抑制炎症反应.
引文著录: 邓学杰, 马洪升, 余倩. 人源乳酸杆菌对幽门螺杆菌诱导胃上皮细胞炎症反应的调节及可能通路. 世界华人消化杂志 2009; 17(30): 3096-3100
Revised: September 2, 2009
Accepted: September 21, 2009
Published online: October 28, 2009
AIM: To investigate the effects of human-derived lactobacillus Lac15 on p38 mitogen-activated protein kinase (MAPK) phosphorylation and interleukin-8 (IL-8) secretion in human gastric cancer SGC7901 cells infected with Helicobacter pylori (H. pylori).
METHODS: SGC7901 cells were divided into four groups: normal control group, H. pylori infection group, SB203580 intervention group, and lactobacillus intervention group. The phosphorylation level of p38 MAPK in SGC7901 cells infected with H. pylori was evaluated by immunocytochemistry. The release of IL-8 in SGC7901 cells was detected by enzyme-linked immunosorbent assay (ELISA).
RESULTS: The phosphorylation level of p38 MAPK (IA: 1.90 ± 0.36 vs 14.01 ± 1.12, P < 0.01) and IL-8 secretion (27.2616 ± 0.27 ng/L vs 46.3691 ± 0.33 ng/L, P < 0.01) were significantly higher in SGC7901 cells infected with H. pylori than in normal control cells. After intervention with lactobacillus Lac15 at doses of 3×1011, 3×1010 and 3×109 cfu/L, both the phosphorylation level of p38 MAPK (IA: 4.61 ± 1.13, 6.11 ± 0.19 and 8.25 ± 0.56 vs 14.01 ± 1.12, respectively; all P < 0.01) and IL-8 secretion (42.3209 ± 0.24 ng/L, 42.1046 ± 0.23 ng/L and 43.4636 ± 0.25 ng/L vs 46.3691 ± 0.33 ng/L, respectively; all P < 0.05 or P < 0.01) decreased significantly in SGC7901 cells infected with H. pylori.
CONCLUSION: H. pylori infection can induce IL-8 secretion perhaps via a mechanism associated with promoting p38MAPK phosphorylation. Human-derived lactobacillus Lac15 can inhibit p38MAPK phosphorylation and thus decrease IL-8 secretion.
- Citation: Deng XJ, Ma HS, Yu Q. Human-derived lactobacillus Lac15 inhibits Helicobacter pylori-induced p38 mitogen-activated protein kinase phosphorylation and interleukin-8 secretion in human gastric cancer SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3096-3100
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3096.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3096
幽门螺杆菌(Helicobacter pylori, H. pylori)与慢性胃炎, 消化性溃疡, 胃黏膜相关淋巴样组织淋巴瘤以及胃癌的发生密切相关[1]. H. pylori与上皮细胞黏附后, 然后通过发生一系列信号转导机制, 进而引起细胞骨架重排及细胞内信号传导系统变化, 引发IL-8的分泌, 使中性粒细胞持续激活和进入胃黏膜, 进而导致一系列炎症反应. 长期以来, 乳酸杆菌作为胃内的优势菌群, 被认为是维持胃内微生态的主要承担者. 目前对于乳酸杆菌作用机制的研究主要集中在对H pylori的黏附抑制、体外抑杀和免疫调节等宏观水平上, 深入到细胞和分子水平阐述其作用机制的研究很少. 针对人体内所获取的乳酸杆菌具有安全性和黏附性好等特点, 研究筛选出的具有较强抑制H. pylori黏附细胞能力的一株人源乳酸杆菌Lac15对H pylori诱导SGC7901细胞炎症的调节作用, 通过观察该人源乳酸杆菌对H. pylori诱导SGC7901细胞p38MAPK磷酸化水平及IL-8分泌的影响来探讨其可能的作用机制, 从而筛选出可用于治疗的菌株.
胃腺癌SGC7901细胞、H. pylori悉尼株SS1(VacA+, CagA+), 冻存品由四川大学公共卫生学院医检教研室提供. 人源乳酸杆菌Lac15(唾液乳酸杆菌, 取自人胃肠道并经一定筛选后的实验菌株, 经法国梅里埃公司API50CHL鉴定培养基的鉴定), 由四川大学公共卫生学院医检教研室提供. 抗P-p38MAPK抗体, 购自武汉博士德生物工程有限公司. p38MAPK通路阻断剂 SB203580母液, 购自晶美生物(Alexis公司). 免疫组织化学染色SP Kit-9707超敏试剂盒, 购自福州迈新生物技术开发有限公司. 人IL-8定量ELISA试剂盒, 购自上海森雄科技实业有限公司.
H. pylori SS1解冻后涂于布氏平板, 置于厌氧培养箱中微需氧和37℃环境培养, 72 h后观察细菌生长情况, 经革兰染色光镜下观察菌体形态、染色特点和尿素酶试验鉴定证实为H. pylori, 分光光度计调浓度为1.0×1011 cfu/L. 人源乳酸杆菌Lac15厌氧培养, 在对数生长期分别调浓度为3.0×1012、3.0×1011、3.0×1010、3.0×109 cfu/L, 分别以纯1640重悬, 使用前配制. SGC7901细胞培养调浓度为2.5×108/L并种植6孔板, 每孔2 mL, 分为SGC7901空白对照组、H. pylori刺激组、SB203580干预H. pylori刺激组和Lac15干预H. pylori刺激组. 37℃ CO2温箱孵育24 h后PBS洗3次, 空白对照组加2 mL纯1640培养液, H. pylori刺激组加SS1悬液0.3 mL(3.0×107 cfu/孔), SB203580干预H. pylori刺激组加入SB203580 1 mL作用1 h后, 再加入SS1悬液0.3 mL, Lac15干预组分别加细菌悬液1 mL, 37℃ CO2温箱孵育1 h后, 再加入SS1悬液0.3 mL, 各组以纯1640培养液补充使体积均至2 mL. H. pylori作用3 h后收集上清, 离心, -70℃冰箱冻存, 以备检测IL-8水平. 各组爬片PBS洗3次后用40 g/L多聚甲醛固定, 然后用SP(Streptavidin)免疫组织化学染色法检测p38MAPK磷酸化水平的表达. 取出上述冻存的上清液, 用ELISA检测试剂盒检测各组上清液内的IL-8含量. 采用双抗体夹心ABC-ELISA法. 以标准品1000、500、250、125、62.5、32、16、0 ng/L的吸光度(A)值在半对数纸上作图, 画出标准曲线. 根据样品A值在该曲线图上查出相应人IL-8含量.
统计学处理 用SPSS12.0软件进行统计分析. 数据以mean±SD表示, 计量资料主要用t检验, 3组以上资料比较用单因素方差分析(One-way ANOVA法), 两两比较采用SNK法, 与对照组比较采用Dunnett法. 检验水准α = 0.05, P<0.05时, 具有统计学意义.
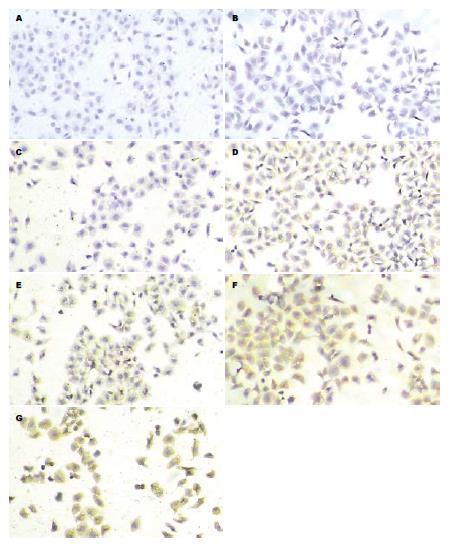
各组每张爬片随机选取3个视野照相, 每张照片使用Image-Pro Plus 5.0软件测量积分吸光度(IA)值, 以照片IA值表示各组P-p38MAPK阳性水平. H. pylori刺激组IA值明显高于空白对照组 (IA: 14.01±1.12 vs 1.90±0.36, P<0.01), 具统计学意义. Lac15(3.0×1012 cfu/L)干预组与H. pylori刺激组IA值比较(12.81±0.99 vs 14.01±1.12, P>0.05), 无统计学意义. Lac15(3.0×1011 cfu/L)、Lac15(3.0×1010cfu/L)、Lac15(3.0×109 cfu/L)干预组与H. pylori刺激组比较IA值明显降低(IA: 14.01±1.12 vs 4.61±1.13, 14.01±1.12 vs 6.11±0.19, 14.01±1.12 vs 8.25±0.56, P<0.01)具有统计学意义. Lac15(3.0×1011 cfu/L)干预组与Lac15(3.0×109 cfu/L)干预组比较, IA值降低(4.61±1.13 vs 8.25±0.56, P<0.05)具有统计学意义(图1, 表1).
| 分组 | p38MAPK磷酸化水平(IA值) | IL-8浓度(μg/L) |
| 空白对照组 | 1.90±0.36 | 27.2616±0.27 |
| H. pylori 刺激组 | 14.01±1.12b | 46.3691±0.33b |
| SB203580干预组 | 13.81±2.10b | 40.7577±0.28b |
| Lac15 (3.0×1012 cfu/L)干预组 | 12.81±0.99b | 46.5894±1.83b |
| Lac15 (3.0×1011 cfu/L)干预组 | 4.61±1.13ad | 42.3209±0.24ad |
| Lac15 (3.0×1010 cfu/L)干预组 | 6.11±0.19bd | 42.1046±0.23bd |
| Lac15 (3.0×109 cfu/L)干预组 | 8.25±0.56bd | 43.4636±0.25bd |
与空白对照组相比较, H. pylori刺激后, SGC7901细胞IL-8分泌量明显增加(46.3691±0.33 μg/L vs 27.2616±0.27 μg/L, P<0.01), 具有统计学意义. 预先使用p38MAPK通路阻断剂SB203580的细胞在H. pylori刺激后, IL-8分泌量较H. pylori刺激组明显减少(40.7577±0.28 μg/L vs 46.3691±0.33 μg/L, P<0.01)具有统计学意义. 预先与浓度为3.0×1011 cfu/L, 3.0×1010 cfu/L, 3.0×109 cfu/L的Lac15乳酸杆菌共育的SGC7901细胞在H. pylori刺激后, IL-8的分泌量较H. pylori刺激组减少(46.3691±0.33 μg/L vs 42.3209±0.24 μg/L, 46.3691±0.33 μg/L vs 42.1046±0.23 μg/L, 46.3691±0.33 μg/L vs 43.4636±0.25 μg/L, P<0.05或0.01), 具有统计学意义. 预先与浓度为3.0×1012 cfu/L的Lac15共育的细胞在H. pylori刺激后, IL-8分泌量与H. pylori刺激组相比较(46.3691±0.33 μg/Lvs 46.5894±1.83 μg/L, P>0.05), 无统计学意义(图2, 表1).
H. pylori是慢性胃炎, 消化性溃疡, 胃癌, MALT淋巴瘤等疾病的重要致病因素. 世界卫生组织和抗癌协会已肯定H pylori为致癌物[2]. H. pylori感染后可导致胃黏膜细胞变性、坏死, 炎细胞浸润, 进而造成胃黏膜屏障损害. H. pylori感染的先决条件是黏附, H. pylori与胃黏膜上皮的接触黏附是活动性炎症反应的细胞学机制的关键一步. 然后胃上皮细胞发生细胞骨架重组、酪氨酸磷酸化, 进而激活MAPK, 诱导前炎性细胞因子如IL-8的生成. H pylori感染引起胃黏膜强烈的中性粒细胞反应造成组织损伤被认为是相关疾病的机制之一, 其中IL-8对特异性和非特异性的免疫反应细胞具有强烈的趋化作用, IL-8为一种多源性的细胞因子, 在宿主免疫防御系统及炎症反应中起重要作用, 尤其是对中性粒细胞的趋化和激活作用, 并参与中性粒细胞与内皮细胞黏附过程的调节, 诱导细胞发生变形、脱颗粒, 释放氧自由基、白三烯和各种蛋白酶, 从而导致细胞膜变性坏死, 溶酶体破裂, 进一步导致细胞组织损伤. IL-8在H. pylori感染的胃黏膜中强烈表达, 使中性粒细胞持续激活和进入胃黏膜[3]. Keates et al[4]发现一株临床分离培养的H. pylori菌株显著增强了p38MAPK在AGS胃上皮细胞的活性, 因此认为p38MAPK可能与H. pylori刺激IL-8分泌的机制相关. Yamada et al[5]对胃上皮细胞MKN28的研究也表明, p38MAPK抑制剂可以明显降低H pylori诱导其分泌IL-8水平. 国内也有报道得出, H. pylori依赖p38MAPK信号通路诱导胃上皮细胞IL-8的分泌[6]. 具体有关H. pylori诱导胃上皮细胞表达分泌IL-8的细胞内信号转导通路尚未达成共识, 究竟何种通路起主要作用, 还需进一步研究.
乳酸杆菌除通过抑制H. pylori黏附上皮细胞, 分泌乳酸及抗菌肽类物质等, 尚可以通过调节细胞因子来抑制H pylori的致病作用. 乳酸杆菌能改善胃肠道的炎症, Kabir et al[7]发现L. salivarius WB 1004株不仅能抑制H. pylori与动物和人胃上皮细胞黏附而且能减少IL-8的分泌, 从而降低胃黏膜的炎症反应. 但乳酸杆菌自身几乎不引起上皮细胞分泌IL-8, 也不引起胃内病理改变. 但目前尚很难确定特定的乳酸杆菌株在炎症反应中的作用地位, 文献报道尚有分歧[8]. Blaster于1998[9]和2000[10]年报道认为无论从生物进化、致病性还是与机体的相互关系上, H. pylori都可以称得上是胃内的原籍菌. H. pylori在胃内诱发相关疾病, 不可避免地要受到胃内微环境的影响. 当胃窦部的H. pylori密度小于105时, 并不能导致胃及十二指肠溃疡的形成, H. pylori并不具有严格的致病性与非致病性的区别, 胃炎的严重程度和活动度与胃内细菌数量具有相关性[11]. 我们通过采用p38MAPK通路阻断剂SB203580, 阻断p38MAPK磷酸化途径, 观察其对H. pylori刺激后细胞IL-8分泌的影响, 在预先使用SB203580干预后, IL-8分泌量有减少, 与H pylori刺激组相比之下具有统计学差异. 同样, 我们选取筛选出的人源乳酸杆菌Lac15的不同浓度进行干预, IL-8的分泌量根据浓度的不同而有所变化, 其中, Lac15(3.0×1011 cfu/L)干预组及Lac15(3.0×1010 cfu/L)干预组的IL-8分泌量明显减少, 与H. pylori刺激组相比有统计学意义.
H. pylori可能通过激活p38MAPK磷酸化途径进而导致IL-8分泌, 致炎症反应的发生. SB203580能阻断p38MAPK通路从而减少IL-8的分泌. 浓度为3.0×1011 cfu/L和3.0×1010 cfu/L的人源乳酸杆菌Lac15可能通过抑制这一通路进而减少H. pylori刺激细胞引起的IL-8分泌, 从而减少炎症反应. 值得注意的是, 我们运用较高浓度的人源乳酸杆菌Lac15(3.0×1012 cfu/L)预先干预刺激后, p38MAPK磷酸化水平与H. pylori刺激组比较无明显降低, 且IL-8的分泌量与H pylori刺激组比较也无明显减少. 一方面说明p38MAPK通路与IL-8分泌的相关性, 另一方面也说明乳酸杆菌作为胃内常驻菌保持适当的比例以维持胃内微生态的平衡才能起到保护作用, 过多或过少都会影响菌群平衡.
幽门螺杆菌(H. pylori)与慢性胃炎, 消化性溃疡, 胃黏膜相关淋巴样组织淋巴瘤以及胃癌的发生密切相关, 他与上皮细胞黏附后, 通过一系列信号转导, 引起细胞骨架重排及细胞内信号传导系统变化, 导致一系列炎症反应. 长期以来, 乳酸杆菌被认为是维持胃内微生态的主要承担者. 目前对于乳酸杆菌作用机制的研究主要集中在其对H. pylori的黏附抑制、体外抑杀和免疫调节等宏观水平上, 深入到细胞和分子水平阐述其作用机制的研究很少.
白爱平, 副教授, 南昌大学第一附属医院消化内科; 陈卫昌, 教授, 苏州大学附属第一医院消化内科
传统的H. pylori根治法主要为质子泵抑制剂加两种抗生素的三联疗法, 但随之产生的耐药菌株增多, 使疗效下降, 且药物的一些不良反应患者不能耐受, 并可能出现抗生素相关疾病. 从微生态角度出发, 在体外筛选出具有较强抑制H. pylori黏附胃上皮细胞能力的人源乳酸杆菌, 可以开发相关的微生态制剂及保健食品, 从而开辟新的治疗领域.
本文主要采用体外筛选出的人源乳酸杆菌Lac15, 通过其对H. pylori诱导SGC7901细胞p38MAPK磷酸化水平及IL-8分泌的影响来探讨其可能的作用机制及阻断通路, 从而筛选出可用于治疗的菌株.
本文通过探讨人源乳酸杆菌Lac15可能的作用机制, 可以开发相关的微生态制剂及保健食品, 从而开辟新的治疗领域.
胃内微生态: 微生态系统是指在一定结构的空间内, 人体正常微生物群与人体的组织、细胞及其基因相互交流的统一生物系统, 主要包括口腔、胃肠道、泌尿、皮肤等系统. 人体胃肠道中生活的细菌大约有1014个, 由厌氧菌、兼性厌氧菌、需氧菌等300-500种微生物组成, 他们形成一个复杂的微生态系统, 对人的健康有重要影响.
本文研究了体外人源乳酸杆菌对H. pylori诱导胃上皮细胞炎症反应的调节及可能通路, 方法合理, 设计科学, 具有较好的可读性.
编辑: 李军亮 电编:吴鹏朕
| 2. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [PubMed] |
| 4. | Keates S, Hitti YS, Upton M, Kelly CP. Helicobacter pylori infection activates NF-kappa B in gastric epithelial cells. Gastroenterology. 1997;113:1099-1109. [PubMed] [DOI] |
| 5. | Yamada H, Aihara T, Okabe S. Mechanism for Helicobacter pylori stimulation of interleukin-8 production in a gastric epithelial cell line (MKN 28): roles of mitogen-activated protein kinase and interleukin-1beta. Biochem Pharmacol. 2001;61:1595-1604. [PubMed] [DOI] |
| 7. | Kabir AM, Aiba Y, Takagi A, Kamiya S, Miwa T, Koga Y. Prevention of Helicobacter pylori infection by lactobacilli in a gnotobiotic murine model. Gut. 1997;41:49-55. [PubMed] |
| 8. | Seegers JF. Lactobacilli as live vaccine delivery vectors: progress and prospects. Trends Biotechnol. 2002;20:508-515. [PubMed] [DOI] |
| 9. | Blaser MJ. Helicobacters are indigenous to the human stomach: duodenal ulceration is due to changes in gastric microecology in the modern era. Gut. 1998;43:721-727. [PubMed] |
| 10. | Rothenbacher D, Blaser MJ, Bode G, Brenner H. Inverse relationship between gastric colonization of Helicobacter pylori and diarrheal illnesses in children: results of a population-based cross-sectional study. J Infect Dis. 2000;182:1446-1449. [PubMed] [DOI] |