修回日期: 2009-09-09
接受日期: 2009-09-15
在线出版日期: 2009-10-28
目的: 观察转录因子Foxo3a对胃癌细胞SGC7901凋亡的影响, 并初步探讨其促进凋亡的分子机制.
方法: 构建Foxo3a真核表达质粒, 转染培养的胃癌细胞系SGC7901 4-6 h, 在FBS完全培养基培养24 h后, 换成0.1%无血清的培养基中培养8 h, TUNEL染色观察对胃癌细胞凋亡的影响, Western blot检测切割的caspase-3和PARP水平.
结果: 成功构建了Foxo3a真核表达质粒. 转染胃癌细胞后, 与对照组相比, 1和2 μg Foxo3a处理组胃癌细胞凋亡率达到了5.8%±2.3%和11.1%±3.4%, 是对照组的近2和4倍. caspase-3和PARP活性明显增高.
结论: Foxo3a是一种肿瘤抑制因子, 可通过促进caspase-3和PARP的活性来诱导癌细胞凋亡, 从而抑制肿瘤细胞的生长.
引文著录: 谭小平, 张庆, 朱燕妮, 何长华, 董卫国, 范文. Foxo3a对胃癌细胞SGC7901凋亡的促进作用. 世界华人消化杂志 2009; 17(30): 3092-3095
Revised: September 9, 2009
Accepted: September 15, 2009
Published online: October 28, 2009
AIM: To investigate the apoptosis-promoting effects of forkhead box O3a (Foxo3a) in human gastric cancer SGC7901 cells and explore molecular mechanisms involved.
METHODS: Foxo3a expression plasmid was introduced into SGC7901 cells via liposome-mediated transfection. Eight hours after transfected cells were cultured in culture medium containing 0.1% fetal bovine serum, apoptosis was measured by terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling (TUNEL) assay. The expression levels of cleaved caspase-3 and cleaved poly(ADP-ribose) polymerase (PARP) were detected by Western blot.
RESULTS: The recombinant Foxo3a expression plasmid was constructed successfully. The apoptotic rates of SGC7901 cells transfected with 1 and 2 μg of Foxo3a expression plasmid were 5.8% ± 2.3% and 11.1% ± 3.4%, respectively, significantly higher than those of control cells. The activity of caspase-3 and PARP was significantly higher in transfected cells than in control cells.
CONCLUSION: Foxo3a can promote apoptosis and inhibit proliferation in SGC7901 cells perhaps via upregulation of caspase-3 and PARP activity.
- Citation: Tan XP, Zhang Q, Zhu YN, He CH, Dong WG, Fan W. Apoptosis-promoting effects of forkhead box O3a in human gastric cancer SGC7901 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3092-3095
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3092.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3092
Forkhead(Fox)转录因子是2000年才发布统一命名的一个新的蛋白质家族, 主要通过转录调控和信号转导途径在动物的生长发育、代谢、细胞周期、凋亡等方面起重要作用. 该家族的共同特征是具有一个长110个氨基酸的保守的DNA结合结构域, 称为Fox结构域(Forkhead box), 折叠成3个α-螺旋和2个翅膀状的大环结构. Forkhead转录因子目前被分为17个亚家族, 他们功能多样, 有的目前尚不清楚. 其中研究最深入的是O亚家族(FoxO)[1-2]. 目前已知哺乳动物中Foxo蛋白家族有4个成员, 即Foxo1, Foxo3a, Foxo4, Foxo6. 他们分别由不同的基因编码, 并定位于不同的染色体上[3]. 他是一类重要的转录因子, 参与细胞周期、DNA损伤后修复、凋亡等多种细胞生物学过程的信号转导及其调控. 其中, Foxo3a与肿瘤发生关系密切, 如最近有学者发现在食管癌中, Foxo3a表达水平低的患者对放射性治疗的敏感性和预后都很差[4]. 为了研究Foxo3a在肿瘤发生发展中的作用, 我们构建了Foxo3a真核表达质粒, 并转染胃癌细胞, 观察他对胃癌细胞凋亡的影响.
293T, 胃癌细胞SGC7901均用含100 mL/L胎牛血清, 100 kU/L青霉素和50 mg/L链霉素的DMEM培养液中培养, 在50 mL/L CO2的培养箱中传代生长, 取对数生长期的细胞用于本实验研究. XhoⅠ, BamHⅠ限制性内切酶购自Promega公司; DNA连接酶购自TaKaRa大连宝生物工程有限公司; 琼脂糖凝胶DNA回收试剂盒、质粒快速提取试剂盒购自百泰克生物技术公司; 脂质体Lipofectamine 2000®购自Invitrogen公司, TUNEL试剂盒购自碧云天公司; BCA蛋白浓度检测试剂盒、ECL发光试剂盒购自Thermo Scientific公司; 所用抗体: Flag抗体, 切割的caspase-3、PARP、β-actin均购自Santa Cruz公司.
1.2.1 细胞总RNA的提取和RT-PCR扩增: 常规293T细胞培养, 采用TRIzol试剂, 按说明书提取细胞总RNA. 用紫外分光光度计测定其浓度和纯度. 以总RNA为模板, 用M-MLV逆转录酶反转录成cDNA再以cDNA为模板PCR扩增人Foxo3a的基因. 引物序列为: 上游: 5'-CCGGATATCGGCAGAGGCACCGGCTT-3', 下游: 5'-CGCGGATCCTCAGCCTGGCACCCA-3'. 此引物去掉了基因前的ATG, 可与载体上的Flag融合表达, 并引入XhoⅠ, BamHⅠ酶切位点. RCR产物在琼脂糖凝胶中电泳, 在紫外线下切下含目的条带的凝胶, 用DNA回收纯化试剂盒回收.
1.2.2 重组克隆载体的构建和鉴定: 用限制性内切酶XhoⅠ, BamHⅠ对PCR产物和载体3×FLAG-CMV7.0分别进行双酶切反应, 各自获得带有黏性末端的DNA片段, 再分别在琼脂糖凝胶中电泳, 用DNA凝胶回收纯化试剂盒回收纯化并测定浓度. 将上述纯化的酶切PCR产物和酶切载体在T4连接酶的作用下作连接反应. 连接反应混合物转化E.coli DH5α感受态细菌, 在含有氨苄青霉素LB平板上生长过夜, 进行抗性筛选. 次日挑选阳性克隆菌, 在含有氨苄青霉素液体培养基中培养过夜后, 用质粒小抽试剂盒按说明书操作进行质粒小量提取. 然后用内切酶XhoⅠ, BamHⅠ进行双酶切反应, 琼脂糖凝胶电泳行酶切鉴定. 通过鉴定后的菌液由上海生工生物工程技术服务有限公司进行测序.
1.2.3 细胞转染: 在转染前1 d将1-1.5×106细胞铺于6孔板中, 在37℃、50 mL/L CO2、100 mL/L胎牛血清的完全培养基条件下, 培养20 h至细胞完全贴壁, 待细胞生长至占据培养皿底面积的80%以上时, 吸去部分培养基, 留下1 mL. 取适量的待转染的质粒, 加入适量无血清OPTI-DMEM培养基使其终体积达200 μL, 在另一Eppendorf管中加入5 μL Lipofectamine 2000并用上述DMEM培养基将体积补足至200 μL, 放置5 min, 将质粒溶液与Lipofectamine 2000溶液轻柔混匀, 于室温放置20 min. 将质粒和脂质体混合液400 μL加入6孔板中, 转染6 h后, 加入培养基1 mL, 37℃, 50 mL/L CO2培养24 h. 转染分为3组, 即3×Flag空载体组, 1 μg Foxo3a组和2 μg Foxo3a组. 转染胃癌细胞6 h后, 在100 mL/L胎牛血清完全培养基中继续培养24 h后, 换成1 mL/L胎牛血清培养基培养8 h, 然后进行TUNEL染色或Western blot检测.
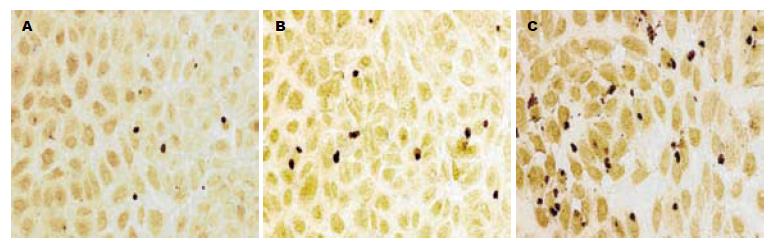
1.2.4 细胞凋亡实验: 培养的肿瘤细胞经过适当处理后, 弃去培养基, PBS洗2遍, 加入3%甲醛固定5-10 min, PBS洗2遍. 根据TUNEL试剂盒操作说明书检测细胞凋亡. 在荧光显微镜下观察照相, 计数凋亡细胞和正常细胞数, 计算凋亡细胞阳性百分率.
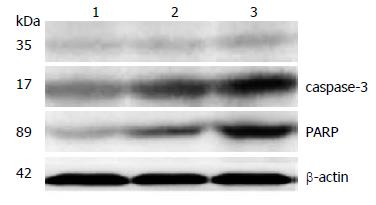
1.2.5 Western blot: 肿瘤细胞经过适当处理后, 弃去培养基, 用PBS冲洗细胞2遍, 然后每孔加入适量细胞裂解缓冲液(50 mmol/L Tris-HCl pH7.5, 1% Triton X-100, 150 mmol/L NaCl, 2 mmol/L EDTA, 5 mmol/L DTT, 1 mmol/L NaF3, 1 mmol/L PMSF和Cocktail蛋白酶混合抑制剂), 冰上裂解细胞并收集蛋白. 采用BCA法测定细胞裂解液中蛋白的浓度. 每个样本取等量的总蛋白, 加入适量的5×上样缓冲液, 进行10% SDS-PAGE电泳, 将蛋白转印到PVDF膜上, 然后用合适的一抗和二抗杂交, ECL发光法检测, 暗室曝光, 图像用蛋白凝胶成像仪分析.
统计学处理 应用SPSS11.0统计软件, 计量资料采用单因素方差分析, 计数资料采用卡方检验, P<0.05差异有统计学意义.
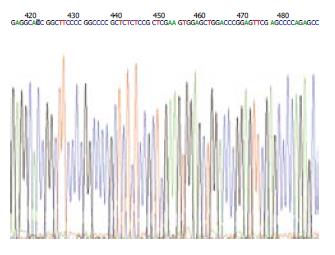
将重组体和空载体分别进行双酶切反应, 经琼脂糖凝胶电泳, 并与DNA Marker相比, 重组体电泳后显示2条带, 相对分子质量较小的条带为预期分子量大小, 表明Foxo3a基因已正确克隆到载体. DNA测序结果经与GenBank人Foxo3a基因(序列号:AF032886)比对, 序列一致(图1).
胃癌细胞转染3×Flag空载体无Flag蛋白表达; 而转染Foxo3a 1和2 μg后, 有Flag融合蛋白的表达, 且随着转染量的增加, 蛋白表达也逐渐增加(图2, 一抗为Flag抗体).
对照组胃癌细胞凋亡率较低, 而转染了Flag-Foxo3a的细胞凋亡明显增加(1和2 μg处理组胃癌细胞凋亡率达到了5.8%±2.3%和11.1%±3.4%, 是对照组的近2倍和4倍), 与转染空质粒组相比具有显著性差异(P<0.01, 图3), 提示Foxo3a可增强胃癌细胞凋亡.
与对照组相比, 1和2 μg 2组细胞中切割的caspase-3和PARP水平呈增高趋势, 特别是切割的PARP变化更为明显(P<0.01, 图4). 表明Flag-Foxo3a增高了caspase-3和PARP的活性而促进胃癌细胞凋亡.
Foxo3a是一个重要的转录因子, 在肿瘤的发生、发展中起重要作用. 最近报道, 在吸烟引起的肺腺癌小鼠模型中, 50.7%的小鼠可以检测到Foxo3a的纯合子缺失, 说明Foxo3a的丢失促进了吸烟引起的肺腺癌的发生发展[5]. Foxo3a是一个肿瘤抑制因子, 可通过增强GADD45和DDB1的表达, 促使损伤后DNA修复[6]. 在急性白血病中往往有混合谱系白血病(mixed lineage leukemia, MLL)基因的重排, 包括易位、缺失和重复. MLL基因最容易易位到Foxo3a基因的附近, 获得强的Foxo3a蛋白转录激活域, 使其控制的基因表达明显增强, 而正常的Foxo3a蛋白不能表达, 导致其肿瘤抑制作用丧失[7]. Foxo3a蛋白可通过上调P27Kip1和下调Cyclin D抑制细胞周期, 在一些肿瘤中, PTEN肿瘤抑制因子失活, 使PI3K/Akt活性增强而抑制Foxo3a的活性, 从而使其抑制细胞周期的作用减弱, 有助于肿瘤的发展[8].
Foxo3a可通过多种信号途径引起肿瘤细胞凋亡而抑制肿瘤的发生. 在造血细胞中, Foxo3a可以诱导FasL和Fas的表达, 激活FADD-caspase-8凋亡酶体, 活化的caspase-8可依次激活其他胱冬酶[9]. 在吸烟导致的肺腺癌中, Foxo3a活性常常丢失. 在用尼古丁衍生物NNK诱导细胞癌变前, Foxo3a活性往往增强, 使SMAD4, KLF-4, LEF-1等54种与凋亡有关的基因的表达增加[10]. 在紫杉醇敏感的乳腺癌中, 抗癌药紫杉醇增强JNK的活性, 导致AKT抑制, Foxo3a的活性增强, 诱导凋亡促进因子Bim的表达[11]. 而这些与凋亡有关的因子含量增加或活性增强, 一般是通过激活死亡受体依赖性信号通路和线粒体依赖性信号通路诱发caspase级联反应, 最终激活caspase-3和PARP. caspase-3和PARP是发挥凋亡的最终执行者, 进而抑制DNA的修复并启动DNA的降解, 导致细胞凋亡[12].
Foxo3a转录因子活性在多种水平上受到调节, 包括基因表达水平、翻译后修饰、蛋白质稳定性等多个层次[13]. 其中磷酸化和去磷酸化修饰在调节Foxo3a蛋白的亚细胞定位及其转录活性中起重要作用. 如10%的血清可激活AKT等多个信号途径, 使Foxo3a磷酸化而出细胞核, 抑制其转录活性[14]. 为了使其以活性形式存在, 我们在胃癌细胞转染了Foxo3a后, 换成0.1% FBS的培养基中培养. 结果表明活性形式的Foxo3a可使caspase-3和PARP活性增强, 胃癌细胞凋亡率明显增加, 说明Foxo3a可通过caspase-3和PARP活性增强而引起肿瘤细胞凋亡[15]. Radisavljevic 报道一氧化氮合酶抑制剂可以使人乳腺癌细胞珠T47D凋亡明显增加, 其具体机制可能是一氧化氮合酶抑制剂使Foxo3a 32位上的苏氨酸发生磷酸化, 激活了Rho激酶而导致细胞凋亡[16].
总之, 我们成功构建了Foxo3a真核表达质粒, 并转染了胃癌细胞SGC7901, 发现Foxo3a通过增强caspase-3和PARP活性而促进了肿瘤细胞的凋亡, 而Foxo3a促进肿瘤细胞凋亡更深入的分子机制有待于进一步的研究.
Foxo3a是一肿瘤抑制因子, 可通过增强GADD45和DDB1的表达, 促使损伤后DNA修复. 最近有学者发现在食管癌中, Foxo3a表达水平低的患者对放射性治疗的敏感性和预后都很差.
郑鹏远, 教授, 郑州大学第二附属医院消化科
Foxo3a可通过多种信号途径引起肿瘤细胞凋亡而抑制肿瘤的发生. 在造血细胞中, Foxo3a可以诱导FasL和Fas的表达, 激活FADD-caspase-8凋亡酶体, 活化的caspase-8可依次激活其他胱冬酶.
本研究成功构建了Foxo3a真核表达质粒, 并转染了胃癌细胞SGC7901, 发现Foxo3a通过增强caspase-3和PARP活性而促进了肿瘤细胞的凋亡, 而Foxo3a促进肿瘤细胞凋亡更深入的分子机制有待于进一步的研究.
本研究通过观察转录因子Foxo3a对胃癌细胞SGC7901的凋亡作用, 证实Foxo3a是一种肿瘤抑制因子, 设计合理, 有一定临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Kaestner KH, Knochel W, Martinez DE. Unified nomenclature for the winged helix/forkhead transcription factors. Genes Dev. 2000;14:142-146. [PubMed] |
| 2. | Arden KC, Biggs WH 3rd. Regulation of the FoxO family of transcription factors by phosphatidylinositol-3 kinase-activated signaling. Arch Biochem Biophys. 2002;403:292-298. [PubMed] [DOI] |
| 3. | Accili D, Arden KC. FoxOs at the crossroads of cellular metabolism, differentiation, and transformation. Cell. 2004;117:421-426. [PubMed] [DOI] |
| 4. | Chen MF, Fang FM, Lu CH, Lu MS, Chen WC, Lee KD, Lin PY. Significance of nuclear accumulation of Foxo3a in esophageal squamous cell carcinoma. Int J Radiat Oncol Biol Phys. 2008;71:1220-1229. [PubMed] [DOI] |
| 5. | Herzog CR, Blake DC Jr, Mikse OR, Grigoryeva LS, Gundermann EL. FoxO3a gene is a target of deletion in mouse lung adenocarcinoma. Oncol Rep. 2009;22:837-843. [PubMed] [DOI] |
| 6. | Greer EL, Brunet A. FOXO transcription factors at the interface between longevity and tumor suppression. Oncogene. 2005;24:7410-7425. [PubMed] [DOI] |
| 7. | Burgering BM, Kops GJ. Cell cycle and death control: long live Forkheads. Trends Biochem Sci. 2002;27:352-360. [PubMed] [DOI] |
| 8. | Birkenkamp KU, Coffer PJ. Regulation of cell survival and proliferation by the FOXO (Forkhead box, class O) subfamily of Forkhead transcription factors. Biochem Soc Trans. 2003;31:292-297. [PubMed] [DOI] |
| 9. | Behzad H, Jamil S, Denny TA, Duronio V. Cytokine-mediated FOXO3a phosphorylation suppresses FasL expression in hemopoietic cell lines: investigations of the role of Fas in apoptosis due to cytokine starvation. Cytokine. 2007;38:74-83. [PubMed] [DOI] |
| 10. | Blake DC Jr, Mikse OR, Freeman WM, Herzog CR. FOXO3a elicits a pro-apoptotic transcription program and cellular response to human lung carcinogen nicotine-derived nitrosaminoketone (NNK). Lung Cancer. 2009; Apr 18. [Epub ahead of print]. [PubMed] |
| 11. | Sunters A, Madureira PA, Pomeranz KM, Aubert M, Brosens JJ, Cook SJ, Burgering BM, Coombes RC, Lam EW. Paclitaxel-induced nuclear translocation of FOXO3a in breast cancer cells is mediated by c-Jun NH2-terminal kinase and Akt. Cancer Res. 2006;66:212-220. [PubMed] [DOI] |
| 12. | Coopersmith CM, Chang KC, Swanson PE, Tinsley KW, Stromberg PE, Buchman TG, Karl IE, Hotchkiss RS. Overexpression of Bcl-2 in the intestinal epithelium improves survival in septic mice. Crit Care Med. 2002;30:195-201. [PubMed] [DOI] |
| 14. | Reagan-Shaw S, Ahmad N. The role of Forkhead-box Class O (FoxO) transcription factors in cancer: a target for the management of cancer. Toxicol Appl Pharmacol. 2007;224:360-368. [PubMed] [DOI] |