修回日期: 2008-12-19
接受日期: 2008-12-22
在线出版日期: 2009-01-28
目的: 探讨胃癌组织芯片中RUNX3、VEGF表达与MVD的相关性及其意义.
方法: 采用组织芯片技术建立经确证80例胃癌的组织芯片, 免疫组化检测芯片中RUNX3、VEGF的表达及微血管密度计数.
结果: RUNX3在胃癌芯片中表达阳性率分别为阴性46.3%(37/80)、弱阳性35.0%(28/80)和强阳性18.7%(15/80); VEGF的表达阳性率分别为阴性22.5%(18/80)、弱阳性30.0%(24/80)和强阳性47.5%(38/80), 其阳性表达部位为细胞质. MVD值RUNX3表达阳性者显著低于表达阴性者; VEGF表达阳性者显著高于表达阴性者, RUNX3的表达和MVD之间存在显著负相关(rs = -0.742, P<0.01), VEGF的表达和MVD之间存在显著正相关(rs = 0.683, P<0.01). VEGF表达阳性率在RUNX3阴性组逐渐增高; 在RUNX3弱阳性组逐渐增高, 在RUNX3强阳性组逐渐降低, RUNX3的表达和VEGF之间存在显著的负相关(rs = -0.333, P<0.01).
结论: RUNX3作为一种抑癌基因可能通过某种机制抑制VEGF的表达减少胃癌的血管新生、生长和转移; 联合检测RUNX3、VEGF和MVD的表达, 对把握胃癌生物学行为和预后有一定的价值.
引文著录: 伏洁, 张煦, 王靖. 应用胃癌组织芯片研究RUNX3、VEGF与MVD的相关性及其意义. 世界华人消化杂志 2009; 17(3): 321-325
Revised: December 19, 2008
Accepted: December 22, 2008
Published online: January 28, 2009
AIM: To investigate the expressions of human runt-related transcription factor 3 (RUNX3), vascular endothelial growth factor (VEGF) and microvascular density (MVD) using gastric cancer tissue microarray and their significance.
METHODS: Gastric cancer tissue microarray was prepared, and the expressions of RUNX3, VEGF and MVD were detected using immunohistochemistry in 80 gastric cancer cases proved pathologically.
RESULTS: RUNX3 expression was classified as negative 46.3% (37/80), weak positive 35.0% (28/80) and strong positive 18.7% (15/80) respectively; VEGF was strongly expressed in 47.5% (38/80), weakly in 30% (24/80) and negatively in 22.5% (18/80). A positive reaction was mainly distributed in cytoplasm. MVD was lower in the positive expression of RUNX3 than the negative expression; MVD in the positive expression of VEGF was greater than the negative expression. The expression of RUNX3 was negatively correlated with MVD (rs = -0.742, P < 0.01), and the expression of VEGF was positively correlated with MVD (rs = 0.683, P < 0.01). The positive expression rates of VEGF increased gradually in negative expression and weak positive but decreased gradually in strong positive of RUNX3. The expression of RUNX3 was negatively correlated with VEGF (rs = -0.333, P < 0.01).
CONCLUSION: RUNX3 may inhibits the expression of VEGF by some mechanism and reduces the angiogenesis, growth, and metastasis of gastric cancer, combined detection of RUNX3, VEGF and MVD can estimate the biological behaviour and prognosis of the patients more exactly.
- Citation: Fu J, Zhang X, Wang J. Correlation analysis among RUNX3, VEGF and MVD and their significance using gastric cancer tissue microarray. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 321-325
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/321.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.321
胃癌是一类多基因疾病, 癌基因的活化是促使肿瘤发生的关键因素之一, 但抑癌基因的失活在肿瘤发生、发展过程中可能起到更加常见、重要的作用[1-3]. 人类相关转录因子3(human runt-related transcription factor 3, RUNX3)是新发现的一个位于1号染色体(1p36.11-p36.13)[4]的肿瘤抑制基因, 尤其在胃癌的发生发展过程中尤为重要[11]. 然而肿瘤血管生成受许多血管生成因子与抑制因子的调节, 血管内皮生长因子(vascular endothelial growth factor, VEGF)是最强有力的血管生成因子, 在血管新生中扮演至关重要的角色. 二者与肿瘤浸润、转移及血管新生有密切关系, 在肿瘤的多步骤演进中起重要作用. 其潜在的机制尚不清楚, 为证明RUNX3与VEGF之间的关系, 本实验采用组织芯片和超敏SP免疫组化法, 检测胃癌中RUXNX3、VEGF的表达与微血管密度(microvascular density, MVD)的关系及意义.
收集武威肿瘤医院2006-01/2007-12手术切除胃癌的蜡块80例, 术前未接受放疗和化疗.
1.2.1 制作组织芯片: 复查HE切片, 在HE切片上找到肿瘤细胞伏击的区域并对照蜡块的位置作标记, 确定取材位点. 用制备组织芯片的模具制作2 mm的空心蜡模, 用内径为2 mm的组织芯片取样器在蜡块的标记位点取出组织蜡芯, 将其放入空心蜡模的孔中, 制成6×7组织微阵列并对组织芯片蜡块进行4 μm厚连续切片, 裱褙于APES防脱片预处理的载玻片上.
1.2.2 染色: 免疫组化均采用SP法, 切片经脱蜡、酒精水化、微波抗原热修复; 3%过氧化氢阻断后, 滴加稀释的一抗RUNX3(1:100)(北京博奥森公司)、VEGF和CD34(北京中杉公司), 4℃过夜后加二抗, DAB显色, 苏木素复染, 封片. 以PBS代替一抗作阴性对照, 用已知阳性片作阳性对照.
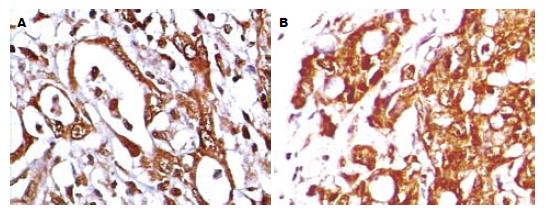
1.2.3 结果判定: 在临床病理资料双盲的条件下, 分别由二位病理医师在芯片的实质区选取视野, 记数肿瘤细胞总数及阳性染色细胞所占比例, 独立判定结果, 最后讨论核实确认. RUNX3与VEGF的阳性表达为细胞质有棕褐色颗粒; 将阳性表达肿瘤细胞百分比≤l0%记为阴性; 11%-50%记为弱阳性; >50%记为强阳性.
1.2.4 MVD测定: 采用CD34抗体标记血管内皮细胞, 低倍镜下选取微血管数量最密集的视野, 在200倍视野范围计算3个视野的微血管数目, 取其平均值作为MVD. 肿瘤区域凡是染成棕色的单个内皮细胞或内皮细胞簇, 均作为一个血管计数.
统计学处理 利用SPSS13.0 for Windows统计软件进行数据处理, MVD数值以mean±SD计算. 采用χ2检验和方差分析进行显著性比较, 采用Spearman等级相关和分类数据相关分析. P<0.05认为有统计学意义.
RUNX3在正常胃腺上皮高表达, 胃癌芯片RUNX3表达阳性率分别是阴性组46.3%, 弱阳性组35.0%, 强阳性组18.7%, 阳性表达率逐渐降低; VEGF在正常胃腺上皮低表达, VEGF表达阳性率分别是阴性组22.5%, 弱阳性组30.0%, 强阳性组47.5%, 其阳性表达率逐渐升高, 阳性表达部位为肿瘤细胞胞质(图1), 详细资料见表1.
| 特征 | 总数 n = 80 | 阴性 18/37 | 弱阳性 24/28 | 强阳性 38/15 | P |
| 性别 | |||||
| 男 | 65 | 33/15 | 22/19 | 12/30 | 0.461 |
| 女 | 15 | 4/2 | 6/5 | 3/8 | 0.670 |
| 年龄/岁 | |||||
| ≤60 | 51 | 24/10 | 16/14 | 11/27 | 0.564 |
| >60 | 29 | 13/8 | 12/10 | 4/11 | 0.426 |
| 病理类型 | |||||
| 管状 | 32 | 16/7 | 10/8 | 6/17 | 0.732 |
| 乳头状 | 12 | 3/3 | 6/3 | 3/6 | 0.982 |
| 弥漫性 | 19 | 9/3 | 6/7 | 4/9 | |
| 黏液性 | 3 | 1/1 | 2/1 | 0/1 | |
| 混合性 | 10 | 5/3 | 3/3 | 2/4 | |
| 印戒 | 4 | 3/1 | 1/2 | 0/1 | |
| Lauren's分型 | |||||
| 肠型 | 45 | 22/10 | 14/15 | 10/20 | 0.281 |
| 弥漫型 | 26 | 12/6 | 9/7 | 5/13 | 0.952 |
| 混合型 | 9 | 3/2 | 5/2 | 0/5 | |
| 临床分期 | |||||
| Ⅰ-Ⅱ | 29 | 8/12 | 13/9 | 8/8 | 0.037 |
| Ⅲ-Ⅳ | 51 | 29/6 | 15/15 | 7/30 | 0.004 |
采用CD34标记微血管清晰, 定位确切. 计数肿瘤细胞浸润区域. RUNX3表达阴性组MVD为50.13±9.28, 弱阳性组为38.21±7.63, 强阳性组为19.42±6.89,显著性递减(P<0.05). RUNX3表达和MVD之间存在显著的负相关(rs = -0.742, P<0.01); VEGF表达阴性组MVD为23.24±6.82, 弱阳性组为46.91±7.28, 强阳性组为51.31±8.71, 显著性递增(P<0.05). VEGF表达和MVD之间存在显著的正相关(rs = 0.683, P<0.01, 表2).
| 变量 | n | MVD | F&P | 变量与MVD相关性 |
| RUNX3 | ||||
| 阴性 | 40 | 50.13±9.28 | F = 64.38, | rs = -0.742, |
| 弱阳 | 28 | 38.21±7.63 | P = 0.00 | P<0.01 |
| 强阳 | 12 | 19.42±6.89 | ||
| VEGF | ||||
| 阴性 | 18 | 23.24±6.82 | F = 79.83, | rs = 0.683, |
| 弱阳 | 24 | 46.91±7.28 | P = 0.00 | P<0.01 |
| 强阳 | 38 | 51.31±8.71 |
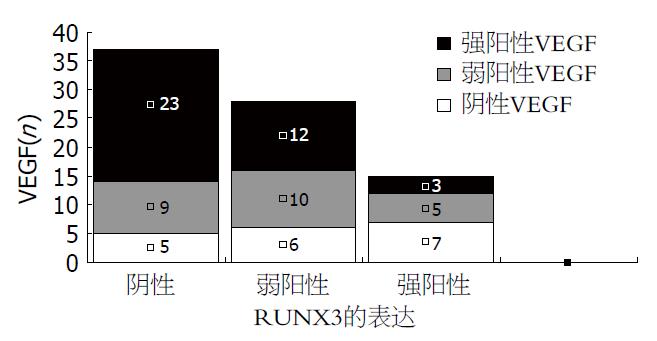
VEGF表达阳性率在RUNX3阴性组逐渐增高(13.5%<24.3%<62.2%), 在RUNX3弱阳性组逐渐增高(21.4%<35.7%<42.9%), 在RUNX3强阳性组逐渐降低(46.7%>33.3%>20.0%), 分类数据的相关分析得出χ2 = 9.178, P = 0.002, 认为RUNX3和VEGF表达存在线性变化关系; RUNX3和VEGF表达之间存在显著的负相关(rs = -0.333, P<0.01, 图2).
胃癌的发生是一个多因素、多步骤、多基因参与的过程, 是环境和遗传共同作用的结果, 他涉及到基因的不稳定性, 端粒酶的活化, 癌基因的激活, 抑癌基因的失活. RUNX3基因被认为是一种新发现的抑癌基因, 对胃癌细胞的生长有明显的抑制作用, 对胃黏膜上皮细胞的调控、脊神经节的神经发育和T细胞分化中都发挥重要作用[5-8]. 在人类许多癌细胞株和癌组织中都存在RUNX3杂合性缺失, 并且与这些癌细胞株或癌组织中的RUNX3表达下调有关[9]. RUNX3在正常胃腺上皮表达阳性, 在45%-60%的胃癌中出现RUNX3基因表达下调或缺失, 推测RUNX3基因可能是抑制胃癌发生的关键基因[7,11]. 本实验RUNX3和VEGF他们在胃癌组织芯片中的表达在性别、年龄、病理类型、Lauren's分型方面并无显著性差异, 但在临床分期方面具有差异有显著性, 充分显示了RUNX3在胃癌的发生、发展过程中的抑制作用, 以及VEGF促进肿瘤生长方面的作用.
Li et al[7]发现缺乏RUNX3基因阳性表达的小鼠, 胃黏膜上皮细胞增殖加快并且凋亡受到抑制, 而且细胞对生长抑制因子如TGF2β表现出拮抗效应, TGF2β又是许多细胞的有效抑制子(如上皮细胞、内皮细胞等), 表明RUNX3基因是胃上皮细胞生长和增殖的调控者[6-7]. 研究证实, RUNX3在很多肿瘤中具有肿瘤抑制作用并且与肿瘤的浸润、转移及血管新生的关系密切[10]. 而VEGF是体内外血管内皮细胞最主要的有丝分裂原, 通过选择性地与血管内皮细胞膜上高亲和力的受体结合, 使受体活化, 然后进一步激活其下游的相关基因表达, 刺激内皮细胞迁移与增殖.
胃癌的生长必须依赖血管的新生, 宿主内皮细胞增殖, 出芽形成新生血管, 向肿瘤方向生长, 构建肿瘤血运通道, 为其提供营养并运输代谢产物. 现已公认, 肿瘤血管生成是肿瘤生长和转移的必要条件. VEGF是最强有力的血管生成因子, 是目前已知活性最强、特异性最高的血管生成因子, 其他血管生成因子大都通过增强VEGF的表达产生血管生成作用[12].
本实验胃癌VEGF表达阳性率为47.5%, 文献中报道的VEGF表达阳性率跨度很大, 从26.7%到84.0%; 研究表明, VEGF阳性胃癌呈为较大体积、进展期等, 其阳性组生存率低于阴性组, 能独立预测肝转移.
肿瘤血管新生机制复杂, 微血管密度是衡量肿瘤血管生成的量化指标, 一般应用FⅧAg、CD31、CD34来标记肿瘤血管, 是检测评估血管新生的一种间接手段. 采用CD34标记微血管清晰, 定位确切, 使微血管计数简单高效. 仅计数肿瘤细胞浸润区域. 本组MVD范围在19-51之间, 平均为38.20, 文献中MVD值大致在24-48之间, 高MVD总生存率显著低下. 本研究显示, RUNX3的表达与MVD的rs = -0.742, 存在显著的负相关(P<0.01); 而VEGF表达与MVD的rs = 0.683, 存在显著的正相关(P<0.01), 胃癌RUNX3、VEGF表达与MVD之间具有显著性意义. 可能在RUNX3抑癌基因发挥作用的同时其对VEGF于MVD的抑制作用也发生了.从实验中可以发现, RUNX3的阴性表达伴随VEGF过表达现象, RUNX3的低表达可能通过某种机制促进了VEGF的血管新生作用,使MVD值升高. RUNX3表达与VEGF表达之间存在显著线性关系, 应用分类数据的相关分析, rs = -0.333, 表明RUNX3和VEGF表达之间存在显著的负相关(P<0.05).
本研究提示在形态学方面, RUNX3失活和VEGF激活在胃癌进程中同时发挥作用, 对于潜在机制的进一步研究, 必将对胃癌的诊断和治疗带来新的启示. VEGF主要是使内皮细胞分裂增殖、血管构建和升高血管的通透性, 内皮细胞遗传学上稳定, 突变率低, 针对内皮细胞的药物较少存在耐药性问题. 因此, 我们认为RUNX3, VEGF和MVD联合检测有助于胃癌的监测, 同时抑制两种或多种与肿瘤血管生成相关的因子, 或者加用抑制肿瘤血管形成的因子, 可以从多个靶点抑制肿瘤血管形成, 指导临床治疗从而产生更好的效果, 对把握胃癌生物学行为和预后等具有一定的价值. 故可考虑以RUNX3为靶点联合VEGF进行胃癌的抗血管生成治疗, 以他们为靶点的抗肿瘤治疗将具有广阔的前景, 随着研究的不断深入, RUNX3有望成为胃癌诊断的一个新型生物学指标和基因治疗靶点.
人类runt相关转录因子3(RUNX3)基因属于RUNT家族成员, 参与胚胎发育过程中细胞基因表达的调控. 人类RUNT家族包括3个RUNT基因, 分别为RUNX1、RUNX2、RUNX3. 其中RUNX3是最小的, 是哺乳动物RUNT家族进化的基础, 对其研究也是最少的. 近年来研究发现, 在许多肿瘤中存在RUNX3基因的异常, 其抑癌机制尚不完全清楚, 可能作为TGF-β传导通路中的一个重要环节, 参与TGF-β上皮细胞生长的负调控作用.
高泽立, 副教授, 上海交通大学医学院附属第九人民医院周浦分院消化科
本研究提示RUNX3失活和VEGF激活在胃癌的进程中共同发挥作用,对于潜在机制的进一步研究,必将对胃癌的诊断和治疗带来新的启示.
近两年发现RUNX3基因对胃癌细胞的生长有明显的抑制作用, 并能阻止其在裸鼠体内的致瘤性. 而敲除掉RUNX3基因, 可使鼠胃黏膜发生异常增生. 在人类许多癌细胞株和癌组织中都存在RUNX3杂合性缺失, 并且与这些癌细胞株或癌组织中的RUNX3表达下调有关. 而VEGF是体内外血管内皮细胞最主要的有丝分裂原, 通过选择性地与血管内皮细胞膜上高亲和力的受体结合,使受体活化, 然后进一步激活其下游的相关基因表达, 刺激内皮细胞迁移与增殖.
随着研究的不断深入, RUNX3有望成为胃癌诊断的一个新型生物学指标和基因治疗靶点.
本文选题新颖, 实验方法先进, 实验数据可信, RUNX3有望成为胃癌诊断的一个新型生物学指标, 为胃癌的基因靶向治疗的提供了新的理论依据.
编辑: 史景红 电编:吴鹏朕
| 1. | Waki T, Tamura G, Sato M, Terashima M, Nishizuka S, Motoyama T. Promoter methylation status of DAP-kinase and RUNX3 genes in neoplastic and non-neoplastic gastric epithelia. Cancer Sci. 2003;94:360-364. [PubMed] [DOI] |
| 2. | Kim TY, Lee HJ, Hwang KS, Lee M, Kim JW, Bang YJ, Kang GH. Methylation of RUNX3 in various types of human cancers and premalignant stages of gastric carcinoma. Lab Invest. 2004;84:479-484. [PubMed] [DOI] |
| 3. | Osaki M, Moriyama M, Adachi K, Nakada C, Takeda A, Inoue Y, Adachi H, Sato K, Oshimura M, Ito H. Expression of RUNX3 protein in human gastric mucosa, intestinal metaplasia and carcinoma. Eur J Clin Invest. 2004;34:605-612. [PubMed] [DOI] |
| 4. | Bae SC, Takahashi E, Zhang YW, Ogawa E, Shigesada K, Namba Y, Satake M, Ito Y. Cloning, mapping and expression of PEBP2 alpha C, a third gene encoding the mammalian Runt domain. Gene. 1995;159:245-248. [PubMed] [DOI] |
| 5. | Lund AH, van Lohuizen M. RUNX: a trilogy of cancer genes. Cancer Cell. 2002;1:213-215. [PubMed] [DOI] |
| 6. | Fukamachi H, Ito K. Growth regulation of gastric epithelial cells by Runx3. Oncogene. 2004;23:4330-4335. [PubMed] [DOI] |
| 7. | Li QL, Ito K, Sakakura C, Fukamachi H, Inoue K, Chi XZ, Lee KY, Nomura S, Lee CW, Han SB. Causal relationship between the loss of RUNX3 expression and gastric cancer. Cell. 2002;109:113-124. [PubMed] [DOI] |
| 8. | Bangsow C, Rubins N, Glusman G, Bernstein Y, Negreanu V, Goldenberg D, Lotem J, Ben-Asher E, Lancet D, Levanon D. The RUNX3 gene--sequence, structure and regulated expression. Gene. 2001;279:221-232. [PubMed] [DOI] |
| 9. | Yanada M, Yaoi T, Shimada J, Sakakura C, Nishimura M, Ito K, Terauchi K, Nishiyama K, Itoh K, Fushiki S. Frequent hemizygous deletion at 1p36 and hypermethylation downregulate RUNX3 expression in human lung cancer cell lines. Oncol Rep. 2005;14:817-822. [PubMed] |
| 10. | Sato K, Tomizawa Y, Iijima H, Saito R, Ishizuka T, Nakajima T, Mori M. Epigenetic inactivation of the RUNX3 gene in lung cancer. Oncol Rep. 2006;15:129-135. [PubMed] |
| 11. | Carvalho R, Milne AN, Polak M, Corver WE, Offerhaus GJ, Weterman MA. Exclusion of RUNX3 as a tumour-suppressor gene in early-onset gastric carcinomas. Oncogene. 2005;24:8252-8258. [PubMed] [DOI] |
| 12. | Wood JM. Inhibition of vascular endothelial growth factor (VEGF) as a novel approach for cancer therapy. Medicina (B Aires). 2000;60 Suppl 2:41-47. [PubMed] |