修回日期: 2008-12-12
接受日期: 2008-12-15
在线出版日期: 2009-01-28
目的: 探讨维生素D受体(vitamin D receptor, VDR)基因多态性与酒精性肝病易感性之间的关系.
方法: 采用半巢式聚合酶链式反应-限制性片段长度多态性(semi-nested PCR-RFLP)技术检测50例酒精性肝病患者和72例健康志愿者VDR多态性的基因型, 并比较甘肃汉族人群和酒精性肝病患者之间VDR基因多态性、基因型频率、等位基因频率的差异与酒精性肝病相关性的分析.
结果: 共检出3种VDR基因型, 即BB、Bb、bb. 病例组bb基因型频率显著高于对照组(χ2 = 7.16, P = 0.028, OR = 2.698, 95% CI: 1.167-6.235); b等位基因的频率病例组显著高于对照组(χ2 = 11.64, P = 0.001, OR = 3.071, 95% CI: 1.583-3.958). 通过多因素非条件Logistic回归模型, 发现携带bb基因型的个体暴露于酒精后容易发展成酒精性肝病, bb基因型可能是酒精性肝病发生的一种易患因素(OR = 2.272, OR 95% CI: 0.971-5.318).
结论: 维生素D受体基因BsmⅠ酶切位点基因型与酒精性肝病之间存在相关性, bb基因型可能是酒精性肝病发生的一种易患基因.
引文著录: 孙平, 王沁. 维生素D受体基因多态性与酒精性肝病的相关性. 世界华人消化杂志 2009; 17(3): 273-278
Revised: December 12, 2008
Accepted: December 15, 2008
Published online: January 28, 2009
AIM: To investigate the relationship between vitamin D receptor gene polymorphism and susceptibility to alcoholic liver disease (ALD).
METHODS: The Semi-nested PCR-restriction fragment length polymorphism (semi-nested PCR-RFLP) technology was used to analyze 50 ALD patients and 72 healthy controls. Comparison was made between the two groups in genotype frequencies, allele frequencies, and finally a correlation analysis was performed.
RESULTS: We found three genotypes in the case group and control group, that is, BB, Bb and bb. The bb genotype frequency and b allele frequency were significantly higher in case group than in control group (χ2 = 7.16, P = 0.028, OR = 2.698, 95% CI: 1.167-6.235; χ2 = 11.64, P = 0.001, OR = 3.071, 95% CI: 1.583-3.958). Multi-factor unconditional Logistic regression analysis showed cases carrying bb genotype were more likely to develop into the ALD, indicating that bb genotype might be a genetic risk factor in ALD (OR = 2.272, OR 95% CI: 0.971-5.318).
CONCLUSION: The vitamin D receptor gene BsmⅠ site polymorphism is strongly associated with the ALD, and bb genotype may be a risk factor for development ALD.
- Citation: Sun P, Wang Q. Relationship between vitamin D receptor gene polymorphisms and alcoholic liver disease. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 273-278
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/273.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.273
酒精性肝病(alcoholic liver disease, ALD)是由于长期饮酒导致的肝损害, 表现为3种形式, 分别为酒精性脂肪肝、酒精性肝炎、酒精性肝硬化. ALD在西方国家是导致肝硬化的最主要原因. 近年来, 我国ALD的发病率也呈逐年上升趋势, 酒精已成为继病毒之后导致肝损伤的第二大原因[1]. 目前尚不清楚其确切的发病机制, 可能与酒精代谢产物对肝脏的毒性作用、氧化应激、免疫反应、内毒素血症、基因多态性, 病毒的协同作用有关[2]. 研究发现VDR基因多态性与多种疾病有关, 而且与肝病之间也存在相关性[3-8]. 由于VDR基因存在多态性可影响与维生素D在体内的活性形式1, 25-(OH)2D3发挥免疫调节作用[3,5,7], 我们通过对VDR基因多态性的研究, 发现VDR基因多态性与ALD之间存在相关性.
2007-07/2008-05在兰州大学第一医院消化科住院或门诊就诊的酒精性肝病患者50例(病例组), 以及在兰州大学第一医院体检中心体检的健康志愿者72例(对照组). 研究对象为长期居住在本地且无血缘关系的汉族人. 研究对象行肝功、血脂、肝纤维化4项、肝炎病毒学指标、肝脏B超等相关检查. 病例组: 50例, 平均年龄45±6.41岁, 诊断标准依据中华医学会肝病学分会脂肪肝和酒精性肝病学组2006-02修订的《酒精性肝病诊疗指南》[9], 并排除其他肝病. 对照组: 72例, 平均年龄49±5.22岁, 均为参加体检的健康志愿者. 上海生工UNIO-10柱式血液基因组抽提试剂盒, 上海生工UNIO-10柱式PCR产物回收试剂盒; 大连宝生物(日本TaKaRa)DL2000型DNA分子质量Marker, 大连宝生物(日本TaKaRa)PCR扩增试剂盒; 美国NEB(Newland Biolabs, NEB)公司限制性内切酶BsmⅠ; 其他试剂均为国产分析纯.
1.2.1 采血: 清晨采静脉血2 mL, 收集于EDTA抗凝管中, -80℃冰箱中冻存.
1.2.2 基因组DNA提取: 采用上海生工UNIO-10柱式血液基因组抽提试剂盒提取血样中基因组DNA.
1.2.3 半巢式PCR引物: 根据PubMed中VDR基因的全序列(注册号AB002168), 参考相关文献设计VDR基因BsmⅠ位点半巢式PCR引物[8,10], 由上海生工合成引物. 引物序列如下: 上游引物P1, 5'-CAA CCA AGA CTA CAA GTA CCG CGT CAG TGA-3', 下游引物P2, 5'-TGG CGG CAG CGG ATG TAC GTC TGC-3', 下游引物P3, 5'-AAC CAG CGG AAG AGG TCA AGG G-3'.
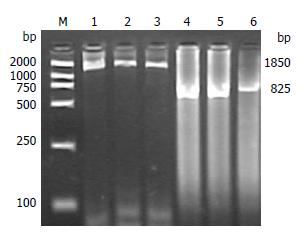
1.2.4 半巢式PCR反应: 半巢式PCR外扩增. 按照下列成份在冰上配置反应体系, 10×PCR缓冲液5 μL(含有MgCl2), dNTPs混合液4 μL, 引物P1、P2各1 μL, TaKaRa Taq酶1 μL(5 U/μL), 基因组DNA 1 μL, 去离子水37 μL, 总反应体系50 μL. 将上述反应体系置PCR扩增仪, 按下列程序进行半巢式PCR外扩增, 94℃预变性5 min, 94℃变性30 s、66℃退火1 min、72℃延伸2 min、32个循环, 72℃再延伸7 min. 取5 μL PCR产物用15 g/L琼脂糖凝胶电泳, 溴化乙啶染色, 以DNA分子质量Marker为参照, 紫外灯下观察扩增结果, 扩增产物1850 bp. 半巢式PCR内扩增. 取外扩增产物1 μL, 按照1:100稀释后, 取稀释后的PCR产物1 μL加入事先配置好的反应体系中, 10×PCR缓冲液5 μL(含有MgCl2), dNTPs混合液4 μL, 引物P1、P3各1 μL, TaKaRa Taq酶1 μL(5 U/μL), 去离子水37 μL, 总反应体系50 μL. 将上述反应体系混匀后置PCR扩增仪, 按下列程序进行半巢式PCR内扩增: 94℃预变性5 min, 94℃变性30 s、60℃退火1 min、72℃延伸1 min、35个循环, 72℃再延伸5 min. 取5 μL PCR产物用20 g/L琼脂糖凝胶电泳, 溴化乙啶染色, 以DNA分子质量 Marker为参照, 紫外灯下观察扩增结果,扩增产物825 bp.
1.2.5 PCR扩增产物的回收: 采用上海生工UNIO-10柱式PCR产物回收试剂盒, 对825 bp扩增产物进行回收.
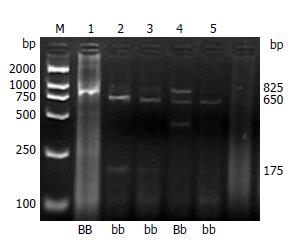
1.2.6 限制性片段长度多态性分析(RFLP): 对PCR回收产物进行RFLP分析, 反应体系如下: 向一只灭菌的PCR反应管中依次加入下列试剂, 灭菌双蒸水12.5 μL, 10×BsmⅠ缓冲液2 μL, 825 bp回收产物5 μL, NEB的限制性内切酶BsmⅠ 0.5 μL(10 U/μL), 酶切反应体系共20 μL, 65℃水浴16 h. 取酶切产物5 μL, 用20 g/L琼脂糖凝胶电泳, 溴化乙啶染色, 以DNA分子质量Marker为参照, 用凝胶成像分析系统判断基因型. VDR基因型判断标准参照相关文献[11]: 缺乏相应酶切位点为BB型(825 bp), 杂合子为Bb型(825 bp, 175 bp, 650 bp), 存在相应酶切位点为bb型(175 bp, 650 bp).
统计学处理 数据处理采用R×C表χ2检验. 由SPSS11.0统计软件计算基因型频率、等位基因频率, 进行遗传学Hardy-Weinberg平衡检验, P<0.05有统计学意义, 最后进行多因素非条件Logistic回归分析.
病例组和对照组VDR基因型分布、等位基因分布, 两者相比较, 病例组bb基因型频率显著高于对照组, b等位基因频率病例组显著高于对照组, 以上结果P<0.05, 有统计学意义(表1-2, 图1-2).
| 分组 | n | 基因型 | |||
| BB | Bb | bb | BB+Bb | ||
| 病例组 | 50 | 4(8.0) | 6(12.0) | 40(80.0) | 10(10.0) |
| 对照组 | 72 | 19(26.4) | 10(13.9) | 43(59.7) | 29(40.3) |
| 合计 | 122 | 23(18.9) | 16(13.1) | 83(68.0) | 39(32.0) |
| OR | 31.667 | 1.550 | 2.698 | 0.371 | |
| 95% CI | 7.983-125.618 | 0.516-4.657 | 1.167-6.235 | 0.160-0.857 | |
| P | 0.028 | 0.001 | 0.435 | 0.020 | 0.018 |
| 分组 | 等位基因 | OR | 95% CI | Pearson列联系数 | |
| b | B | ||||
| 病例组 | 86(86.0) | 14(14.0) | |||
| 对照组 | 96(66.7) | 48(33.3) | 3.071 | 1.583-3.958 | 0.213 |
| 合计 | 182(74.6) | 72(25.4) | |||
对病例组和对照组的VDR基因型分布进行遗传学平衡检验, 结果符合Hardy-Weinberg遗传平衡定律.
通过建立多因素非条件Logistic回归模型, 筛选与ALD有关的危险因素, P<0.05, 有统计学意义. 最后进入回归模型的危险因素有3个, 他们分别为饮酒状况、基因型、ALT(表3-4).
| 研究因素 | 变量 | 赋值 |
| 年龄(岁) | X1 | <45 = 1, 45-54 = 2, 55-64 = 3, >65 = 4 |
| 性别 | X2 | 女 = 0, 男 = 1 |
| 饮酒状况 | X3 | 不饮酒 = 0, 饮酒 = 1 |
| 基因型 | X4 | Bb = 0, BB = 1, bb = 2 |
| ALT | X5 | <50 U/L = 0, >50 U/L = 1 |
| AST | X6 | <50 U/L = 0, >50 U/L = 1 |
| ALT/AST | X7 | <1 = 0, >1 = 1 |
| 总胆红素 | X8 | 3.4-17.1 μmol/L = 0, >17.1 μmol/L = 1 |
| 结合胆红素 | X9 | 0-6.8 μmol/L = 0, >6.8 μmol/L = 1 |
| 非结合胆红素 | X10 | 1.7-17.1 μmol/L = 0, >17.1 μmol/L = 1, |
| CHOL | X11 | 3.60-5.70 mmol/L = 0, >5.70 mmol/L = 1 |
| TG | X12 | 0.80-1.80 mmol/L = 0, >1.80 mmol/L = 1 |
| HDL | X13 | 0.80-1.08 mmol/L = 0, >1.08 mmol/L = 1 |
| LDL | X14 | 1.55-3.70 mmol/L = 0, >3.70 mmol/L = 1 |
| 透明质酸(HA) | X15 | 50.0-120.0 mg/L = 0, >120.0 mg/L = 1 |
| 层黏蛋白(LN) | X16 | 90.0-133.0 μg/L = 0, >133.0 μg/L = 1 |
| 人型前胶原(HacⅢ) | X17 | <120.0 μg/L = 0, >120.0 μg/L = 1 |
| Ⅳ型胶原(Ⅳ.C) | X18 | <84.7 μg/mL = 0, >84.7 μg/mL = 1 |
| 结合胆酸(SCG) | X19 | <290.0 μg/mL = 0, >290.0 μg/mL = 1 |
| 是否患酒精性肝病 | Y | 对照 = 0, 患者 = 1 |
| 入选变量 | 回归系数b | 标准误Sb | WaldΧ2 | P | OR | 95% CI For OR | |
| Lower | Upper | ||||||
| X3 | 9.613 | 29.010 | 0.110 | 0.740 | 14964.120 | 0.000 | 7.4E+28 |
| X4 | 0.821 | 0.434 | 3.580 | 0.058 | 2.272 | 0.971 | 5.318 |
| X5 | 3.649 | 1.085 | 11.319 | 0.001 | 38.439 | 4.587 | 322.120 |
| 常数项 | -11.487 | 29.018 | 0.157 | 0.692 | 0.000 | ||
人类的VDR基因定位于12q13, mRNA全长4791 bp; 由9个外显子和8个内含子组成. 外显子Ⅰ位于5'端非编码区, 分为ⅠA、ⅠB、ⅠC; 外显子Ⅱ-外显子Ⅸ是真正编码VDR结构的外显子. 外显子Ⅱ和外显子Ⅲ编码DNA结合结构域, 外显子Ⅳ-Ⅸ编码配体结合结构域. 用限制性内切酶BsmⅠ、ApaⅠ、TaqⅠ、FokⅠ对VDR基因进行基因多态性研究, 发现VDR基因存在4种限制性内切酶切割位点, BsmⅠ切割位点位于第Ⅷ内含子内[12]. 目前研究发现VDR基因多态性与许多疾病之间存在相关性. 对原发性胆汁性肝硬化和自身免疫性肝炎的研究, 发现FokⅠ位点多态性与自身免疫性肝炎存在相关性, BsmⅠ位点多态性与原发性胆汁性肝硬化存在相关性[8,11]; 对乙型病毒性肝炎研究发现, VDR基因TaqⅠ和FokⅠ位点多态性与HBV感染结局存在相关性[13]; ApaⅠ位点多态性与肝纤维化存在相关性[14]. VDR基因多态性可能是通过影响VDR的mRNA的表达与稳定, 造成VDR数量或活性的差异, 从而改变了其与1, 25-(OH)2D3的亲和力、结合DNA的能力及转录激活能力[11]. 对结核病和乙型病毒性肝炎研究也发现, VDR基因多态性可以影响免疫反应的强度与类型[15-16].
维生素D在体内的活性形式是1, 25-(OH)2D3, 以前认为其主要调节钙、磷代谢, 现在认为1,25-(OH)2D3和其的类似物还具有抗细胞增殖、诱导细胞分化、免疫调节等功能. 其能激活单核细胞和巨噬细胞, 抑制淋巴细胞的增殖, 抑制树突状细胞分化为抗原呈递细胞; 其可以减少细胞因子IL-1、IL-2、IL-6、IL-12、INF-γ、TNF-α和TNF-β的产生; 除此之外, 其还具有神经保护作用, 可以诱导产生神经生长因子[8,11]. 1, 25-(OH)2D3通过以下机制发挥作用: 其与VDR结合形成激素-受体复合物, 该复合物与VDR基因上的激素反应元件结合, 再通过与其他调节因子相互作用, 从而对VDR基因的表达进行调控, 发挥免疫调节功能[8,17]. VDR基因存在多态性可能影响1, 25-(OH)2D3的发挥免疫调节作用, 并由此诱发或加重某些免疫性疾病[18].
基因和环境因素共同决定了酒精性肝病的发生, 酒精性肝病具有遗传易感性. 与酒精代谢有关的乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)基因多态性决定了东方人对酒精性肝病的遗传易感性, 细胞色素P4502E1(CYP2E1)基因多态性决定了氧化应激的程度, 内毒素受体基因多态性影响了炎性细胞因子的释放, TNF-α和IL-10基因多态性影响了他们对肝脏的作用效果[2].
酒精性肝病发生与免疫反应和炎性细胞因子产生有关, 与酒精性肝病有关的炎性细胞因子主要包括IL-1、IL-6、TNF-α和TGF-β等[2]. 本研究结果显示VDR基因BsmⅠ位点多态性与酒精性肝病之间存在相关性, 病例组的bb基因型频率和b等位基因频率显著高于对照组, 有统计学意义(P<0.05). 通过建立多因素非条件Logistic回归模型, 采用逐步回归的方法, 剔除一些变量后, 最后进入回归方程的变量有3个, 分别是饮酒状况、基因型和ALT, 我们发现bb基因型是和酒精性肝病发生相关联的一种易患基因(OR = 2.272, OR 95% CI: 0.971-5.318); 本研究结果提示bb基因型个体在酒精性肝病患者中所占比例较高, 与Fan et al[8]的研究结果较接近, 可能该基因型的个体暴露于酒精后容易发展酒精性肝病. 原因可能是VDR基因多态性可以影响与1, 25-(OH)2D3结合发挥免疫调节作用[8]; 同时也可以影响免疫反应的强度和类型、影响炎性细胞因子的产生[13,16,19]; Vogel et al认为虽然BsmⅠ位点在第Ⅷ内含子, 但是通过干扰mRNA转录的结合位点, 或者改变内在的调节元件, 他可能影响VDR基因表达, 影响1, 25-(OH)2D3发挥免疫调节作用[11]. 本研究采用了半巢式PCR-RFLP技术, 与以往的检测技术相比, 提高了检测的敏感性和特异性, 减少了假阳性; 与以往的基因多态性研究相比, 用半巢式PCR技术可以提高基因型分析的准确性与可靠性[20].
长期过量饮酒可以引起酒精性肝病. 酒精性肝病在西方国家是导致肝硬化的最主要原因, 在我国是继病毒之后导致肝损伤的第二大原因. 其发病机制尚不清楚, 可能与酒精代谢产物对肝脏的毒性作用、氧化应激、免疫反应、异常的甲硫氨酸循环、内毒素血症、基因多态性, 病毒的协同作用有关. 因此对于酒精性肝病发病机制的研究具有非常重要的现实意义.
迟宝荣, 教授, 吉林大学第一医院消化内科; 倪润洲, 教授, 南通大学附属医院消化内科
对VDR基因多态性的研究最早主要在代谢性疾病研究领域, 目前对VDR基因多态性的研究已经拓展到许多疾病研究领域. 对肝病的研究主要集中在乙型病毒性肝炎研究领域, 并已取得一些成果, 最新报道认为VDR基因多态性与炎症性肠病和乳腺癌之间存在密切关系.
目前研究发现, FokⅠ位点与自身免疫性肝炎存在相关性, BsmⅠ位点与原发性胆汁性肝硬化存在相关性, TaqⅠ和FokⅠ位点多态性与HBV感染结局存在相关性, ApaⅠ位点多态性与肝纤维化存在相关性.
通过对VDR基因多态性与酒精性肝病相关性的研究, 希望能为酒精性肝病防治工作提供一些分子生物学依据.
本文采用半巢式PCR-RFLP技术分析维生素 D受体基因多态性与酒精性肝病相关性, 文题较准确反映了研究工作的科学问题和特定内容, 国内对维生素 D受体基因多态性与酒精性肝病相关性报道较少, 技术路线较为清晰可行, 研究结果明确. 文章的科学性、创新性和可读性较好地反映我国胃肠病学基础研究的先进水平.
编辑: 李军亮 电编:何基才
| 2. | Day CP. Genes or environment to determine alcoholic liver disease and non-alcoholic fatty liver disease. Liver Int. 2006;26:1021-1028. [PubMed] [DOI] |
| 3. | Shimada A, Kanazawa Y, Motohashi Y, Yamada S, Maruyama T, Ikegami H, Awata T, Kawasaki E, Kobayashi T, Nakanishi K. Evidence for association between vitamin D receptor BsmI polymorphism and type 1 diabetes in Japanese. J Autoimmun. 2008;30:207-211. [PubMed] [DOI] |
| 4. | Gunes S, Sumer AP, Keles GC, Kara N, Koprulu H, Bagci H, Bek Y. Analysis of vitamin D receptor gene polymorphisms in patients with chronic periodontitis. Indian J Med Res. 2008;127:58-64. [PubMed] |
| 5. | Chen RH, Chang CT, Chen HY, Chen WC, Tsai CH, Tsai FJ. Association between vitamin-D receptor gene FokI polymorphism and Graves' disease among Taiwanese Chinese. J Clin Lab Anal. 2007;21:173-177. [PubMed] [DOI] |
| 6. | Naito M, Miyaki K, Naito T, Zhang L, Hoshi K, Hara A, Masaki K, Tohyama S, Muramatsu M, Hamajima N. Association between vitamin D receptor gene haplotypes and chronic periodontitis among Japanese men. Int J Med Sci. 2007;4:216-222. [PubMed] |
| 7. | Carlberg C, Seuter S. The vitamin D receptor. Dermatol Clin. 2007;25:515-523, viii. [PubMed] [DOI] |
| 8. | Fan L, Tu X, Zhu Y, Zhou L, Pfeiffer T, Feltens R, Stoecker W, Zhong R. Genetic association of vitamin D receptor polymorphisms with autoimmune hepatitis and primary biliary cirrhosis in the Chinese. J Gastroenterol Hepatol. 2005;20:249-255. [PubMed] [DOI] |
| 10. | 张 红红, 陶 国枢, 高 宇红, 刘 建伟, 吴 青, 牟 小芬, 胡 亚卓, 陈 瑞英, 冷 兴文. 我国四种民族维生素D受体基因多态性 分布的研究. 中国骨质疏松杂志. 2006;12:1-3. |
| 11. | Vogel A, Strassburg CP, Manns MP. Genetic association of vitamin D receptor polymorphisms with primary biliary cirrhosis and autoimmune hepatitis. Hepatology. 2002;35:126-131. [PubMed] [DOI] |
| 12. | Zmuda JM, Cauley JA, Ferrell RE. Molecular epidemiology of vitamin D receptor gene variants. Epidemiol Rev. 2000;22:203-217. [PubMed] |
| 13. | 李 俊红, 李 洪权, 李 卓, 刘 英, 高 冀荣, 曾 宪嘉, 勾 春燕, 朱 席林, 郭 新会, 潘 利. 维生素D受体基因TaqⅠ、FokⅠ单核苷酸多态与HBV感染结局关联探讨. 中华医学杂志. 2006;86:1952-1956. |
| 15. | 李 俊红, 陈 冬梅, 李 卓, 刘 英, 高 冀荣, 曾 宪嘉, 钟 崇芳, 朱 席林, 勾 春燕, 潘 利. 维生素D受体基因多态性与乙型肝炎病毒感染的关联研究. 中华医学遗传学杂志. 2006;23:402-405. |
| 16. | 单 晶, 王 璐, 李 卓, 刘 英, 高 冀蓉, 庞 艳雷, 李 俊红, 庞 福民, 郭 新会, 池 洪治. 维生素D受体基因多态性与乙型肝炎阳性者家庭聚集性关系. 中国医学科学院学报. 2006;28:148-153. |
| 17. | van Etten E, Mathieu C. Immunoregulation by 1,25-dihydroxyvitamin D3: basic concepts. J Steroid Biochem Mol Biol. 2005;97:93-101. [PubMed] [DOI] |
| 18. | 范列英, 仲人前, 屠小卿, 朱烨, 弓长丽, 周琳, 赵智贤, Ralph Feltens, Thomas Pfeiffer. 维生素D受体基因多态性与中国人自身免疫肝病相关性研究. 中华医学杂志. 2003;83:1852-1855. |
| 19. | García D, Angel B, Carrasco E, Albala C, Santos JL, Pérez-Bravo F. VDR polymorphisms influence the immune response in type 1 diabetic children from Santiago, Chile. Diabetes Res Clin Pract. 2007;77:134-140. [PubMed] [DOI] |
| 20. | 蒋 磊, 覃 扬, 孙 芝琳, 孙 泽芳, 王 锦红, 杨 鲁川. 限制性内切酶结合半巢式Pcr法检测人肝癌P16抑癌基因启动子区甲基化研究. 四川大学学报(医学版). 2007;38:53-56. |