修回日期: 2009-01-03
接受日期: 2009-01-05
在线出版日期: 2009-01-28
目的: 探讨核转录因子(NF)-κB在HBV相关肝癌组织中的表达及其临床病理学关系.
方法: 采用免疫组织化学方法, 分别检测35例肝癌灶组及其自身对照的非癌组NF-κB的表达; 以生物素标记的HBV DNA探针检测肝癌组织中HBV DNA, 并分析NF-κB表达与HBV复制及其临床病理学特征之间的关系. 计数资料用Fisher确切概率法处理, 等级资料用秩和检验处理.
结果: NF-κB阳性表达物呈棕黄色颗粒状染色, 癌组织中NF-κB呈点灶状表达, 定位于胞质和细胞核; 而癌周组织NF-κB主要在胞质表达, 细胞核未见阳性表达. 癌组织NF-κB表达强度明显高于癌周组织; 癌组织NF-κB表达阳性率为100%, 癌周组织为68.6%, 二者差异显著(Fisher's exact = 0.000). 肝癌组织中NF-κB的表达强度与肿瘤分化程度、肿瘤数目、肿瘤直径等临床病理学特征无关. HBV DNA阳性肝癌组织中NF-κB比浓度显著高于HBV DNA阴性组(t = 4.7347, P = 0.0000).
结论: 肝癌组织NF-κB过表达与HBV相关肝癌的发生、发展密切相关, 可作为肝癌早期诊断及预后判断的标志.
引文著录: 王以浪, 姚登福, 吴玮, 于洪波, 赛文莉, 钱静, 李姗姗, 卞银珠. 肝癌组织核转录因子-κB表达与HBV复制及其临床病理学特征. 世界华人消化杂志 2009; 17(3): 265-269
Revised: January 3, 2009
Accepted: January 5, 2009
Published online: January 28, 2009
AIM: To investigate the expression of nuclear-transcription factor-κB (NF-κB) in different tissues of hepatocellular carcinoma (HCC) and its correlation with the clinicopathological features of HCC.
METHODS: Immunohistochemistry was used to detect NF-κB expression in 35 HCC tissues and in their corresponding non-cancerous tissues. Liver HBV-DNA was detected by in situ molecular hybridization technique. The relationship between NF-κB expression and HBV replication, and clinical pathological characteristics was analyzed. Fisher's exact test was used to analyze the numeration data, and rank sum test was used to analyze the ranked data.
RESULTS: The positive NF-κB material was brown granule-like stained substance, the NF-κB with dot-nest-like staining was localized in nucleus and cytoplasm in HCC, and only in cytoplasm in its surrounding tissues. Its expression in HCC was well-distributed and stronger than its surrounding tissues. The incidence of NF-κB positive expression was 100% in HCC tissues, and 68.6% in its surrounding tissues, respectively. Significant difference was found between the two groups (Fisher's exact = 0.000). No positive relationship presented itself between NF-κB expression and histological differentiation grading, the number of tumor, the size of tumor or the level of AFP and ALT. The expression level of NF-κB was significantly higher in HBV-DNA-positive HCC group than that in HBV-DNA- negative ones (t = 4.7347, P = 0.000).
CONCLUSION: The overexpression of hepatic NF-κB was closely associated with the occurrence and development of HCC, and it could be a marker for early diagnosis and prognosis of HCC.
- Citation: Wang YL, Yao DF, Wu W, Yu HB, Sai WL, Qian J, Li SS, Bian YZ. Nuclear-transcription factor-κB expression and HBV replication and their clinicopathological features in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 265-269
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/265.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.265
核转录因子-κB(nuclear-transcription factor-κB, NF-κB)是首先在B细胞中发现的一种能与免疫球蛋白κ轻链增强子B区特异性结合的蛋白因子, 后证实其广泛存在于真核细胞内, 能与多种细胞基因启动子或增强子特定位点结合而促进基因转录、表达[1]. 持续肝炎病毒感染导致肝脏慢性炎症是原发性肝癌(hepatocellular carcinoma, HCC)的主要发病背景, 炎症介质和病毒癌基因可使NF-κB异常活化, 活化的NF-κB进入细胞核内调节靶基因表达, 抑制肝细胞凋亡, 促进肝细胞转化, 在肝细胞炎症与癌变间起桥梁作用[2]. 肝癌组织中NF-κB高表达, 其参与癌症的启动、发生及发展过程, 但肝癌中NF-κB表达临床病理学特征尚不清楚[3]. 本研究按自身配对法留取肝癌术后癌灶和癌周组织, 分析了组织中NF-κB表达、胞内分布与HBV DNA复制及其临床病理特征.
于2005-2008年按自身配对法收取南通大学附属医院原发性肝癌患者(男49例, 女16例)术后新鲜肝脏组织, 分别留取肝癌切除后的癌灶组织、癌周组织(距癌灶边缘5 cm)各35份(每份约200 mg), 除部分作组织病理学检查外, 其余组织置-85℃保存备用. 35份标本中肝癌肿块直径≥5 cm有7例, <5 cm有28例(其中<3.0 cm肝癌17例), 肝癌患者年龄范围在35-69岁, 平均年龄50.9±9.8岁. 标本经组织病理学(HE染色)证实其类型均为肝细胞肝癌, 其中高分化、中分化和低分化分别为7例、22例及6例; 肿瘤单发者30例, ≥2个者5例. 所有病例均有完整随访资料, 按全国肝癌防治协作组制定的标准核实诊断.
1.2.1 肝组织匀浆制备和核蛋白提取: 取新鲜肝组织50 mg, 剪成碎片置于经高压灭菌的匀浆器中, 按细胞核蛋白与细胞质蛋白抽提试剂(碧云天生物技术有限公司)使用说明进行核蛋白提取.方法主要为: 加入适当量的组织匀浆液(由细胞质蛋白抽提试剂A、B和PMSF按一定比例配制而成), 冰浴中充分匀浆, 离心后移去上清(部分浆蛋白), 再加入含有PMSF的细胞质蛋白抽提试剂A, 震荡和冰浴后加入试剂B, 再次震荡冰浴, 离心后移上清(浆蛋白), 此时加入含有PMSF的核蛋白提取试剂, 经反复震荡冰浴30 min后, 离心吸取上清(即核蛋白), 置于-85℃冰箱保存备用.
1.2.2 肝组织总RNA制备: 取新鲜肝组织50 mg, 剪成碎片于RNAlater液中, 4℃过夜去除上层液体, 置于经0.1% DEPC水处理的匀浆器中, 加入TRIzol试剂(Gibco, USA)2 mL, 冰上匀浆肝组织后, 吸1.5 mL匀浆液至离心管中, 室温静置3-5 min; 加入氯仿, 激烈振荡混匀; 于4℃ 12 000 r/min, 离心15 min; 小心吸出上层水相于另一离心管中, 加入异丙醇; -20℃沉淀30 min; 4℃ 12 000 r/min, 离心10 min; 小心弃上清; 沉淀中加入750 mL/L乙醇, 4℃ 12 000 r/min, 离心10 min; 重复洗涤1次; 去上清, 稍微晾干, 加入适当体积(30 μL)无核酸酶水, 充分溶解. 在UV2201型紫外分光光度计上测定A260和A280值, 比率在1.9-2.1之间.
1.2.3 肝组织NF-κB定量方法: 肝组织核蛋白以BCA法测定. NF-κB活性测定按Trans AM(Active Motif提供)说明书进行.其方法: 每孔加结合缓冲液30 μL和10 μL细胞核蛋白提取液, 并加细胞溶解液(CLB)20 μL. 阳性对照孔中加2.5 μg Jurkat核提取物并稀释到20 μL CLB中, 空白孔中加CLB液20 μL. 标准孔中依次加20 μL重组蛋白质P50或P65, 封板后置于震荡培养箱中室温孵育1 h. 每孔以洗涤液200 μL洗3次. 然后加入100 μL稀释的NF-κB抗体, 封板后置室温孵育1 h, 再以洗涤液200 μL洗3次. 每孔加100 μL HRP结合的抗体, 封板后置室温震荡1 h, 以洗涤液200 μL洗4次. 每孔加100 μL显色剂, 室温置2-10 min, 加终止液100 μL, 于450 nm处测定其吸光度值(A450), 根据标准曲线计算出蛋白浓度.
1.2.4 肝组织HBV DNA检测: 取肝癌的癌灶及癌旁组织, 经40 g/L中性甲醛固定, 石蜡包埋, 组织切片, 脱蜡水化, 蒸馏水冲洗, 37℃烘干, 蛋白酶K(20 mg/L)室温下消化30 min, 脱水, 37℃烘干, 加生物素标记的HBV DNA探针, 加盖玻片, 加热(95℃)10 min(变性), 37℃过夜, 加蛋白阻断液, 37℃ 5 min, 滴加羊抗鼠生物素IgG, 37℃ 20 min, 37℃的增强洗液冲洗, 甩干; 加羊抗鼠IgG, 37℃ 20 min, 37℃的增强洗液中洗, 甩干; 加入碱性磷酸酶标记的结合物(SAP), 37℃ 20 min, 37℃的增强洗液冲洗, 甩干; 加入BCIP/NBT染色, 蒸馏水冲洗, 复染封片.
1.2.5 免疫组织化学分析NF-κB(SP法): 兔抗人NF-κB多克隆抗体及S-P免疫组化试剂盒均购自武汉博士德生物工程有限公司. 新鲜肝组织以40 g/L中性甲醛固定, 石蜡包埋, 制成厚度4 μm的组织切片. 按常规脱蜡、水化; 双氧水阻断内源性过氧化物酶; 高压加热法修复抗原; 正常动物血清封闭非特异性结合; 滴加NF-κB抗体, 4℃过夜, 磷酸盐缓冲液(PBS)漂洗; 滴加生物素标记的第二抗体, 室温孵育10 min, PBS漂洗; 滴加链霉素抗生物素蛋白-过氧化酶, 室温10 min, PBS冲洗; 滴加新鲜配制的四盐酸二氨基联苯胺(DAB)溶液, 显色, 水洗; 复染. 透明、封片. Olympus BX 50光学显微镜观察、摄像. 以0.01 mol/L PBS液(pH = 7.5)分别替代一抗、二抗和SP试剂作阴性对照, 已知表达NF-κB的肝癌组织作阳性对照. NF-κB表达强度, 以阳性细胞数≥10%作为阳性判断标准, 进而根据阳性细胞百分率分为NF-κB表达弱阳性(+): 阳性细胞数为10%-25%; NF-κB表达阳性(++): 阳性细胞数为26%-75%; NF-κB表达强阳性(+++): 阳性细胞数>75%.
统计学处理 人肝癌组织分为癌灶组与自身对照的癌周组进行比较.以Stata7.0统计软件进行分析, 计数资料用Fisher确切概率法分析和处理, 等级资料用秩和检验分析和处理, 以P<0.05表示差异具有显著性.
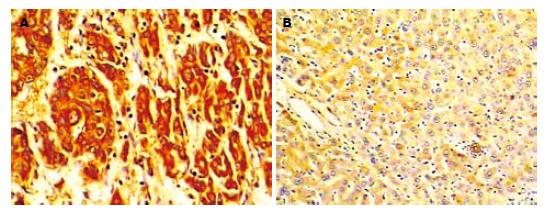
肝癌及癌周组织中NF-κB阳性表达呈棕黄色. 癌组织NF-κB表达呈巢状分布, 深染, 胞质和胞核均阳性; 而对应的癌周组织NF-κB表达主要定位于胞质, 胞核无明显阳性着色(图1). 癌组织中NF-κB全数表达, 且强度明显高于癌周组织.肝癌组与癌周组间, 其表达阳性率(Fisher's exact = 0.000)和表达强度(U = 4.373, P<0.01)均存在明显差异.肝癌组的肝NF-κB比浓度为69.3±40.2 ng/g肝组织, 癌周组为21.0±17.2 ng/g肝组织, 肝癌组比癌周组大约高3倍(t = 6.04, P<0.01).
肝癌组织中NF-κB表达的病理学特征分析见表1. 癌组织NF-κB全数阳性, 其强度与肿瘤的分化程度、数目和大小、AFP以及ALT水平间的关系经秩和检验均未见明显的统计学差异.
癌旁组织NF-κB表达与癌灶组织相比, 表达强度低, 有近1/3组织中未见阳性表达(表2). 癌旁组织中NF-κB阳性率为68.6%(24/35), 其表达阳性率和表达强度与分化程度、肿瘤数目与直径、AFP及ALT水平间, 经确切概率法和秩和检验分析同样未见明显的统计学差异.
| 分组 | n | NF-κB表达 | NF-κB表达强度 | U值 | P值 | ||||
| 阳性(%) | Fisher值 | - | + | ++ | +++ | ||||
| 分化程度 | |||||||||
| 高 | 7 | 7(100) | 0 | 4 | 3 | 0 | |||
| 中 | 22 | 14(63.6) | 0.045 | 8 | 3 | 7 | 4 | 0.204 | >0.05a |
| 低 | 6 | 3(50.0) | 0.155 | 3 | 1 | 2 | 0 | 0.819 | >0.05a |
| 肿瘤数目 | |||||||||
| 单发 | 30 | 20(66.7) | 10 | 6 | 10 | 4 | |||
| 多发 | 5 | 4(80.0) | 0.774 | 1 | 2 | 2 | 0 | 0.024 | >0.05 |
| 肿瘤直径(cm) | |||||||||
| >5 | 7 | 4(57.1) | 3 | 2 | 1 | 1 | |||
| <5 | 28 | 20(71.4) | 0.651 | 8 | 6 | 11 | 3 | 0.722 | >0.05 |
| AFP(μg/L) | |||||||||
| >400 | 12 | 9(75.0) | 3 | 3 | 6 | 1 | |||
| <400 | 23 | 15(69.6) | 0.424 | 8 | 4 | 7 | 3 | 1.044 | >0.05 |
| ALT(U/L) | |||||||||
| >50 | 11 | 9(81.8) | 2 | 4 | 5 | 0 | |||
| <50 | 24 | 15(62.5) | 0.230 | 9 | 3 | 8 | 4 | 0.018 | >0.05 |
肝癌组织HBV复制与NF-κB表达关系分析见表3. 肝癌组织中均有NF-κB表达, 但在HBV DNA阳性组和阴性组间, 癌组织NF-κB比浓度(ng/g肝)明显高于癌周组织; NF-κB表达强度也存在明显差异, 癌组织显著增强. HBV DNA阳性组23例中, 其表达强度均在中等阳性表达以上, 其中强阳性表达为主(78.3%); HBV DNA阴性组12例阳性中, 其表达强度以中等阳性表达为主, 未见强阳性表达病例.
NF-κB是一种具有广泛生物活性的核转录因子, 作为细胞内信号传递的一个枢纽参与多种生理过程的调控, 其表达异常会导致机体的多种病理改变. 当细胞处于静息状态时, NF-κB主要位于胞质中, 与NF-κB抑制蛋白(IκB)家族成员结合, 形成无活性的三聚体. 当其受到细胞因子、有丝分裂原、病毒等刺激后, IκBα通过磷酸化、泛素化降解, 使NF-κB的核定位信号暴露, 引导NF-κB进入到细胞核内, 活化的NF-κB与靶基因顺式调节元件上的κB位点上特异序列结合而诱导相关基因的转录, 进而发挥抑制细胞凋亡、诱导细胞恶性转化、促进肿瘤侵袭转移和对化学药物耐药等作用[4]. 本研究分析了人HCC及配对癌周组织中NF-κB的表达特点、胞内定位、比浓度及临床病理特征.
HCC发生发展具多病因、多中心和多阶段特征[5]. 我国HCC患者中90%伴HBV感染, HBV或HCV持续感染, 引起肝细胞长期慢性炎症, 使肝脏损伤和肝硬化, 而易罹患HCC[6-8]. 研究表明炎症相关性HCC形成过程中涉及多种基因表达改变、众多信号通路异常激活, NF-κB信号通路是其中重要一环[9-13]. 其上调炎症反应介质如TNF-α, 化学因子和白介素的表达, 而炎症介质和化学因子又可以进一步激活NF-κB, 形成正反馈放大机制, 进而选择性促进癌前病变细胞的存活, 致使肝细胞基因损伤不断积累而向恶性表型转化[14-15]. 研究发现NF-κB表达阳性率在癌组织明显高于癌周组织, 且阳性强度亦明显高于癌周组织; 肝癌细胞中NF-κB的mRNA表达量明显比正常肝细胞高, 表明NF-κB与HCC形成密切相关.
HBV的X基因编码的X蛋白在HBV相关HCC的形成过程中起了重要作用[16-18]. 有研究报道X蛋白与NF-κB在细胞内定位有关, X蛋白对NF-κB的激活可能是HBV感染诱发HCC的主要原因之一[19]. 本研究对HBV相关HCC的NF-κB表达定位分析发现, NF-κB在HCC的胞核内有点灶状阳性表达, 而癌周组织未发现有胞核内表达, 提示NF-κB是被激活后进入胞核内发挥其转录活性, 从而参与HCC的发生发展. HBV DNA是病毒复制和传染性的直接标志, 其测定为判断HBV复制、传染性大小、抗病毒药物疗效、病情变化和预后、调整抗病毒药物剂量、确定疗程提供可靠依据.在本组资料中NF-κB表达在HBV DNA阳性与阴性组间差别十分明显, 提示HBV复制与NF-κB表达明显相关.在与HBsAg之间, 显示HBsAg阳性病例癌组织与癌周组织NF-κB强度均有高于HBsAg阴性病例趋势, 但在统计学上未见有明显差异.
对照临床资料分析发现在HCC中NF-κB阳性及强度与分化程度、肿瘤数目和大小以及患者AFP和ALT水平间均未见统计学差异, 提示NF-κB异常激活可能是HCC形成的早期分子事件, 这有助于HCC的早期诊断、治疗. 对诱导大鼠肝癌模型研究也观察到NF-κB在诱癌早期即有过表达, 且随着肝细胞变性、癌前病变和癌变表达逐渐增强. 用NF-κB抑制剂喂饲大鼠后, NF-κB表达明显下调, 且肝脏病变程度明显变轻.
总之, NF-κB信号通路异常激活与HBV相关性HCC形成密切相关, 靶向NF-κB信号通路的基因治疗可在多途径、多位点阻止HCC的发生、发展及进展.
HCC是全球最常见的恶性肿瘤之一, 每年有50余万新发病例, 其中一半在中国. HCC发生发展具多病因、多中心和多阶段特征, 肝炎病毒感染引起肝脏慢性炎症是其主要发病背景.
谭学瑞, 教授, 汕大医学院第一附属医院院长室.
NF-κB是一种具有广泛生物活性的核转录因子, 作为细胞内信号传递的一个枢纽参与了多种肿瘤的形成, 在慢性炎症所致的HCC中起了桥梁作用, NF-κB信号通路近年来已成为HCC防治的研究热点.
Beg et al报道HBV X基因编码的X蛋与NF-κB在细胞内定位有关, 其激活肝细胞中NF-κB信号途径的上游激酶, 通过激酶的级联反应, 使IκBα磷酸化并降解, 细胞质中解离的NF-κB移位入核内使转录功能, X蛋白对NF-κB的激活可能是HBV感染诱发HCC的主要原因之一.
对于NF-κB在HCC形成中的作用机制多集中在细胞水平, 本实验研究了NF-κB在人肝癌组 织中表达特点、细胞内分布、与肝癌相关临床病理特征以及HBV DNA复制关系, 尚少见报道.
NF-κB信号通路是HCC形成机制中的重要一环, 可以成为HCC基因治疗的有力靶点.
本文立题明确, 方法可靠, 层次清晰, 讨论简洁且重点突出切题, 具有较好的科学价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Karin M. Nuclear factor-kappaB in cancer development and progression. Nature. 2006;441:431-436. [PubMed] [DOI] |
| 2. | Li Q, Withoff S, Verma IM. Inflammation-associated cancer: NF-kappaB is the lynchpin. Trends Immunol. 2005;26:318-325. [PubMed] [DOI] |
| 4. | Moynagh PN. The NF-kappaB pathway. J Cell Sci. 2005;118:4589-4592. [PubMed] [DOI] |
| 5. | Peto J. Cancer epidemiology in the last century and the next decade. Nature. 2001;411:390-395. [PubMed] [DOI] |
| 6. | Thorgeirsson SS, Grisham JW. Molecular pathogenesis of human hepatocellular carcinoma. Nat Genet. 2002;31:339-346. [PubMed] [DOI] |
| 7. | Raza SA, Clifford GM, Franceschi S. Worldwide variation in the relative importance of hepatitis B and hepatitis C viruses in hepatocellular carcinoma: a systematic review. Br J Cancer. 2007;96:1127-1134. [PubMed] [DOI] |
| 8. | Orito E, Mizokami M. Hepatitis B virus genotypes and hepatocellular carcinoma in Japan. Intervirology. 2003;46:408-412. [PubMed] [DOI] |
| 9. | Yao D, Jiang D, Huang Z, Lu J, Tao Q, Yu Z, Meng X. Abnormal expression of hepatoma specific gamma-glutamyl transferase and alteration of gamma-glutamyl transferase gene methylation status in patients with hepatocellular carcinoma. Cancer. 2000;88:761-769. [PubMed] [DOI] |
| 10. | Yao DF, Wu XH, Zhu Y, Shi GS, Dong ZZ, Yao DB, Wu W, Qiu LW, Meng XY. Quantitative analysis of vascular endothelial growth factor, microvascular density and their clinicopathologic features in human hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2005;4:220-226. [PubMed] |
| 11. | Dong ZZ, Yao DF, Yao DB, Wu XH, Wu W, Qiu LW, Jiang DR, Zhu JH, Meng XY. Expression and alteration of insulin-like growth factor II-messenger RNA in hepatoma tissues and peripheral blood of patients with hepatocellular carcinoma. World J Gastroenterol. 2005;11:4655-4660. [PubMed] |
| 14. | 董 志珍, 姚 登福, 苏 小琴, 姚 敏, 吴 信华, 邱 历伟, 吴 玮. 肝癌形成过程中基因表达谱及转录核因子-κB动态改变. 胃肠病学和肝病学杂志. 2007;16:580-584. |
| 15. | Karin M, Greten FR. NF-kappaB: linking inflammation and immunity to cancer development and progression. Nat Rev Immunol. 2005;5:749-759. [PubMed] [DOI] |
| 16. | Kim DG. Differentially expressed genes associated with hepatitis B virus HBx and MHBs protein function in hepatocellular carcinoma. Methods Mol Biol. 2006;317:141-155. [PubMed] |
| 17. | Zhang X, Zhang H, Ye L. Effects of hepatitis B virus X protein on the development of liver cancer. J Lab Clin Med. 2006;147:58-66. [PubMed] [DOI] |
| 18. | Chan DW, Ng IO. Knock-down of hepatitis B virus X protein reduces the tumorigenicity of hepatocellular carcinoma cells. J Pathol. 2006;208:372-380. [PubMed] [DOI] |
| 19. | Wang T, Wang Y, Wu MC, Guan XY, Yin ZF. Activating mechanism of transcriptor NF-kappaB regulated by hepatitis B virus X protein in hepatocellular carcinoma. World J Gastroenterol. 2004;10:356-360. [PubMed] |