修回日期: 2009-01-04
接受日期: 2009-01-05
在线出版日期: 2009-01-28
绿茶的主要成分之一茶多酚由多种儿茶素组成, 其中没食子儿茶素没食子酸酯(EGCG)含量最多. 大量研究表明, 绿茶的抗肿瘤作用主要与该分子有关. EGCG具有强烈的抗肿瘤作用, 其机制复杂, 如抑制细胞分裂、诱导细胞凋亡、抑制血管生成等等. 最近又发现了很多新的机制, 如EGCG对67 kDa层黏连蛋白受体及AKT信号传导系统的作用等. EGCG抗肿瘤作用机制正逐渐变得清晰起来. 本文综合了最新的发现和已证实的研究结论, 对EGCG抗肿瘤机制作一综述, 期待可以为新一代化疗药物的进一步深入研究提供依据.
引文著录: 崔云甫, 石林, 秦虹, 刘适. 茶多酚没食子儿茶素没食子酸酯抗肿瘤机制研究进展. 世界华人消化杂志 2009; 17(3): 229-235
Revised: January 4, 2009
Accepted: January 5, 2009
Published online: January 28, 2009
Green tea is a worldwide popular beverage, which is found to have a broad anticancer activity. Polyphenol, one of the major constituents of green tea, is composed of catechins, mainly (-)-epigallocatechin-3-gallate (EGCG). It is known anticancer effects of green tea are associated with this component. It has been well established that EGCG has strong anticancer effects. Studies have shown that the mechanisms through which EGCG exerts its anticarcinogenesis potential are very complex, such as cell division, apoptosis induction, angiogenesis inhibition, and so on. Recently, many new findings have been reported, like the action on 67 kDa Laminin receptors and AKT signaling pathway, which are not well covered by the previous researches. The mechanisms of its anticancer effects are becoming clear. In this paper we mainly discussed the mechanisms of anticancer effects of EGCG, based on the latest findings and proved conclusions, in hope of providing rationale for future cancer managements and giving enlightenment to the design of next-generation chemotherapeutics.
- Citation: Cui YF, Shi L, Qin H, Liu S. Research progress in mechanisms of the anticancer effects of green tea polyphenol (-)-epigallocatechin-3-gallate. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 229-235
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.229
绿茶是一种世界性流行的保健饮料, 近年来发现其具有较强的抗肿瘤作用. 为了全面了解绿茶的抗肿瘤作用, 我们查阅了大量茶多酚抗肿瘤方面的相关文献, 对绿茶多酚类物质的抗肿 瘤机制作一综述, 期待可以为肿瘤的药物治疗提供理论基础, 为新一代化疗药物的开发提供帮助.
通常生物体内细胞膜上的受体分子与细胞外配体结合, 其细胞内部分会发生构象的改变, 从而产生蛋白激酶的活性, 并使其下游分子磷酸化或去磷酸化, 将细胞外信号传至细胞内, 进而影响基因表达和蛋白合成. 受体、蛋白激酶、磷酸酶及细胞核内转录因子等多个层面的分子组成了复杂的细胞信号网络. 在这个网络中, 任何一个环节出现问题都有可能导致细胞信号的改变, 使细胞发生恶变[1]. 因此, 通过作用于细胞信号通路抑制细胞过度生长的药物必然具有强大的抗肿瘤作用[2]. 肿瘤的分子靶向化学治疗是指能特异性识别癌细胞的某一个分子而发挥针对性抗肿瘤作用的药物治疗方法. 靶向化疗凭借其特异性、非细胞毒性、有效性和毒副反应低、耐受性高的特点, 在肿瘤的治疗中取得了很大的成功. 各种能与细胞信号传导系统上的关键分子结合并发挥特异性抗肿瘤作用的药物已成为目前国内外肿瘤治疗研究的热点. 很多新一代分子靶向化疗药物已快速通过FDA的检验并上市应用, 但这些药物大多只针对几种肿瘤, 或者只对某个阶段的肿瘤有效, 因此仍有很大局限性. 目前学术界正致力于寻找广谱对抗肿瘤多个发展阶段的分子靶向化疗药物.
绿茶是一种世界性流行的保健饮料. 绿茶的主要成分之一茶多酚由多种儿茶素组成, 其中EGCG含量最多[3-5]. 众多研究证实, 绿茶的抗肿瘤作用主要与该分子有关[6-7], 其相关的作用机制包括诱导细胞凋亡、抑制细胞增殖以及抑制肿瘤血管生成等[8-11], 体外实验已证明绿茶对多种肿瘤均有疗效[12-17]. 最新研究显示, EGCG对人源肿瘤细胞也有明显抑制作用. Ravindranath et al报道, EGCG有明显抑制人黑色素瘤细胞生长的作用[18]. 此外, EGCG在动物实验及流行病学实验中也表现出明显抑制肿瘤发生和发展的作用. Imai et al进行的对384名肿瘤患者进行研究, 发现大量服用绿茶的患者肿瘤发生时间明显推迟[19]. 在472名一期或二期肿瘤患者中, 服用绿茶较多的患者复发率明显较低[20]. 另外, Neukam et al用进行的实验证明, EGCG处理CWR22R裸鼠抑制了其非雄激素依赖性前列腺癌的生长, 该现象与血清前列腺特异抗原(PSA)水平、肿瘤血管生成以及凋亡率上升呈正相关, 且没有相关副作用发生[21]. 可见, 绿茶及EGCG对肿瘤的发生、发展和复发均有抑制作用. 因此EGCG是一种广谱抗肿瘤分子, 并具有分子靶向化疗药物的特点.
肿瘤细胞中EGCG发挥作用的信号通路比他的抗肿瘤作用要复杂得多, 涉及到受体、下游蛋白激酶和磷酸酶、核转录因子等诸多环节. 细胞表面的受体与细胞外液中EGCG结合后, 激活一系列下游蛋白激酶和磷酸酶, 最后激活特殊的功能基因转录, 合成抑制增殖和促进凋亡的蛋白, 从而发挥抗肿瘤作用. 目前尚无关于EGCG本身穿过细胞膜直接与细胞膜内相关分子结合的报道.
多年来研究人员一直在寻找EGCG的受体. 近期研究证实, EGCG能与一种分子质量为67 kDa的层黏连蛋白受体(67LR)结合, 这是一种癌转移相关蛋白, 在多种肿瘤组织中都有表达. EGCG是唯一能与67LR结合的儿茶素. 维甲酸能增强EGCG与67LR的结合[22]. 67LR可与层黏连蛋白相互作用发生磷酸酶激酶级联反应, 诱导层黏连蛋白的降解, 进而导致肿瘤细胞的转移. 在细胞表面, 67LR与整联蛋白α6亚基相连, 后者是层黏连整联蛋白α6β4和α6β1的一部分[23]. 近期研究显示, 存在着两种α6亚基, α6A和α6B, 他们都在A375SM黑色素瘤细胞中表达. 67LR的减少能很明显的下调α6B亚基的表达, 而不会下调α6A亚基, 这提示67LR与α6B亚基可能有共同调节关系. 最新研究表明, 在EGCG-67LR信号通路中包含了肽链延长因子(eEF1A)和肌球蛋白磷酸酶(MYPT1). 体外实验显示, 肿瘤细胞中67LR、eEF1A或MYPT1的沉默使EGCG诱导的肿瘤生长抑制作用消失, 提示由67LR、eEF1A和MYPT1介导的EGCG信号传导, 在EGCG抗肿瘤作用中是必不可少的[24-25]. 同时有证据显示在人黑色素瘤细胞转移过程中, 丝裂原激活蛋白激酶(MAPK)和二元特异性磷酸酶是层黏连蛋白信号途径的重要分子[26].
然而, 对于EGCG受体, 有学者提出了不同观点. Adachi et al认为, EGCG可能并不直接作用于细胞表面的受体. 他们通过荧光标记等技术研究发现经EGCG处理后细胞表面的表皮生长因子(EGFR)转移到细胞质中的内涵体中, 即内化作用, 进而使生长信号阻断[27].
2.2.1 生长抑制作用和凋亡诱导作用: 很多研究证实, EGCG的细胞生长抑制和凋亡诱导作用是一个多靶点多途径共同参与的过程[28]. EGCG作用于细胞后, 通过直接和间接方式, 作用于许多与细胞周期进程相关的因子, 导致细胞生长促进通路阻断和生长抑制通路激活, 进而使细胞生长停滞. 另一方面, EGCG激活凋亡通路, 促进肿瘤细胞凋亡.
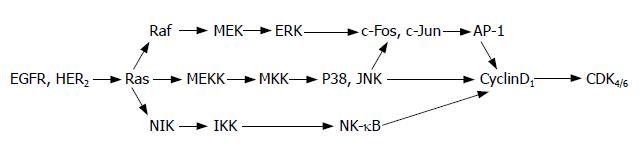
2.2.2 抑制MAPK通路: EGFR是一种细胞膜上的糖蛋白受体, 是表皮生长因子的受体. EGFR与表皮生长因子结合后, 其胞内部分会发生构象改变并表现出酪氨酸激酶的活性, 并磷酸化下游分子, 从而激活细胞生长信号通路, 其中包括MAPK通路. 在哺乳动物细胞中最重要的MAPK包括细胞外信号调节蛋白激酶(ERK), P38 MAPK, 和Jun氨基末端激酶(JNK). MAPK通路如图1所示. 这些MAPK的亚族在许多生理过程中均起着不同的作用, 包括影响细胞增殖, 分化和死亡. 有研究证实, 过表达的EGFR和高活性的MAPK信号通路, 是很多肿瘤形成的主要机制之一[29]. 研究表明, EGCG对不同组织的MAPK通道可能存在不同的效应. 有报道称在JB6小鼠表皮肿瘤细胞系中, EGCG能通过使ERK等分子磷酸化而抑制MAPK通路[30-31]. 而其他学者发现正常人表皮细胞在紫外线照射之前用EGCG处理后, ERK1/2、JNK和P38蛋白的磷酸化形式下降, 进而使紫外线诱导的表皮损伤减轻[32]. 在人类癌克隆细胞ECE16-1、HeLa、Caski和SiHa细胞中, EGCG能抑制MAPK通路和AP-1的活性[33-34]. 此外, Koichi et al指出, 在凋亡过程中, EGCG激活了JNK和P38 MAPK介导的凋亡通路[35]. 在3T3-L1前脂肪细胞中, EGCG抑制ERK活性, 但不抑制JNK和P38 MAPK[36]. 以上结果表明, 对不同的组织, EGCG对MAPK通路的作用并不完全一致, 有时甚至相反. 需要进一步大规模实验来对上述结论加以证实.
2.2.3 抑制NF-κB通路: 核转录因子NF-κB是一种氧化应激转录因子, 参与调节多种重要生理过程, 包括炎症、免疫、生长和细胞死亡. 据报道在乳腺癌组织中存在着NF-κB的多种亚基被异常激活的情况[37-38]. 通常, NF-κB在胞质中与IκB处于结合状态, 此时NF-κB无活性. 磷酸化的IκB与NF-κB解离, 从而使NF-κB可以移动到核内并影响基因表达. 在人表皮角化细胞中, EGCG可抑制紫外线诱导的NF-κB的激活, 这可能是EGCG抗氧化损伤作用的机制之一[32]. 在预后较差的人结肠癌细胞中, EGCG可抑制NF-κB级联反应, 进而抑制结肠癌细胞生长[34]. 可见, EGCG对NF-κB的抑制可能是EGCG抗肿瘤作用的一条重要机制.
2.2.4 抑制AKT/蛋白激酶B(PKB)信号通路: AKT/PKB信号通路也是细胞内一条重要的信号通路, 与细胞生长, 凋亡, 以及细胞内糖脂代谢及血管生成等重要生理过程密切相关. 磷酸肌醇三激酶(PI3K)是EGFR细胞内部分的下游分子, EGFR激活后, PI3K随后活化, 并进一步磷酸化激活AKT. 磷酸化的AKT直接或间接参与许多生理和病理过程[39]. EGCG抑制了EGFR依赖的AKT激活过程, 并且导致凋亡诱导过程中重要蛋白的磷酸化形式比例改变, 如Forkhead家族和BAD家族等, 这可能是细胞周期停滞以及发生凋亡的关键因素[33].
2.2.5 抑制细胞周期蛋白依赖性蛋白激酶(CDK)和细胞周期蛋白: 在CDK-细胞周期蛋白复合体中, CDK是催化亚基, 细胞周期蛋白是调节亚基. CDK和细胞周期蛋白是细胞周期必不可少的因子, 直接调控细胞周期. 研究发现EGCG可下调细胞周期蛋白D1和Rb, 并抑制CDK[36], 这被认为是导致细胞周期多种负性调节的主要事件[39]. 最近, 研究者发现EGCG诱导的ERK和AKT活性下降与P53, P21WAF-1和P27KIP-1水平升高有相关性, 同时细胞周期蛋白E与CDK2活性的降低也有相同的下降趋势[33,40]. 因此可以推测EGCG可能通过直接或间接的方式作用于细胞核内增殖相关分子, 并影响他们的活性.
2.2.6 抑制DNA甲基转移酶, 端粒酶和拓扑异构酶: 有研究证明EGCG能明显抑制肿瘤细胞系中DNA甲基转移酶的活性, 从而抑制肿瘤的生长[41]. 此外, 一些细胞实验和动物实验显示, EGCG抗肿瘤作用与其对肿瘤相关端粒酶的封闭作用直接相关[42-43]. Bandele et al进行的实验表明, EGCG通过与拓扑异构酶共价结合使其改变构象, 进而表现出氧化还原反应依赖性拓扑异构酶毒性, 与1, 4-苯醌的作用机制相似. 作者认为这是EGCG抗癌的重要机制[21,44]. 然而, 这些结论还有待进一步大规模随机实验的证明.
2.2.7 EGCG对Wnt和Id通路的影响: 不久前, Liu和Sartippour et al通过基因芯片技术及real-timePCR技术检测了EGCG对VEGF刺激的血管内皮的调节作用. 他们发现共有421基因上调, 72基因下调, 他们还发现Wnt和Id通路在EGCG依赖性细胞生长抑制中有重要作用, 并证明抗血管生成的作用来自于EGCG对生长因子刺激下血管内皮细胞增殖的广泛抑制作用. 他们认为, EGCG抗肿瘤作用是由其对细胞增殖相关基因的调控实现的[45-46]. 目前, 关于EGCG对这两条通路的研究报道较少, 但这两条通路在EGCG生物活性中发挥的作用值得关注.
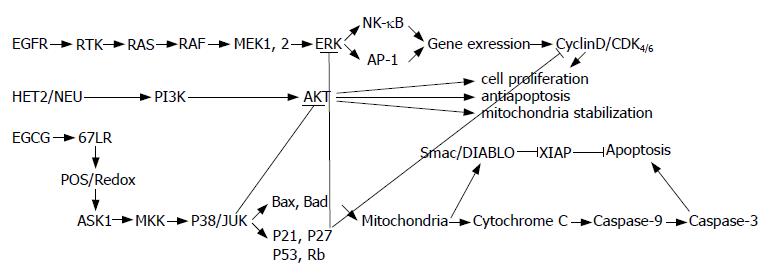
2.2.8 诱导细胞凋亡: 凋亡, 可用于清除不应该继续存在的细胞, 是一种由细胞内凋亡系统精细调控的生理性保护机制, 以前称作程序性细胞死亡, 用于清除不应该继续存在的细胞. 大量实验已证明EGCG可以诱导肿瘤细胞凋亡, 其机制涉及Bax寡聚化, Bcl-2减少, 线粒体膜的去极化, 细胞色素C的释放和激活等[47-49]. 此外, EGCG的促凋亡作用并不影响正常细胞[9]. 最新研究表明, EGCG可以通过增加过氧化物H2O2的产生促进凋亡[39,50-51]. Koichi et al发现EGCG可通过N-乙酰末端敏感的细胞内氧化事件激活ASK1, MKK及JNK/P38 MAPK凋亡途径, 进而诱发细胞凋亡, 其与化学和受体介导的凋亡为不同凋亡途径[35]. 可见, EGCG介导的凋亡有可能是通过激活细胞内氧化应激通路的关键分子, 如活性氧、H2O2等, 这些分子进一步激活下游ASK1, MKK及JNK/P38, 通过一系列复杂的细胞内反应完成凋亡的诱导[47], 使线粒体去极化释放细胞色素C, 进而诱导凋亡[52]. 然而, Jerome et al发现EGCG不影响表皮生长因子受体依赖的JNK激活过程[33]. Khan et al发现EGCG可下调ERK, p38和JNK的含量, 进而抑制MAPK通路[39]. 此外, 本实验室目前有研究证明EGCG对胰腺癌Panc-1细胞有促凋亡作用, 在这个过程中, EGCG对Akt通路的抑制发挥了重要作用. 不久前Raza et al报道, 体外实验证明EGCG改变了活性氧、谷胱甘肽、脂质过氧化反应和蛋白氧化的发生情况, 同时改变了细胞的氧化还原反应, 他们还发现EGCG处理后细胞出现DNA裂解和凋亡标志物如细胞色素C、Caspase-3等的激活[53-57]. 由此可见, EGCG促凋亡的具体机制十分复杂, 涉及细胞内多个信号传导通路, 具体机制仍有待进一步研究(图2).
当前EGCG抗肿瘤作用的动物实验和临床试验正在国内外很多实验室逐渐展开. 动物实验方面, 很多研究结果证实, 针对不同组织, 如肺、胃、结肠、肝、皮肤等, EGCG处理组动物的肿瘤发生率和复发率比对照组明显降低[58-59]. Mantena et al提出, EGCG处理的动物患紫外线诱导的表皮损伤及皮肤癌比例较低[60-61]. 临床研究方面, 不久前EGCG应用于人体的一期和二期临床试验也开始进行[62-63], 目前未有相关研究结果的报道.
可以特异性抑制生长失控细胞继续繁殖甚至清除这种细胞的药物目前受到学术界普遍关注. 如前所述, EGCG就是这样的一种很有潜在开发价值的药物. 很多流行病学实验、细胞实验、动物实验以及临床研究都证实EGCG具有广谱对抗肿瘤生成、转移的作用[64]. EGCG可直接作用于细胞增殖和凋亡等多个水平, 并可影响肿瘤血管生成. 具体机制十分复杂, 涉及到细胞内几乎所有增殖相关通路, 如生长因子通路、MAPK依赖通路、Akt信号通路和泛素/蛋白体降解通路等[65-68]. 很多实验结论甚至互相矛盾. 如前文所述, 有的实验证明EGCG通过激活MAPK依赖性通路而发挥作用, 还有的研究人员认为EGCG对该通路的直接作用是抑制. 有的研究发现EGCG可以直接封闭Akt酶的活性, 相反也有人认为EGCG是通过作用于其上游的蛋白而发挥抑制作用. 虽然当前学者们对其确切机制仍莫衷一是, 但正是其复杂的作用方式使EGCG具有广谱的多方面的抗肿瘤作用. 目前关于EGCG仍然有许多方面需要进行进一步研究. 首先日常生活对茶的饮用量虽然很大, 但这种摄入方式所带来的茶多酚EGCG血液浓度并不能达到离体实验中的浓度, 因此这个浓度EGCG对人体的作用是否与细胞实验所得结论一致值得关注. 整体情况下机体的自我调节机制会对EGCG的作用产生何种影响也未见报道. 在动物体内, 非常有可能出现EGCG的作用被机体免疫系统或内分泌系统弱化甚至抵消的情况. 此外, 目前报道的动物实验和临床研究结果都来自小规模单中心的实验. 因此, 未来研究应注重大规模动物实验及随机双盲临床研究, 以进一步研究并验证EGCG的抗肿瘤作用, 以期为癌症的化学治疗提供足够的理论依据, 为未来新一代化疗药物的研发打下基础.
绿茶是一种世界性饮料, 研究发现其具有生物多效性, 如抗氧化、抗高脂血症及提升机体免疫力等作用, 因此受到世界广泛关注. 绿茶主要成分茶多酚由多种儿茶素组成, 其中没食子儿茶素没食子酸酯(EGCG)含量最多. 已证明, 绿茶的上述生物活性大多来自EGCG.
许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科.
目前有多家大型实验室正通过细胞实验和动物实验对茶多酚EGCG进行抗肿瘤、抗氧化等方面的研究, 研究重点主要集中在分子机制等方面. 据报道, 相关的大规模随机临床研究正在进行, 以了解EGCG作为抗肿瘤药物的可能性和治疗效果.
Naghma et al对EGCG抗肿瘤作用的机制进行了详细论述, 包括对细胞传导通路的作用、抗肿瘤血管生成作用以及抗肿瘤转移的作用等方面.
本文综合了已被证实的观点和最新研究发现, 对EGCG抗肿瘤及诱导凋亡作用的机制进行了详细综述.
全面了解EGCG的抗肿瘤机制, 有助于为新一代靶向抗癌药物的研发提供理论基础.
分子靶向化学治疗: 指能特异性识别癌细胞的某一个分子而发挥针对性抗肿瘤作用的药物治疗方法.
本文从肿瘤细胞信号传导通路多方面综述了茶多酚没食子儿茶素没食子酸酯(EGCG)在抑制肿瘤生长、诱导肿瘤细胞凋亡方面的作用机制. 对人们了解EGCG及EGCG在肿瘤领域应用的深入研究有一定的帮助.
编辑: 史景红 电编:吴鹏朕
| 1. | Brown MS, Goldstein JL. Sterol regulatory element binding proteins (SREBPs): controllers of lipid synthesis and cellular uptake. Nutr Rev. 1998;56:S1-S3; discussion S54-S75. [PubMed] |
| 2. | Mukhtar H, Ahmad N. Cancer chemoprevention: future holds in multiple agents. Toxicol Appl Pharmacol. 1999;158:207-210. [PubMed] [DOI] |
| 3. | Mukhtar H, Ahmad N. Tea polyphenols: prevention of cancer and optimizing health. Am J Clin Nutr. 2000;71:1698S-1702S; discussion 1703S-1704S. [PubMed] |
| 4. | Cheynier V. Polyphenols in foods are more complex than often thought. Am J Clin Nutr. 2005;81:223S-229S. [PubMed] |
| 5. | Graham HN. Green tea composition, consumption, and polyphenol chemistry. Prev Med. 1992;21:334-350. [PubMed] [DOI] |
| 6. | Katiyar SK, Afaq F, Azizuddin K, Mukhtar H. Inhibition of UVB-induced oxidative stress-mediated phosphorylation of mitogen-activated protein kinase signaling pathways in cultured human epidermal keratinocytes by green tea polyphenol (-)-epigallocatechin-3-gallate. Toxicol Appl Pharmacol. 2001;176:110-117. [PubMed] [DOI] |
| 7. | Conney AH, Lu Y, Lou Y, Xie J, Huang M. Inhibitory effect of green and black tea on tumor growth. Proc Soc Exp Biol Med. 1999;220:229-233. [PubMed] [DOI] |
| 8. | Adhami VM, Ahmad N, Mukhtar H. Molecular targets for green tea in prostate cancer prevention. J Nutr. 2003;133:2417S-2424S. [PubMed] |
| 9. | Ahmad N, Feyes DK, Nieminen AL, Agarwal R, Mukhtar H. Green tea constituent epigallocatechin-3-gallate and induction of apoptosis and cell cycle arrest in human carcinoma cells. J Natl Cancer Inst. 1997;89:1881-1886. [PubMed] [DOI] |
| 10. | Ju J, Lu G, Lambert JD, Yang CS. Inhibition of carcinogenesis by tea constituents. Semin Cancer Biol. 2007;17:395-402. [PubMed] [DOI] |
| 11. | Eatock MM, Schatzlein A, Kaye SB. Tumour vasculature as a target for anticancer therapy. Cancer Treat Rev. 2000;26:191-204. [PubMed] [DOI] |
| 12. | Pianetti S, Guo S, Kavanagh KT, Sonenshein GE. Green tea polyphenol epigallocatechin-3 gallate inhibits Her-2/neu signaling, proliferation, and transformed phenotype of breast cancer cells. Cancer Res. 2002;62:652-655. [PubMed] |
| 13. | Yang F, de Villiers WJ, McClain CJ, Varilek GW. Green tea polyphenols block endotoxin-induced tumor necrosis factor- production and lethality in a murine model. J Nutr. 1998;128:2334-2340. [PubMed] |
| 14. | Liang YC, Chen YC, Lin YL, Lin-Shiau SY, Ho CT, Lin JK. Suppression of extracellular signals and cell proliferation by the black tea polyphenol, theaflavin-3,3'-digallate. Carcinogenesis. 1999;20:733-736. [PubMed] [DOI] |
| 15. | Kavanagh KT, Hafer LJ, Kim DW, Mann KK, Sherr DH, Rogers AE, Sonenshein GE. Green tea extracts decrease carcinogen-induced mammary tumor burden in rats and rate of breast cancer cell proliferation in culture. J Cell Biochem. 2001;82:387-398. [PubMed] [DOI] |
| 16. | Brown MD. Green tea (Camellia sinensis) extract and its possible role in the prevention of cancer. Altern Med Rev. 1999;4:360-370. [PubMed] |
| 17. | Umemura T, Kai S, Hasegawa R, Kanki K, Kitamura Y, Nishikawa A, Hirose M. Prevention of dual promoting effects of pentachlorophenol, an environmental pollutant, on diethylnitrosamine-induced hepato- and cholangiocarcinogenesis in mice by green tea infusion. Carcinogenesis. 2003;24:1105-1109. [PubMed] [DOI] |
| 18. | Ravindranath MH, Ramasamy V, Moon S, Ruiz C, Muthugounder S. differential growth suppression of human melanoma cells by tea (camellia sinensis) epicatechins (ECG, EGC and EGCG). Evid Based Complement Alternat Med. 2008; Jan 3 [Epub ahead of print]. [PubMed] |
| 19. | Imai K, Suga K, Nakachi K. Cancer-preventive effects of drinking green tea among a Japanese population. Prev Med. 1997;26:769-775. [PubMed] [DOI] |
| 20. | Nakachi K, Suemasu K, Suga K, Takeo T, Imai K, Higashi Y. Influence of drinking green tea on breast cancer malignancy among Japanese patients. Jpn J Cancer Res. 1998;89:254-261. [PubMed] |
| 21. | Neukam K, Pastor N, Cortés F. Tea flavanols inhibit cell growth and DNA topoisomerase II activity and induce endoreduplication in cultured Chinese hamster cells. Mutat Res. 2008;654:8-12. [PubMed] |
| 22. | Tachibana H, Koga K, Fujimura Y, Yamada K. A receptor for green tea polyphenol EGCG. Nat Struct Mol Biol. 2004;11:380-381. [PubMed] [DOI] |
| 23. | Montuori N, Müller F, De Riu S, Fenzi G, Sobel ME, Rossi G, Vitale M. Laminin receptors in differentiated thyroid tumors: restricted expression of the 67-kilodalton laminin receptor in follicular carcinoma cells. J Clin Endocrinol Metab. 1999;84:2086-2092. [PubMed] [DOI] |
| 24. | Umeda D, Yano S, Yamada K, Tachibana H. Green tea polyphenol epigallocatechin-3-gallate signaling pathway through 67-kDa laminin receptor. J Biol Chem. 2008;283:3050-3058. [PubMed] [DOI] |
| 25. | Kim K, Li L, Kozlowski K, Suh HS, Cao W, Ballermann BJ. The protein phosphatase-1 targeting subunit TIMAP regulates LAMR1 phosphorylation. Biochem Biophys Res Commun. 2005;338:1327-1334. [PubMed] [DOI] |
| 26. | Givant-Horwitz V, Davidson B, Reich R. Laminin-induced signaling in tumor cells: the role of the M(r) 67,000 laminin receptor. Cancer Res. 2004;64:3572-3579. [PubMed] [DOI] |
| 27. | Adachi S, Nagao T, To S, Joe AK, Shimizu M, Matsushima-Nishiwaki R, Kozawa O, Moriwaki H, Maxfield FR, Weinstein IB. (-)-Epigallocatechin gallate causes internalization of the epidermal growth factor receptor in human colon cancer cells. Carcinogenesis. 2008;29:1986-1993. [PubMed] [DOI] |
| 28. | Kazi A, Wang Z, Kumar N, Falsetti SC, Chan TH, Dou QP. Structure-activity relationships of synthetic analogs of (-)- epigallocatechin-3-gallate as proteasome inhibitors. Anticancer Res. 2004;24:943-954. [PubMed] |
| 29. | Guo S, Lu J, Subramanian A, Sonenshein GE. Microarray-assisted pathway analysis identifies mitogen-activated protein kinase signaling as a mediator of resistance to the green tea polyphenol epigallocatechin 3-gallate in her-2/neu- overexpressing breast cancer cells. Cancer Res. 2006;66:5322-5329. [PubMed] [DOI] |
| 30. | Dong Z, Ma W, Huang C, Yang CS. Inhibition of tumor promoter-induced activator protein 1 activation and cell transformation by tea polyphenols, (-)-epigallocatechin gallate, and theaflavins. Cancer Res. 1997;57:4414-4419. [PubMed] |
| 31. | Chung JY, Park JO, Phyu H, Dong Z, Yang CS. Mechanisms of inhibition of the Ras-MAP kinase signaling pathway in 30.7b Ras 12 cells by tea polyphenols (-)-epigallocatechin-3-gallate and theaflavin-3,3'-digallate. FASEB J. 2001;15:2022-2024. [PubMed] |
| 32. | Afaq F, Adhami VM, Ahmad N, Mukhtar H. Inhibition of ultraviolet B-mediated activation of nuclear factor kappaB in normal human epidermal keratinocytes by green tea Constituent (-)-epigallocatechin-3-gallate. Oncogene. 2003;22:1035-1044. [PubMed] [DOI] |
| 33. | Sah JF, Balasubramanian S, Eckert RL, Rorke EA. Epigallocatechin-3-gallate inhibits epidermal growth factor receptor signaling pathway. Evidence for direct inhibition of ERK1/2 and AKT kinases. J Biol Chem. 2004;279:12755-12762. [PubMed] [DOI] |
| 34. | Shimizu M, Deguchi A, Lim JT, Moriwaki H, Kopelovich L, Weinstein IB. (-)-Epigallocatechin gallate and polyphenon E inhibit growth and activation of the epidermal growth factor receptor and human epidermal growth factor receptor-2 signaling pathways in human colon cancer cells. Clin Cancer Res. 2005;11:2735-2746. [PubMed] [DOI] |
| 35. | Saeki K, Kobayashi N, Inazawa Y, Zhang H, Nishitoh H, Ichijo H, Saeki K, Isemura M, Yuo A. Oxidation-triggered c-Jun N- terminal kinase (JNK) and p38 mitogen-activated protein (MAP) kinase pathways for apoptosis in human leukaemic cells stimulated by epigallocatechin-3-gallate (EGCG): a distinct pathway from those of chemically induced and receptor- mediated apoptosis. Biochem J. 2002;368:705-720. [PubMed] [DOI] |
| 36. | Hung PF, Wu BT, Chen HC, Chen YH, Chen CL, Wu MH, Liu HC, Lee MJ, Kao YH. Antimitogenic effect of green tea (-)- epigallocatechin gallate on 3T3-L1 preadipocytes depends on the ERK and Cdk2 pathways. Am J Physiol Cell Physiol. 2005;288:C1094-C1108. [PubMed] [DOI] |
| 37. | Sovak MA, Bellas RE, Kim DW, Zanieski GJ, Rogers AE, Traish AM, Sonenshein GE. Aberrant nuclear factor-kappaB/Rel expression and the pathogenesis of breast cancer. J Clin Invest. 1997;100:2952-2960. [PubMed] [DOI] |
| 38. | Romieu-Mourez R, Kim DW, Shin SM, Demicco EG, Landesman-Bollag E, Seldin DC, Cardiff RD, Sonenshein GE. Mouse mammary tumor virus c-rel transgenic mice develop mammary tumors. Mol Cell Biol. 2003;23:5738-5754. [PubMed] [DOI] |
| 39. | Khan N, Afaq F, Saleem M, Ahmad N, Mukhtar H. Targeting multiple signaling pathways by green tea polyphenol (-)- epigallocatechin-3-gallate. Cancer Res. 2006;66:2500-2505. [PubMed] [DOI] |
| 40. | Kuo PL, Lin CC. Green tea constituent (-)-epigallocatechin-3-gallate inhibits Hep G2 cell proliferation and induces apoptosis through p53-dependent and Fas-mediated pathways. J Biomed Sci. 2003;10:219-227. [PubMed] |
| 41. | Fang MZ, Wang Y, Ai N, Hou Z, Sun Y, Lu H, Welsh W, Yang CS. Tea polyphenol (-)-epigallocatechin-3-gallate inhibits DNA methyltransferase and reactivates methylation-silenced genes in cancer cell lines. Cancer Res. 2003;63:7563-7570. [PubMed] |
| 42. | Naasani I, Oh-Hashi F, Oh-Hara T, Feng WY, Johnston J, Chan K, Tsuruo T. Blocking telomerase by dietary polyphenols is a major mechanism for limiting the growth of human cancer cells in vitro and in vivo. Cancer Res. 2003;63:824-830. [PubMed] |
| 43. | Akiyama M, Yamada O, Kanda N, Akita S, Kawano T, Ohno T, Mizoguchi H, Eto Y, Anderson KC, Yamada H. Telomerase overexpression in K562 leukemia cells protects against apoptosis by serum deprivation and double-stranded DNA break inducing agents, but not against DNA synthesis inhibitors. Cancer Lett. 2002;178:187-197. [PubMed] [DOI] |
| 44. | Bandele OJ, Osheroff N. (-)-Epigallocatechin gallate, a major constituent of green tea, poisons human type II topoisomerases. Chem Res Toxicol. 2008;21:936-943. [PubMed] [DOI] |
| 45. | Liu L, Lai CQ, Nie L, Ordovas J, Band M, Moser L, Meydani M. The modulation of endothelial cell gene expression by green tea polyphenol-EGCG. Mol Nutr Food Res. 2008;52:1182-1192. [PubMed] [DOI] |
| 46. | Sartippour MR, Shao ZM, Heber D, Beatty P, Zhang L, Liu C, Ellis L, Liu W, Go VL, Brooks MN. Green tea inhibits vascular endothelial growth factor (VEGF) induction in human breast cancer cells. J Nutr. 2002;132:2307-2311. [PubMed] |
| 47. | Qanungo S, Das M, Haldar S, Basu A. Epigallocatechin-3-gallate induces mitochondrial membrane depolarization and caspase-dependent apoptosis in pancreatic cancer cells. Carcinogenesis. 2005;26:958-967. [PubMed] [DOI] |
| 48. | Lambert JD, Hong J, Yang GY, Liao J, Yang CS. Inhibition of carcinogenesis by polyphenols: evidence from laboratory investigations. Am J Clin Nutr. 2005;81:284S-291S. [PubMed] |
| 49. | Kazi A, Smith DM, Zhong Q, Dou QP. Inhibition of bcl-x(l) phosphorylation by tea polyphenols or epigallocatechin-3-gallate is associated with prostate cancer cell apoptosis. Mol Pharmacol. 2002;62:765-771. [PubMed] [DOI] |
| 50. | Chen C, Shen G, Hebbar V, Hu R, Owuor ED, Kong AN. Epigallocatechin-3-gallate-induced stress signals in HT-29 human colon adenocarcinoma cells. Carcinogenesis. 2003;24:1369-1378. [PubMed] [DOI] |
| 51. | Coimbra S, Castro E, Rocha-Pereira P, Rebelo I, Rocha S, Santos-Silva A. The effect of green tea in oxidative stress. Clin Nutr. 2006;25:790-796. [PubMed] [DOI] |
| 53. | Raza H, John A. In vitro effects of tea polyphenols on redox metabolism, oxidative stress, and apoptosis in PC12 cells. Ann N Y Acad Sci. 2008;1138:358-365. [PubMed] |
| 54. | Artali R, Beretta G, Morazzoni P, Bombardelli E, Meneghetti F. Green tea catechins in chemoprevention of cancer: A molecular docking investigation into their interaction with glutathione S-transferase (GST P1-1). J Enzyme Inhib Med Chem. 2008; Sep 29: 1 [Epub ahead of print]. [PubMed] |
| 55. | Dou QP, Landis-Piwowar KR, Chen D, Huo C, Wan SB, Chan TH. Green tea polyphenols as a natural tumour cell proteasome inhibitor. Inflammopharmacology. 2008;16:208-212. [PubMed] [DOI] |
| 56. | Ishii T, Mori T, Tanaka T, Mizuno D, Yamaji R, Kumazawa S, Nakayama T, Akagawa M. Covalent modification of proteins by green tea polyphenol (-)-epigallocatechin-3-gallate through autoxidation. Free Radic Biol Med. 2008;45:1384-1394. [PubMed] [DOI] |
| 57. | Hakim IA, Harris RB, Brown S, Chow HH, Wiseman S, Agarwal S, Talbot W. Effect of increased tea consumption on oxidative DNA damage among smokers: a randomized controlled study. J Nutr. 2003;133:3303S-3309S. [PubMed] |
| 58. | Dreosti IE, Wargovich MJ, Yang CS. Inhibition of carcinogenesis by tea: the evidence from experimental studies. Crit Rev Food Sci Nutr. 1997;37:761-770. [PubMed] |
| 59. | Lu YP, Lou YR, Lin Y, Shih WJ, Huang MT, Yang CS, Conney AH. Inhibitory effects of orally administered green tea, black tea, and caffeine on skin carcinogenesis in mice previously treated with ultraviolet B light (high-risk mice): relationship to decreased tissue fat. Cancer Res. 2001;61:5002-5009. [PubMed] |
| 60. | Mantena SK, Meeran SM, Elmets CA, Katiyar SK. Orally administered green tea polyphenols prevent ultraviolet radiation- induced skin cancer in mice through activation of cytotoxic T cells and inhibition of angiogenesis in tumors. J Nutr. 2005;135:2871-2877. [PubMed] |
| 61. | Zykova TA, Zhang Y, Zhu F, Bode AM, Dong Z. The signal transduction networks required for phosphorylation of STAT1 at Ser727 in mouse epidermal JB6 cells in the UVB response and inhibitory mechanisms of tea polyphenols. Carcinogenesis. 2005;26:331-342. [PubMed] [DOI] |
| 62. | Chen D, Milacic V, Chen MS, Wan SB, Lam WH, Huo C, Landis-Piwowar KR, Cui QC, Wali A, Chan TH. Tea polyphenols, their biological effects and potential molecular targets. Histol Histopathol. 2008;23:487-496. [PubMed] |
| 63. | Scalbert A, Manach C, Morand C, Remesy C, Jimenez L. Dietary polyphenols and the prevention of diseases. Crit Rev Food Sci Nutr. 2005;45:287-306. [PubMed] [DOI] |
| 65. | Ciechanover A. The ubiquitin-proteasome proteolytic pathway. Cell. 1994;79:13-21. [PubMed] [DOI] |
| 66. | Kuhn D, Lam WH, Kazi A, Daniel KG, Song S, Chow LM, Chan TH, Dou QP. Synthetic peracetate tea polyphenols as potent proteasome inhibitors and apoptosis inducers in human cancer cells. Front Biosci. 2005;10:1010-1023. [PubMed] [DOI] |
| 67. | Nam S, Smith DM, Dou QP. Ester bond-containing tea polyphenols potently inhibit proteasome activity in vitro and in vivo. J Biol Chem. 2001;276:13322-13330. [PubMed] [DOI] |