修回日期: 2009-09-09
接受日期: 2009-09-15
在线出版日期: 2009-10-08
目的: 分析姑息性手术联合I125粒子植入和化疗对晚期胰腺癌患者的疗效.
方法: 回顾性分析我科2004-2008年收治的晚期胰腺癌患者149例, 按治疗方法分为2组, 姑息手术+I125粒子植入+化疗62例(A组), 姑息手术+化疗87例(B组). 比较2组患者客观有效率(OTR)、临床受益率(CBR)、中位生存期以及并发症发生率.
结果: 与B组相比, A组患者临床受益率, 中位生存期差异有统计学差异(χ2 = 7.361, 10.090, P<0.05), 而客观有效率与并发症发生率差异无统计学差异(P>0.05).
结论: 姑息性手术联合I125粒子植入和术后化疗治疗晚期胰腺癌患者, 是一种安全有效的治疗方法.
引文著录: 吴汉青, 吴河水, 杨智勇, 王春友, 原伟伟. I125粒子植入在胰腺恶性肿瘤治疗中的疗效分析. 世界华人消化杂志 2009; 17(28): 2951-2954
Revised: September 9, 2009
Accepted: September 15, 2009
Published online: October 8, 2009
AIM: To investigate the efficacy of palliative operation in combination with iodine-125 (I-125) seed implantation and postoperative chemotherapy in the treatment of unresectable pancreatic carcinoma.
METHODS: A total of 149 pancreatic carcinoma patients were retrospectively analyzed. These patients were divided into two groups according to therapeutic protocol: patients undergoing palliative operation in combination with postoperative chemotherapy and I-125 seed implantation (study group, n = 62) and those undergoing palliative operation only in combination with postoperative chemotherapy (control group, n = 87). Objective tumor response, clinical benefit response, median survival time and complication rate were compared between the two groups.
RESULTS: Significant differences were noted in clinical benefit response and median survival time between the two groups (χ2 = 7.361 and 10.090, respectively, both P < 0.05). No significant differences were observed in objective tumor response and complication rate between the two groups (both P > 0.05).
CONCLUSION: Palliative operation in combination with I-125 seed implantation and postoperative chemotherapy is safe and effective in the treatment of unresectable pancreatic carcinoma.
- Citation: Wu HQ, Wu HS, Yang ZY, Wang CY, Yuan WW. Efficacy of iodine-125 seed implantation in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2951-2954
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2951.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2951
胰腺癌因其隐匿性及生物学特性, 患者早期多无明显临床症状, 就诊时大多失去根治性切除机会. 对于不能行根治切除的中晚期胰腺癌, 治疗方法较多, 但效果不尽人意[1]. 华中科技大学同济医学院附属协和医院胰腺外科中心自2004年采用姑息性手术联合I125粒子植入和术后化疗治疗患者, 取得了较好的疗效, 现报道如下.
收集2004-01/2008-06华中科技大学同济医学院附属协和医院胰腺外科收治的中晚期胰腺癌患者149例, 患者术前均经彩超和CT, 或者经术中病理确诊肿瘤已广泛侵犯肠系膜血管和(或)门静脉血管, 无法施行根治性手术. 其中男91例, 女58例, 年龄31-72(平均52)岁; 既往未接受化疗和放疗, 无严重的心脏病及其他脏器病史等.
1.2.1 分组: 根据患者所受的治疗方法分为2组, A组62例, 行姑息性手术(如胆管空肠吻合和/或胃空肠吻合等), 术中同时在肿瘤中植入I125粒子, 术后行化疗(吉西他滨); B组87例, 行姑息性手术(同A组), 术后行化疗(同A组). 2组病例性别、年龄和病程方面无差异, 具有可比性.
1.2.2 治疗: 手术前彩超和CT检查结果评价瘤体,根据胰腺肿瘤病灶大小、位置以及与周围正常组织的关系从而确定手术方案及I125粒子植入的数目及进针的深度. I125粒子植入是在术中直视下采用粒子植入枪植入, 常用的粒子数目估算公式为: 粒子植入总数 = [(肿瘤长+宽+高)/3×5]/每个粒子的活度, 常用的每个粒子的活度为(1.1-1.8)×107 Bq, 一般粒子数目为20-40粒. 姑息性手术常常为胆管空肠吻合和/或胃空肠吻合术, 其目的常常为解除黄疸及肠道梗阻. 吉西他滨的化疗常常在患者术后2 wk内施行, 用量根据患者体表面积大小决定常常为1000 mg/m2经外周静脉滴入30 min, 每周1次, 连续3 wk, 随后休息1 wk, 每4 wk重复1次. 依据患者的毒性反应相应减少剂量.
1.2.3 临床疗效标准和临床受益反应: 临床疗效标准按照世界卫生组织(WHO)疗效评价标准, 将患者治疗疗效评价为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD). 临床受益反应根据1997年Burris et al制定的临床受益反应标准对患者的疼痛强度对患者的疼痛强度(VAS评分, 10分制)、镇痛药物消耗量、卡氏评分和体质量变化综合评估. 凡符合下列一项指标(持续4 wk以上), 并无任何一项恶化者, 定义为临床受益者: (1)疼痛强度减轻≥50%; (2)镇痛药物用量减少≥50%; (3)体力状况按卡氏评分标准改善≥20分; (4)如疼痛程度及体力状况均稳定, 则非体液滞留的体质量增加≥7%.
统计学处理 在SPSS13.0软件上进行统计学分析, 2组间样本客观有效率, 临床受益率以及并发症发生率等采用χ2检验. 对生存率比较采用Log-rank检验法. P<0.05差异有统计学意义.
客观有效率(PR+CR)A组为32.3%(20/62), B组为28.7%(25/87), 2组差异无统计学差异(χ2 = 0.213, P = 0.640). 临床受益率A组为58.1%(36/62), B组为35.6%(31/87), 2组差异有统计学差异(χ2 = 7.361, P = 0.007<0.05). 术后1 mo中患者发生的并发症A组为6.5%(4/62), B组为5.7%(5/87), 2组间差异无统计学差异(χ2 = 0.032, P = 0.859), 并发症主要为腹腔感染, 恶心呕吐为主, A组有1例患者出现粒子游走至肝脏(表1).
| 分组 | PR+CR | SD+PD | 客观有效率(%) | 临床受益n(%) | 并发症n(%) |
| A组 | 20 | 42 | 32.3 | 36(58.10) | 4(6.5) |
| B组 | 25 | 62 | 28.7 | 31(35.60) | 5(5.7) |
| 总计 | 45 | 104 | 30.5 | 67(46.85) | 9(5.6) |
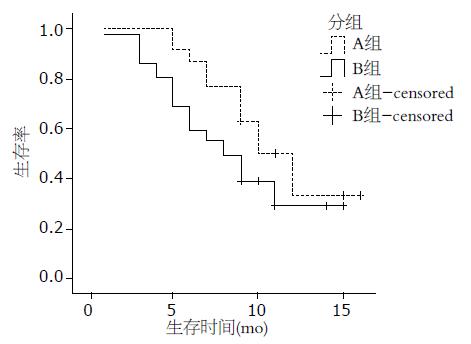
A组中位生存期为12.0 mo, B组中位生存期为8.0 mo, 平均生存时间A组为11.3 mo, B组为8.9 mo. Log-rank检验发现2组差异有统计学意义(χ2 = 10.09, P<0.05, 表2, 图1).
| 分组 | 平均生存时间(mo) | 中位生存时间(mo) | ||
| mean±SD | 95%CI | mean±SD | 95%CI | |
| A组 | 11.316±0.866 | 9.618-13.014 | 12.000±1.631 | 8.804-15.196 |
| B组 | 8.908±0.584 | 7.763-10.053 | 8.000±0.666 | 6.694-9.306 |
| 总计 | 10.102±0.541 | 9.042-11.162 | 9.000±0.495 | 8.029-9.971 |
胰腺癌是恶性程度较高的消化系肿瘤, 其发病率在近数十年明显升高. 胰腺癌患者的1年生存率低于25%, 可手术切除者的5年生存率也不超过5%[1-2], 局部进展期和伴转移的胰腺癌患者中位生存时间分别为6-10 mo和3-6 mo[3]. 因此, 如何有效提高胰腺癌患者的生活质量和生存期成为临床医学的重要课题.
对大多数手术不能根治切除的胰腺癌, 目前主要的治疗方法有以下几种: 姑息性外科手术治疗, 体内外放疗[4-5], 以吉西他滨为主的化疗[6]等. 姑息性外科手术治疗主要目的在于缓解临床症状, 改善生活症状, 包括以下手术: (1)解除黄疸: 胰腺癌中大多数为胰头癌, 易引起梗阻性黄疸. 手术方式有胆囊空肠吻合、胆管空肠吻合和胆道外引流等. 本次收集的患者中, 有黄疸者82例, 占所有患者比例为55%. (2)解除或预防十二指肠梗阻: 手术方式通常为胃空肠吻合, 对尚未发生梗阻行预防性胃空肠吻合尚存在争议. 本次患者中有十二指肠梗阻者9例, 占所有患者比例为6%, 对其他患者未行预防性胃空肠吻合. (3)缓解疼痛: 引流减压胆胰管; 内脏神经切断或神经节切除等. 放射性粒子近距离治疗肿瘤是指将微型放射源(I125放射性粒子)植入肿瘤内或受肿瘤浸润侵犯的组织中, 包括肿瘤淋巴扩散途径的组织, 通过微型放射源发出的持续低能量射线, 使肿瘤组织遭受最大程度的毁灭性损伤, 而正常组织不损伤或仅有微小损伤. 肿瘤的内部放射治疗既能达到一定治疗效果, 同时也无严重并发症. 据文献报道, I125内放射粒子植入可有力控制胰腺癌局部病变的发展, 降低肿瘤生长速度. 与此同时, 内放射粒子副损伤小, 可有力保留周围功能性组织(如血管和神经等)[7]. 从上述实验结果可以看出, 通过放射性粒子植入治疗中晚期手术不能切除的胰腺癌病例, 可以明显改善生活质量减少患者尤其是疼痛对患者的影响, 同时不引起明显并发症. 结果说明粒子植入有比较确切的止痛效果, 可以明显改善患者的生活质量. 本实验A组患者行粒子植入后, 对比B组未行粒子植入患者, 生活质量明显改善, 这可能与减轻患者疼痛有关. 吉西他滨对胰腺癌的治疗作用最早在1999年Storniolo et al[8]一项临床试验, 证实了吉西他滨对晚期胰腺癌的治疗益处. 此后吉西他滨成为晚期胰腺癌的标准一线药物, 并逐渐用于术后治疗. 近年的研究多针对吉西他滨为基础的化疗方案. 而吉西他滨作为新合成的脱氧胞苷类似物, 具有完全不同的抗肿瘤活性, 美国FDA以批准吉西他滨作为抗胰腺癌的一线用药[9], 在无法行根治切除术的进展期胰腺癌患者, 吉西他滨可以获得较高的反应率和更长的生存期. 在2007年ASCO年会上, Yoshitomi et al[10]报道了胰腺癌术后辅助化疗的Ⅱ期随机临床试验结论是吉西他滨为基础的联合化疗方案对术后患者是安全有效的.
本研究结果显示对肿块不能切除、伴有消化系梗阻的晚期胰腺癌患者, 在应用姑息手术以解除日渐加重的胆道和胃肠道梗阻的基础上, 结合术后吉西他滨化疗加行术中I125粒子植入可明显提高晚期胰腺癌患者的客观有效率和临床受益率. 同时结果显示I125粒子植入组临床受益率明显高于未加用粒子组, 说明I125粒子植入可持久的改善患者生活质量, 减轻痛苦, 这可能与I125粒子既可以使肿瘤局部变性坏死, 减轻局部张力, 也可以破坏胰腺周围的腹腔神经丛有关. 在并发症的发生率上, I125粒子植入组并发症发生并没有高于未植入粒子组, 这说明在粒子植入对于患者是比较安全的. 在生存率的比较上, I125粒子植入组与未植入组有明显的统计学差异, 所以粒子的植入能够提高患者的远期生存率, 这可能与I125粒子的放射性能够局部杀灭肿瘤细胞, 抑制肿瘤的生长, 从而提高患者中位生存期. 但I125粒子种植治疗也有其不利的因素, 如粒子游走等. A组患者有1例患者出现粒子游走至肝脏, 但因患者无不良反应, 肝功能正常未作处理. 由于I125的半衰期特点以及穿透力的局限性, 目前许多学者正进行更具优越性的Pd103粒子治疗胰腺癌的探讨, 如Bernard et al[11]应用Pd103粒子治疗一组晚期胰腺癌患者, 但确切疗效尚需要大样本资料对照研究来证实.
总之, 姑息性手术联合I125粒子植入和吉西他滨化疗对局部进展期胰腺癌, 能控制局部肿瘤的生长, 提高患者生存率, 是一种安全有效的晚期胰腺肿瘤治疗手段.
胰腺癌是一种常见而又恶性程度很高的消化系肿瘤, 5年生存率仍低于5%, 且其发病率在近数十年有明显升高. 如何提高胰腺癌患者生存质量和生存期为当今治疗的难点和重点. 文献报道多种恶性肿瘤术中联合放射性粒子为近年发展起来的一种针对晚期不能切除恶性实体肿瘤新的治疗手段. 将放射性粒子应用到不能根治切除胰腺癌, 并评价其效果, 为临床胰腺癌治疗提供依据.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
不能根治切除的胰腺癌单纯应用化疗药物由于可能产生耐药性从而导致治疗效果不佳. 由于放射性粒子的应用取得了很大的进展, 故联合化疗和放疗将成为不能根治切除胰腺癌的一个重要治疗方法.
放射性粒子植入被广泛应用到晚期不能切除的恶性实体肿瘤. 有学者认为, 应用I125粒子植入对于晚期不能根治切除的胰腺癌不能提高其远期生存率. 还有学者认为, 应该应用更优越性的Pd103治疗胰腺癌, 但还需要样本支持.
本研究设计合理, 具有一定的临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Cooperman AM, Kini S, Snady H, Bruckner H, Chamberlain RS. Current surgical therapy for carcinoma of the pancreas. J Clin Gastroenterol. 2000;31:107-113. [PubMed] |
| 2. | Parkin DM, Bray FI, Devesa SS. Cancer burden in the year 2000. The global picture. Eur J Cancer. 2001;37 Suppl 8:S4-S66. [PubMed] |
| 3. | Haller DG. New perspectives in the management of pancreas cancer. Semin Oncol. 2003;30:3-10. [PubMed] |
| 4. | Willett CG, Safran H, Abrams RA, Regine WF, Rich TA. Clinical research in pancreatic cancer: the Radiation Therapy Oncology Group trials. Int J Radiat Oncol Biol Phys. 2003;56:31-37. [PubMed] |
| 5. | Moore MJ. Pancreatic cancer: what the oncologist can offer for palliation. Can J Gastroenterol. 2002;16:121-124. [PubMed] |
| 6. | Böttger TC, Junginger T. Factors influencing morbidity and mortality after pancreaticoduodenectomy: critical analysis of 221 resections. World J Surg. 1999;23:164-171; discussion 171-172. [PubMed] |
| 7. | Cooperman AM. Pancreatic cancer: the bigger picture. Surg Clin North Am. 2001;81:557-574. [PubMed] |
| 8. | Storniolo AM, Enas NH, Brown CA, Voi M, Rothenberg ML, Schilsky R. An investigational new drug treatment program for patients with gemcitabine: results for over 3000 patients with pancreatic carcinoma. Cancer. 1999;85:1261-1268. [PubMed] |
| 9. | Oya N. Chemoradiotherapy for pancreatic cancer: current status and perspectives. Int J Clin Oncol. 2004;9:451-457. [PubMed] |
| 10. | Yoshitomi H, Togawa A, Kimura F, Shimizu H, Yoshidome H, Miyazaki M. A randomized phase II trial of adjuvant chemotherapy with uracil/tegafur (UFT) and gemcitabine (GEM). vs gemcitabine alone in patients with resected pancreatic cancer. ASCO Annual Meeting. 2007;Abstract 454 DOI. |
| 11. | Bernard S, Vynckier S. Dosimetric study of a new polymer encapsulated palladium-103 seed. Phys Med Biol. 2005;50:1493-1504. [PubMed] |