修回日期: 2009-09-12
接受日期: 2009-09-21
在线出版日期: 2009-10-08
目的: 研究TPX2基因特异性小干扰RNA(small RNA interference, siRNA)对食管鳞癌EC9706细胞基因表达的抑制作用及对食管癌细胞生长的影响.
方法: 以食管鳞癌EC9706细胞为研究对象, 利用Lipofectamine2000介导TPX2 siRNA分组转染EC9706细胞24, 48, 72, 96 h(实验组), 并设立阴性对照组和空白对照组. RT-PCR检测siRNA转染前后TPX2 mRNA的表达水平的变化; Western blot检测转染前后EC9706细胞中TPX2蛋白表达水平的变化; MTT法检测瞬时转染TPX2 siRNA对EC9706细胞增殖的影响.
结果: 导入有效siRNA后, PT-PCR及Western blot结果显示, TPX2 siRNA可使EC9706细胞中TPX2 mRNA水平及蛋白表达水平下降, 至72 h时表达量最低, 与空白对照组相比分别为0.31±0.08和0.39±0.12, 差异有统计学意义(P<0.05); MTT实验显示细胞的生长增殖受到明显抑制, 与对照组相比抑制率可达35.4%(P<0.05).
结论: siRNA可以有效抑制EC9706细胞中TPX2的表达, 并降低EC9706细胞的增殖能力.
引文著录: 刘红春, 刘玉含, 赵培荣, 李晟磊. siRNA沉默TPX2基因对食管癌细胞EC9706的增殖和TPX2基因表达的影响. 世界华人消化杂志 2009; 17(28): 2927-2930
Revised: September 12, 2009
Accepted: September 21, 2009
Published online: October 8, 2009
AIM: To investigate the impact of targeting protein for Xklp2-speicific siRNA on TPX2 expression and cell proliferation in human esophageal carcinoma EC9706 cells.
METHODS: TPX2-specific siRNA was introduced into EC9706 cells by lipofectamine 2000-mediated transfection. After 24, 48, 72 and 96 hours of transfection, the expression levels of TPX2 mRNA and protein were determined by reverse transcription polymerase chain reaction (RT-PCR) and Western blot, respectively, and cell proliferation was detected by methyl thiazolyl tetrazolium (MTT) assay.
RESULTS: After siRNA transfection, RT-PCR and Western blot assays showed that there was a significant decrease in EC9706 mRNA and protein levels. The lowest expression levels of TPX2 mRNA and protein were detected 72 h after transfection (0.31 ± 0.08 and 0.39 ± 0.12 relative to blank control, respectively; both P < 0.05). MTT assay indicated that cell proliferation was restrained remarkably, and the growth inhibition rate was 35.4% relative to blank control (P < 0.05).
CONCLUSION: TPX2-specific siRNA can effectively downregulate TPX2 expression and inhibit cell proliferation in EC9706 cells.
- Citation: Liu HC, Liu YH, Zhao PR, Li SL. Small interfering RNA-mediated downregulation of targeting protein for Xklp2 suppresses the proliferation of human esophageal carcinoma EC9706 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2927-2930
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2927.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2927
TPX2(targeting protein for Xklp2)基因是近年来发现的一个候选的癌基因, 他的表达受到细胞周期的严格调控, 可能成为肿瘤细胞增殖的更确切的评估指标[1-3]. 肿瘤的发生和发展涉及到多个基因变化和相互作用, 是多阶段受多种因素调控的过程, RNAi相关技术可用于抑制其突变基因表达, 恢复正常基因的功能, 增加肿瘤细胞对现有治疗手段的敏感性, 还能研究各种作用因子的功能, 筛选有效的基因治疗的靶点[4]. 本实验利用siRNA技术, 通过体外设计合成针对靶基因TPX2的siRNA作用于食管癌EC9706细胞后观察其对细胞的作用效果及TPX2的表达.
人食管癌EC9706细胞为中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室惠赠; RPMI 1640培养液、胎牛血清、胰蛋白酶购于美国Hyclone公司; siRNA模板由上海吉玛生物工程公司合成; Lipofectamine 2000购于Invitrogen公司; MTT购于Sigma公司; RT-PCR与DNA Marker 1000试剂购于美国TaKaRa 公司; β-actin的兔多克隆抗体, 山羊抗兔辣根酶标记IgG(H+L)二抗均购自天根生化科技有限公司; 抗人TPX2的兔多克隆抗体为Gruss博士(European Molecular Biology Laboratory, Heidelberg, 德国)馈赠.
1.2.1 细胞株及其培养: 本实验采用食管鳞癌EC9706细胞作为研究对象. EC9706细胞在100 mL/L胎牛血清的RPMI 1640培养基中, 置于37℃, 50 mL/L CO2浓度, 饱和湿度下进行培养.
1.2.2 siRNA的设计与合成: TPX2的mRNA序列号为NM-012112, 针对靶基因TPX2设计siRNA, 靶序列为: 5'-CCA UUA ACC UGC CAG AGA ATT-3', 5'-UUC UCU GGC AGG UUA AUG GTG-3'.
1.2.3 siRNA特异性的转染: 按照Lipofectamine 2000说明书的要求进行转染, 转染前, 将处于对数生长期的EC9706(5×104个)铺于6孔板中, 使用无抗生素的培养基培养24 h. 待其细胞达到80%-90%融合度时, 将含有siRNA的转染试剂与细胞共孵育5 h后, 置换含100 mL/L胎牛血清的RPMI 1640培养基再孵育. 在培养24, 48, 72和96 h后分别收集转染细胞, 用于以下实验, 实验组重复4次. 每次实验设3组: 分别为siRNA组、阴性siRNA对照组和空白对照组(无siRNA). 每组设4 个平行孔, 实验重复2次.
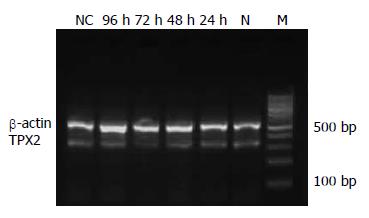
1.2.4 RT-PCR检测EC9706细胞TPX2 mRNA的表达: 分别于转染后24, 48, 72和96 h收集各组细胞各2×106个, PBS洗涤2遍, 提取各组细胞总RNA, 再进行RT-PCR. 反应条件: 50℃ 30 min; 94℃ 2 min; 94℃ 30 s, 56℃ 30 s, 72℃ 1 min 35个循环, 4℃保存RT-PCR产物. 用12 g/L琼脂糖凝胶对RT-PCR产物进行电泳, GeneTools图像系统分析结果, 分别得出各组TPX2基因条带和内参条带β-actin的A比值, 以其表示TPX2 mRNA含量的相对强度. PCR引物为: TPX2: 上游5'-GCC CTT TGT TCC CAA GAA AGA-3', 下游5'-AGC AGT GGA ATC GAG TGG AGA-3'; β-actin: 上游5'-GGG ACC TGA CTG ACT ACC TCA-3', 下游5'-GAC TCG TCA TAC TCC TGC TTG-3'. 具体操作过程按RT-PCR试剂盒说明书进行. TPX2扩增片段为335 bp, β-actin扩增片段为500 bp.
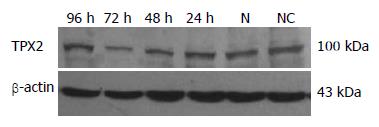
1.2.5 Western blot检测TPX2蛋白: 分别于转染后24, 48, 72和96 h收集细胞, 加入细胞裂解液提取细胞的总蛋白, 用Bradford法测定蛋白浓度. 制备SDS-聚丙烯酰胺凝胶, 每孔上样量为60 μg, 进行常规电泳后, 凝胶转移至硝酸纤维素膜上. 取出转移膜, 用50 g/L的脱脂牛奶封闭. 兔抗人TPX2一抗(1:1500), β-actin一抗(1:300)孵育过夜. TBST洗涤3次, 加入(1:10 000)稀释的山羊抗兔辣根酶标记IgG(H+L)二抗, 室温1 h. ECL发光液处理后, 暗室内曝光, 将胶片显影固定, 实验重复4次. 图像应用TotalLab 2.0软件进行灰度分析并作统计学处理.
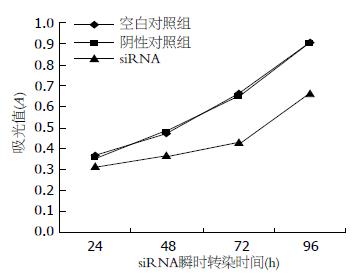
1.2.6 干涉TPX2表达后细胞增殖抑制实验(MTT): 为了直观地验证抑制TPX2的表达是否会抑制细胞的增殖, 用MTT来直接检测[5]. 用96 孔培养板分别于转染24、48、72和96 h时检测EC9706细胞增殖状态. 将转染siRNA后的细胞浓度调整为2×104/L, 96孔培养板内每孔加入培养液体积为200 μL. 分别在转染后的24、48、72和96 h, 在各组孔内加入20 μL MTT工作液(5 g/L), 继续37℃孵育4 h. 吸去上清液, 每孔加入二甲基亚砜(DMSO)200 μL, 置平板摇床震荡10 min. 至结晶完全溶解后, 酶标仪测定492 nm波长各孔的吸光度(A)值. 实验重复3次. 绘制细胞生长曲线, 计算生长抑制率. 生长抑制率 = (空白对照组A值-实验组A值)/对照组A值×100%.
统计学处理 使用SPSS13.0软件进行方差分析.
RT-PCR产物电泳条带显示, 转染TPX2 siRNA后, EC9706细胞TPX2 mRNA表达量随时间的增加而减少, 在72 h达最低(图1), 之后又增高, 但不影响β-actin的表达, 而空白和阴性对照组的EC9706细胞TPX2 mRNA无明显改变. 用H检验进行分析, 转染TPX2 siRNA 72 h后EC9706细胞的mRNA表达量与空白对照组之间的差异有显著性意义(n= 4, P<0.05). 阴性对照组TPX2 mRNA的量为空白对照组的1.01±0.11, 瞬时转染24, 48, 72, 96 h后TPX2 mRNA的量仅为空白对照组的0.87±0.06, 0.62±0.09, 0.31±0.08和0.74±0.10.
在72 h时siRNA TPX2瞬时转染后的EC9706细胞中TPX2蛋白表达水平较转染阴性对照细胞组和空白对照细胞组的TPX2蛋白表达水平显著降低. TPX2 mRNA表达下调后, 在蛋白质层次上引起TPX2表达下调(图2). Bandscan图像系统分析结果所示, 以EC9706细胞空白对照组的TPX2蛋白带为标准(亮度定为100), 其他几组与之比较, 转染阴性对照siRNA TPX2的条带强度为0.98±0.11, 干扰后24, 48, 72和96 h的条带强度分别为0.91±0.06, 0.68±0.07, 0.39±0.12和0.77±0.09.
通过比较细胞的3条生长曲线(图3), 可以看出阴性对照组和空白对照组细胞的生长曲线较为接近, 而转染TPX2 siRNA组细胞的生长曲线则位于前二者的下方. 这表明细胞在转染siRNA后48 h其增殖特性开始受到抑制, 至72 h抑制作用最为明显, 生长抑制率为0.35.
食管癌是世界上常见的消化系恶性肿瘤之一, 我国是世界上食管癌发病率和死亡率最高的国家, 鳞癌是最多见的组织学类型[6-7], 占90%以上. 基因治疗是近年来治疗恶性肿瘤的主要研究方向, 探寻食管鳞癌新的基因治疗方法具有重要意义. 与此同时, RNAi技术已经成为科学研究的前沿, 他为基因功能研究、疾病治疗及药物开发等提供了全新的构思和技术途径[8]. RNAi技术, 指内源性或外源性双链(dsRNA)在细胞内诱导同源序列的基因表达受抑的现象, 主要借助转录后的加工特异性抑制靶mRNA生成, 并导致特异性蛋白合成减少, 所以也称为转录后基因沉默(PTGS). 其基本原理是将dsRNA裂解为21-25个核苷酸组成的小的siRNA作为介导子, 引起同源序列特异性的mRNA降解[9].
TPX2是在爪蟾的微管相关蛋白中被首次发现的[10]. TPX2是一种微管相关蛋白, 对于有丝分裂纺锤体的稳定有重要作用[11]. TPX2的表达受细胞周期的严格调控, 只在G1-S交界期开始可以被检测到, 在胞质分裂完成后消失. 在S和G2期, 人TPX2弥漫分布在整个细胞核, 而在分裂期细胞, 他与有丝分裂的纺锤体密切结合, 是一种细胞周期蛋白[12]. 已有文献证明TPX2在肺鳞状细胞癌, 唾液腺癌, 卵巢癌中有高表达[11-13], 但关于TPX2在食管鳞癌细胞中表达情况的报道较为少见. 目前国内外应用RNAi技术干扰TPX2基因表达的报道甚少, Zhang et al[14]曾用RNAi技术成功地沉默了恶化的人支气管上皮细胞细胞TPX2基因, 实验结果显示: 化学合成的靶向siRNA在转染48 h时能够显著下调TPX2基因表达, 阻滞细胞周期于S期, 抑制细胞增殖. 在本研究中, 我们选用高表达TPX2基因的食管癌EC9706细胞, 应用RNAi技术观察化学合成的TPX2 siRNA对EC9706细胞的增殖抑制影响, 以及对TPX2的基因和蛋白表达的作用. 结果发现siRNA能有效抑制TPX2的表达, 从而抑制细胞的生长增殖.
本研究提示RNA干扰TPX2能有效抑制食管鳞癌EC9706细胞的生长增殖, 揭示了RNA干扰在食管癌基因治疗上的潜在应用价值, 为今后应用该技术治疗食管癌提供了一定的实验室依据.
感谢Gruss博士(European Molecular Biology Laboratory, Heidelberg, 德国)馈赠TPX2抗体, 感谢河南省肿瘤重点实验室及病理科同仁对本实验研究的帮助.
TPX2蛋白在细胞有丝分裂纺锤体形成过程中发挥重要作用. TPX2在多种恶性肿瘤中存在过表达, 阻断其表达可抑制肿瘤细胞的生长, 有望成为肿瘤治疗的候选靶点. 选用高表达TPX2基因的食管癌EC9706细胞, 应用RNAi技术, 观察siRNA能否有效抑制TPX2的表达, 从而抑制细胞的生长增殖, 为基因治疗食管癌提供实验依据.
许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科
有研究人员用RT-PCR和Western blot对肺癌细胞系中TPX2的表达水平进行了检测. 研究评价了TPX2异常表达在肺鳞癌发生、发展中的重要性. 还有研究表明胰腺癌中TPX2基因也明显扩增. 国外更多是研究TPX2的各种调控功能, 食管癌中的表达和干扰尚未见报道.
有关食管癌TPX2文献报道尚未见到, 本研究采用RNAi技术干扰食管癌细胞后, 采用RT-PCR 、Western blot检测siRNA干扰前后TPX2 mRNA的表达水平和蛋白表达水平的变化, 以及MTT法检测瞬时转染TPX2 siRNA对EC9706细胞增殖的影响, 具有一定的创新性.
siRNA可以有效抑制EC9706细胞中TPX2的表达, 并降低EC9706细胞的增殖能力.
本文选题新颖, 设计合理, 对食管癌基因治疗有一定的意义.
编辑: 李军亮 电编:何基才
| 1. | Wittmann T, Wilm M, Karsenti E, Vernos I. TPX2, A novel xenopus MAP involved in spindle pole organization. J Cell Biol. 2000;149:1405-1418. [PubMed] |
| 2. | Ma Y, Lin D, Sun W, Xiao T, Yuan J, Han N, Guo S, Feng X, Su K, Mao Y. Expression of targeting protein for xklp2 associated with both malignant transformation of respiratory epithelium and progression of squamous cell lung cancer. Clin Cancer Res. 2006;12:1121-1127. [PubMed] |
| 4. | 叶 景佳, 曹 江. RNAi相关技术及其在肿瘤基因治疗中的应用. 国外医学·肿瘤学分册. 2004;31:670-674. |
| 7. | Metzger R, Schneider PM, Warnecke-Eberz U, Brabender J, Hölscher AH. Molecular biology of esophageal cancer. Onkologie. 2004;27:200-206. [PubMed] |
| 9. | Semizarov D, Frost L, Sarthy A, Kroeger P, Halbert DN, Fesik SW. Specificity of short interfering RNA determined through gene expression signatures. Proc Natl Acad Sci U S A. 2003;100:6347-6352. [PubMed] |
| 10. | Rajangam AS, Kumar M, Aspeborg H, Guerriero G, Arvestad L, Pansri P, Brown CJ, Hober S, Blomqvist K, Divne C. MAP20, a microtubule-associated protein in the secondary cell walls of hybrid aspen, is a target of the cellulose synthesis inhibitor 2,6-dichlorobenzonitrile. Plant Physiol. 2008;148:1283-1294. [PubMed] |
| 11. | Lin DM, Ma Y, Xiao T, Guo SP, Han NJ, Su K, Yi SZ, Fang J, Cheng SJ, Gao YN. [TPX2 expression and its significance in squamous cell carcinoma of lung]. Zhonghua Binglixue Zazhi. 2006;35:540-544. [PubMed] |
| 12. | Shigeishi H, Ohta K, Hiraoka M, Fujimoto S, Minami M, Higashikawa K, Kamata N. Expression of TPX2 in salivary gland carcinomas. Oncol Rep. 2009;21:341-344. [PubMed] |
| 13. | Scharer CD, Laycock N, Osunkoya AO, Logani S, McDonald JF, Benigno BB, Moreno CS. Aurora kinase inhibitors synergize with paclitaxel to induce apoptosis in ovarian cancer cells. J Transl Med. 2008;6:79. [PubMed] |
| 14. | Zhang L, Huang H, Deng L, Chu M, Xu L, Fu J, Zhu Y, Zhang X, Liu S, Zhou Z. TPX2 in malignantly transformed human bronchial epithelial cells by anti-benzo[a]pyrene-7,8-diol-9,10-epoxide. Toxicology. 2008;252:49-55. [PubMed] |