修回日期: 2009-08-26
接受日期: 2009-09-07
在线出版日期: 2009-10-08
目的: 观察慢性HBV感染(CHB)免疫清除期PD-1的表达状态以及干扰素抗病毒治疗期间T细胞PD-1的表达, 明确免疫清除期CHB患者PD-1表达的临床意义.
方法: 伴有长期ALT反复升高的CHB患者20例被纳入本研究, 所有病例均接受为期6 mo的Peg干扰素(1.5 μg/kg)抗病毒治疗, 每周1次. 应用流式细胞术对所有患者抗病毒治疗不同时间点(0、12、24 wk)的外周血总CD8+ T细胞和CD4+ T细胞PD-1表达百分比和表达强度进行检测.
结果: 免疫清除期CHB患者外周血总CD8+ T细胞和CD4+ T细胞PD-1阳性率和PD-1表达荧光强度均明显高于健康对照组(P<0.05); PEG干扰素治疗早期CD8+ T细胞PD-1阳性率呈现明显下降, 且CD8+ T细胞PD-1表达阳性率同ALT水平和病毒水平均呈现明显正相关(R2 = 0.22, 0.357, P = 0.001, 0.002).
结论: CHB患者外周血T细胞PD-1呈高表达; 干扰素治疗诱导的病毒水平下降可导致CD8+ T细胞PD-1表达明显下降.
引文著录: 梁雪松, 李成忠, 万谟彬, 张迁. 外周血T细胞表面PD-1在慢性乙型肝炎患者干扰素治疗期间的表达. 世界华人消化杂志 2009; 17(28): 2899-2902
Revised: August 26, 2009
Accepted: September 7, 2009
Published online: October 8, 2009
AIM: To investigate the expression of PD-1 on the surface of T cells in CHB patients in immune clearance phase and the dynamic changes in PD-1 expression on the surface of T cells in CHB patients during IFN-alpha 2b therapy, and analyze the prognostic significance of PD-1 expression in CHB infection patients after antiviral therapy.
METHODS: Twenty CHB patients with long-term elevated serum alanine aminotransferase (ALT) level were enrolled. All the patients underwent IFN-alpha 2b therapy (1.5 μg/kg, once a week) for 6 months. PD-1 expression on the surface of total peripheral CD8+ and CD4+ T cells was evaluated using flow cytometry at different time points during the therapy.
RESULTS: The positive rates and mean fluorescence intensity (MFI) of PD-1 expression on CD4+ and CD8+ T cells were significantly higher in CHB patients in immune clearance phase than in normal controls (all P < 0.05). During IFN-alpha 2b therapy, the positive rate of PD-1 expression on CD8+ T cells declined significantly over time. In CHB patients undergoing IFN-alpha 2b therapy, the positive rate of PD-1 expression on CD8+ T cells was positively correlated with both serum ALT level and HBV DNA level.
CONCLUSION: PD-1 is upregulated on total peripheral T cells in CHB patients in immune clearance phase. Interferon treatment-induced suppression of HBV replication results in a significant reduction in PD-1 expression on the surface of CD8+ T cells.
- Citation: Liang XS, Li CZ, Wan MB, Zhang Q. Dynamic changes in programmed death-1 expression on the surface of T cells in chronic hepatitis B patients undergoing interferon therapy. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2899-2902
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2899.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2899
HBV感染引起的乙型病毒性肝炎是一种常见的严重肝脏疾病. 在慢性HBV感染进程中, 宿主免疫反应特别是细胞免疫反应在病毒清除中起重要作用. 慢性乙型肝炎(chronic hepatitis B, CHB)患者宿主免疫特点为严重的HBV特异性T细胞功能缺陷, 其中程序型坏死因子1(programmed death 1, PD-1)是CHB进程中T细胞功能缺陷原因之一[1-7]. 为了明确干扰素(interferon, IFN)抗病毒治疗对宿主T细胞PD-1表达影响, 本研究对20例免疫清除期CHB患者Peg(polyethylene glycol, Peg)IFN治疗中T细胞PD-1表达进行了检测.
2007-09/2008-09长海医院感染科收治的CHB患者20例, 其中男15例, 女5例, 年龄21-41(平均29.6±5.9)岁, 所有患者均处于免疫清除期(ALT≥2倍). 诊断符合2000年修订《病毒性肝炎防治方案》标准. 所有患者排除其他肝炎病毒现症感染及合并自身免疫性肝炎、酒精性肝病等, 同时在入组前6 mo内未经任何抗病毒及免疫抑制治疗. 所有患者均接受为期6 mo的Peg IFN-α2b抗病毒治疗, 剂量为1.5 μg/kg, 每周1次. 分别在3个时间点进行了随访和检测: 基线(T1), 治疗12 wk(T2), 治疗24 wk(T3). 另选年龄和性别与患者相匹配的健康献血员10例为正常对照组. 所有病例均签署了知情同意, 并且本研究获得本院伦理委员会同意; FITC-CD4流式抗体、APC-CD8流式抗体购自美国eBiosciences公司、PD-1-PE流式抗体购自美国BD公司; HBV DNA荧光定量PCR法为罗氏Amplifier COBAS; FACSCalibur流式细胞仪为美国BD公司.
1.2.1 外周血总T细胞PD-1表达水平的检测: 应用流式细胞术对20例免疫清除期CHB患者接受抗病毒治疗前和10例健康献血员外周血总T细胞PD-1表达状态进行检测. 取50 μL抗凝血, 加抗-CD4-FITC、抗-CD8-APC和抗-PD-1-PE流式抗体各5 μL, 常温避光孵育20 min标记, 用流式细胞裂解液1 mL常温避光裂解10 min, 1500 r/min常温离心5 min, 弃去上清并用PBS 1 mL冲悬沉淀, 1500 r/min常温离心5 min洗沉淀1次, 标记处理好后, 将细胞收集冲悬在400 μL PBS中, 避光放置待上机, 上机浓度为106/mL. 激光器波长为488 nm与635 nm, 用Cellquest(Becton Dickinson Rutherford, NJ)软件获取和分析数据.
1.2.2 病毒检测: 抗HAV、抗HCV、抗HDV、抗HEV、抗EB、抗CMVIgM和HBV病毒学指标用第3代ELISA法进行检测(SABC公司). 血清HBV DNA水平应用罗氏Amplifier COBAS法检测. 肝功指标和血清HBV DNA水平在住院期间每周和随访期1年内每月门诊进行检测.
统计学处理 统计学处理采用SPSS12.0软件, 数据进行样本均数t检验和两变量相关性分析, 以及线性相关性分析.
9例患者在治疗12 wk时病毒载量水平较基线平均下降1.5个Log, 治疗24 wk时, 其中5例达到了完全病毒学应答, 发生eAg血清学转归和病毒载量水平下降为500拷贝以下, 且ALT水平复常. 根据eAg转变将病例分为eAg转换组和eAg阳性组. 其中两组病毒载量水平和ALT变化见表1. 治疗12 wk时,病毒载量下降幅度两组差异具有统计学差异(P<0.05).
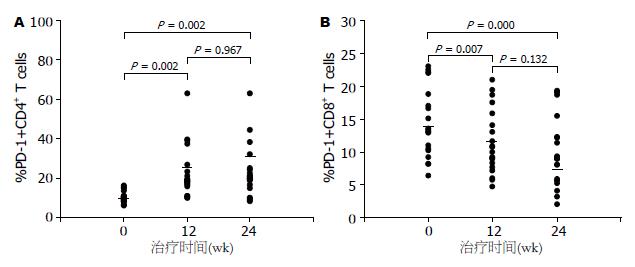
其阳性表达率波动在6.24%到63.5%之间, 平均14.64%±5.38%; 外周血总CD4+ T细胞PD-1阳性表达率波动在6.07%到16.19%之间, 平均为11.03%±2.83%, 都明显高于健康对照组(均P<0.05). 免疫清除期CHB外周血总CD8+ T细胞和CD4+ T细胞PD-1单细胞表达强度(MFI)分别为5.04±1.09与4.16±0.66, 健康对照为3.64±0.76与3.46±0.38, CHB组明显高于对照组(均P<0.05).
治疗12 wk时CD4+ T细胞PD-1表达阳性率明显升高, 由基线的11.03%±2.83%上升到25.03%±14.18%(P<0.01), 治疗12-24 wk期间CD4+ T细胞PD-1阳性率基本趋于稳定(25.03%±14.18% vs25.24%±14.22%)(图1A); Peg INF-α2b治疗期间CD8+ T细胞PD-1表达阳性率随着治疗时间呈现下降趋势, 基线到治疗12 wk时PD-1阳性CD8+ T细胞比例由14.64%±5.38%下降为9.84%±3.62%, 显著降低(P<0.01), 治疗12-24 wk期间CD8+ T细胞PD-1阳性率略有下降, 但未见统计学意义(图1B).
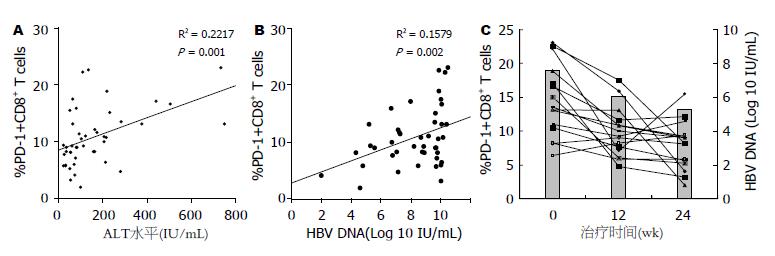
Peg IFN治疗基线T细胞PD-1表达水平同ALT水平之间未见明显相关性, 且在治疗结束时发生完全病毒学应答组和未获得组相比T细胞PD-1表达水平无明显差异(P>0.05). 然而, Peg IFN抗病毒治疗期间CD8+ T细胞PD-1表达阳性率却同ALT水平呈正相关(R2 = 0.22, P = 0.001)(图2A); 经单因素线性回归分析, IFN治疗期间CD8+ T细胞PD-1阳性率同病毒载量呈现正相关, 且具有统计学意义(R2 = 0.357, P = 0.002)(图2B). 另外, 治疗12 wk时同基线相比, 病毒载量水平明显下降, 同时CD8+ T细胞表面PD-1表达水平也发生明显变化(均P<0.05)见图2C; 但治疗12 wk到24 wk病毒载量水平下降幅度减弱, 同时CD8+ T细胞PD-1表达水平变化也明显减弱, 甚至个别病例还出现PD-1表达水平回升(P>0.05, 图2C).
基于IFN抗病毒期间前12 wk T细胞PD-1变化明显的发现, 我们进一步对IFN治疗基线到12 wk期间CD8+ T细胞PD-1表达阳性率变化对疗效预测作用进行了分析. CD8+ T细胞PD-1变化对疗效无明显预测作用(F = 1.43, P = 0.25).
本研究结果显示CHB患者免疫活动期T细胞表面PD-1表达水平较对照组明显升高. 抗病毒治疗诱导病毒载量水平明显下降的早期, CD8+ T细胞表面PD-1明显下降, 但CD4+ T细胞表面PD-1水平却明显升高. Evans et al对直接抑制HBV复制抗病毒药物治疗期间宿主T细胞表面PD-1表达研究中也发现[6-7], 在抗病毒治疗诱导病毒明显下降后, 可以见到CD8+ T细胞表面PD-1表达明显下降, 同时伴有功能恢复.
我们发现在IFN抗病毒治疗过程中CD4+ T细胞和CD8+ T细胞PD-1表达具有不同的模式, 且CD4+ T细胞PD-1表达同病毒载量水平之间呈现负相关, 该研究结果同Evans et al[7]的报道相悖, 原因可能是两个研究设计差异导致; IFN抗病毒治疗过程中虽然总体病毒载量水平随抗病毒时间呈现下降趋势, 但一些病例病毒载量水平基本未变, 甚至还有上升, 因此不能很好确定CD4+ T细胞PD-1表达同病毒载量变化之间的因果关系; 随着病毒水平下降, 无论是否发生eAg血清转换, CD8+ T细胞PD-1表达均明显下降, 但是未发现CD8+ T细胞PD-1表达水平下降同eAg血清转换之间具有相关性. Cooksley et al发现在阿德福韦酯抗病毒治疗患者, eAg转阴会伴随HBV DNA水平的明显下降, 及CD4+ T细胞功能恢复, 这些结果提示PD-1表达下降可能不足以完全恢复T细胞功能[8-10].
抗病毒治疗基线ALT水平对抗病毒疗效具有很好的预测作用[11-15]. 如果ALT是宿主针对HBV病毒免疫反应的标志, 那么在基线ALT水平和PD-1表达之间就应该存在一定的相关性, 本研究却未发现存在这种关系. 可能部分源于不同的患者基线PD-1表达水平存在很大差异. 抗病毒治疗期间随着病毒水平下降, ALT水平复常, CD8+ T细胞PD-1表达也呈现下降趋势, 并同ALT水平变化之间呈正相关性, 这在一定程度上提示: ALT可能更多的是代表病毒复制启动的针对肝细胞的炎症反应程度.
总之, 本研究结果更进一步明确了HBV复制同T细胞功能缺陷的关系. 病毒载量水平和CD8+ T细胞PD-1表达之间具有明显相关性, 抗病毒治疗诱导的病毒载量水平下降可导致CD8+ T细胞PD-1表达的明显下降.
在慢性HBV感染进程中, 宿主免疫反应特别是细胞免疫反应在病毒清除中起重要作用. 慢性乙型肝炎(CHB)患者宿主免疫特点为严重的HBV特异性T细胞功能缺陷, 其中程序型坏死因子1(PD-1)是CHB进程中T细胞功能缺陷原因之一.
李靖, 副教授, 中国人民解放军第三军医大学附属新桥医院肝胆外科
Evans et al对直接抑制HBV复制抗病毒药物治疗期间宿主T细胞表面PD-1表达研究中也发现, 在抗病毒治疗诱导病毒明显下降后, 可以见到CD8+ T细胞表面PD-1表达明显下降, 同时伴有功能恢复.
本研究结果更进一步明确了HBV复制同T细胞功能缺陷的关系. 病毒载量水平和CD8+ T细胞PD-1表达之间具有明显相关性, 抗病毒治疗诱导的病毒载量水平下降可导致CD8+ T细胞PD-1表达的明显下降.
本文本研究立题有一定创新, 指标稍显单一, 若能设立不同抗病毒治疗对CHB患者PD-1的影响, 可能更有临床意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Barber DL, Wherry EJ, Masopust D, Zhu B, Allison JP, Sharpe AH, Freeman GJ, Ahmed R. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 2006;439:682-687. [PubMed] |
| 2. | Klenerman P, Hill A. T cells and viral persistence: lessons from diverse infections. Nat Immunol. 2005;6:873-879. [PubMed] |
| 3. | Day CL, Kaufmann DE, Kiepiela P, Brown JA, Moodley ES, Reddy S, Mackey EW, Miller JD, Leslie AJ, DePierres C. PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression. Nature. 2006;443:350-354. [PubMed] |
| 4. | Petrovas C, Casazza JP, Brenchley JM, Price DA, Gostick E, Adams WC, Precopio ML, Schacker T, Roederer M, Douek DC. PD-1 is a regulator of virus-specific CD8+ T cell survival in HIV infection. J Exp Med. 2006;203:2281-2292. [PubMed] |
| 5. | Trautmann L, Janbazian L, Chomont N, Said EA, Gimmig S, Bessette B, Boulassel MR, Delwart E, Sepulveda H, Balderas RS. Upregulation of PD-1 expression on HIV-specific CD8+ T cells leads to reversible immune dysfunction. Nat Med. 2006;12:1198-1202. [PubMed] |
| 6. | Ye P, Weng ZH, Zhang SL, Zhang JA, Zhao L, Dong JH, Jie SH, Pang R, Wei RH. Programmed death-1 expression is associated with the disease status in hepatitis B virus infection. World J Gastroenterol. 2008;14:4551-4557. [PubMed] |
| 7. | Evans A, Riva A, Cooksley H, Phillips S, Puranik S, Nathwani A, Brett S, Chokshi S, Naoumov NV. Programmed death 1 expression during antiviral treatment of chronic hepatitis B: Impact of hepatitis B e-antigen seroconversion. Hepatology. 2008;48:759-769. [PubMed] |
| 8. | Cooksley H, Chokshi S, Maayan Y, Wedemeyer H, Andreone P, Gilson R, Warnes T, Paganin S, Zoulim F, Frederick D. Hepatitis B virus e antigen loss during adefovir dipivoxil therapy is associated with enhanced virus-specific CD4+ T-cell reactivity. Antimicrob Agents Chemother. 2008;52:312-320. [PubMed] |
| 9. | Lau GK, Cooksley H, Ribeiro RM, Powers KA, Shudo E, Bowden S, Hui CK, Anderson J, Sorbel J, Mondou E. Impact of early viral kinetics on T-cell reactivity during antiviral therapy in chronic hepatitis B. Antivir Ther. 2007;12:705-718. [PubMed] |
| 10. | You J, Sriplung H, Geater A, Chongsuvivatwong V, Zhuang L, Li YL, Lei H, Liu J, Chen HY, Tang BZ. Impact of viral replication inhibition by entecavir on peripheral T lymphocyte subpopulations in chronic hepatitis B patients. BMC Infect Dis. 2008;8:123. [PubMed] |
| 11. | Perrillo RP, Liaw YF, Schiff ER, Heathcote EJ, Atkins M, Gardner SD. Predictors of HBeAg loss after lamivudine treatment for chronic hepatitis B. Hepatology. 2002;36:186-194 DOI. |
| 13. | Hou J, Yin YK, Xu D, Tan D, Niu J, Zhou X, Wang Y, Zhu L, He Y, Ren H. Telbivudine versus lamivudine in Chinese patients with chronic hepatitis B: Results at 1 year of a randomized, double-blind trial. Hepatology. 2008;47:447-454. [PubMed] |
| 14. | Tseng TC, Liu CJ, Wang CC, Chen PJ, Lai MY, Kao JH, Chen DS. A higher alanine aminotransferase level correlates with earlier hepatitis B e antigen seroconversion in lamivudine-treated chronic hepatitis B patients. Liver Int. 2008;28:1034-1041. [PubMed] |
| 15. | Tseng TC, Liu CJ, Wang CC, Chen PJ, Lai MY, Chen DS, Kao JH. Association of baseline viral factors with response to lamivudine therapy in chronic hepatitis B patients with high serum alanine aminotransferase levels. Antivir Ther. 2009;14:203-210. [PubMed] |