修回日期: 2009-09-23
接受日期: 2009-09-28
在线出版日期: 2009-10-08
目的: 观察白藜芦醇对重症急性胰腺炎(SAP)胰腺细胞凋亡的影响, 探讨线粒体凋亡通路及线粒体DNA修复酶OGG1与SAP腺泡细胞凋亡的关系.
方法: 30只SD大鼠随机分为假手术组(Sham组, 只行开腹术, n = 10), SAP模型组(SAP组, 胆管逆行性注射牛黄胆酸钠制备SAP模型, n = 10), 白藜芦醇治疗组(Res组, SAP模型制作成功后, 注射白藜芦醇溶液, n = 10). 测定各组血清淀粉酶, caspase-3, -9活性, 高压液相色谱法测定线粒体DNA 8-氧鸟嘌呤(8-oxodG)含量, 罗丹明123法测定线粒体膜电位, 流式细胞法检测胰腺腺泡细胞凋亡, Western blot法测定细胞色素C释放及线粒体OGG1蛋白表达, 并对胰腺组织进行病理学评分.
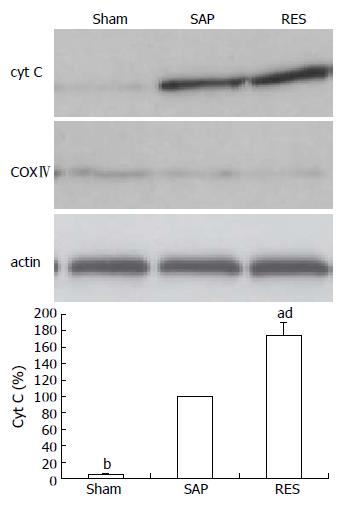
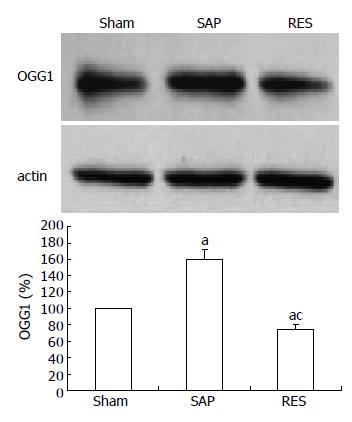
结果: Res组与SAP组比较, 血清胰淀粉酶、线粒体膜电位、线粒体OGG1蛋白表达量及胰腺病理损害评分显著降低(4761.98±501.45 vs 7428.91±526.49, 18.42±2.04 vs 22.01±2.93, 73.97±6.49 vs 159.46±12.85, 5.74±0.95 vs 12.95±1.54, 均P<0.05). 胰腺腺泡细胞凋亡指数、线粒体细胞色素C释放、线粒体DNA 8-oxodG含量及caspase-3, -9的活性显著升高(19.63±2.07 vs 12.45±1.93, 174.31±15.93 vs 100±0.00, 0.0590±0.074 vs 0.0336±0.0061, 2.37±0.35 vs 1.95±0.19, 2.07±0.25 vs 1.62±0.15, 均P<0.05).
结论: 白藜芦醇通过下调胰腺腺泡细胞线粒体DNA修复酶OGG1, 增加SAP胰腺腺泡细胞凋亡以减轻胰腺组织病理损害, 对SAP具有治疗意义.
引文著录: 侯伊玲, 薄海, 刘子泉, 夏时海. 白藜芦醇下调线粒体DNA修复酶对重症急性胰腺炎大鼠胰腺腺泡细胞凋亡的影响. 世界华人消化杂志 2009; 17(28): 2892-2898
Revised: September 23, 2009
Accepted: September 28, 2009
Published online: October 8, 2009
AIM: To investigate the relationship among pancreatic acinar cell apoptosis, mitochondrial apoptosis pathway and mitochondrial DNA repair enzyme in severe acute pancreatitis (SAP).
METHODS: Thirty Sprague-Dawley rats were randomly divided into sham operation group (n = 10), model control group (SAP rats induced by retrograde injection of sodium taurocholate, n = 10), and resveratrol treatment group (SAP rats injected with resveratrol, n = 10). Serum amylase and caspase-3 and -9 activity in pancreatic acinar cells were detected. The level of 8-oxodeoxyguanosine (8-oxodG) in mitochondrial DNA (mtDNA) was measured by high-pressure liquid chromatography (HPLC). Mitochondrial cross-membrane potential (ΔΨ) was measured by monitoring the fluorescence spectrum of rhodamine 123. Pancreatic acinar cell apoptosis was detected by flow cytometry. Cytochrome c release and mitochondrial 8-oxoguanine DNA glycosylase 1 (OGG1) protein expression were determined by Western blot. Pathological damage of pancreatic tissue was scored.
RESULTS: Serum amylase level, mitochondrial cross-membrane potential, mitochondrial OGG1 protein expression level and pancreatic pathological score were lower in the resveratrol treatment group than in the model control group (4761.98 ± 501.45 vs 7428.91 ± 526.49, 18.42 ± 2.04 vs 22.01 ± 2.93, 73.97 ± 6.49 vs 159.46 ± 12.85, and 5.74 ± 0.95 vs 12.95 ± 1.54, respectively; all P < 0.05). Pancreatic acinar cell apoptosis index, cytochrome c release, 8-oxodG level and caspase-3 and -9 activity were higher in the resveratrol treatment group than in the model control group (19.63 ± 2.07 vs 12.45 ± 1.93, 174.31 ± 15.93 vs 100 ± 0.00, 0.0590 ± 0.074 vs 0.0336 ± 0.0061, 2.37 ± 0.35 vs 1.95 ± 0.19, and 2.07 ± 0.25 vs 1.62 ± 0.15, respectively; all P < 0.05).
CONCLUSION: Resveratrol can reduce pancreatic pathological damage in SAP rats possibly by downregulating mitochondrial OGG1 protein expression and inducing pancreatic acinar cell apoptosis.
- Citation: Hou YL, Bo H, Liu ZQ, Xia SH. Resveratrol induces mitochondrial DNA repair enzyme downregulation and promotes pancreatic acinar cell apoptosis in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2892-2898
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2892.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2892
重症急性胰腺炎(severe acute pancreatitis, SAP)病情危重, 并发症多, 病死率高. 胰腺腺泡细胞损伤释放胰酶和炎症介质是其病情危重的关键因素. 近年来人们在SAP发病机制方面的研究注意到细胞凋亡与SAP病程及预后密切相关, 发现SAP的严重程度与胰腺细胞的凋亡呈负相关[1]. 诱导胰腺细胞凋亡可改善胰腺炎的病变发展, 而抑制胰腺细胞凋亡可加重胰腺炎的病变发展[2]. 提示细胞凋亡可能是SAP时宿主自身的保护性反应, 诱导损伤的胰腺细胞凋亡可能成为治疗SAP的一种有效策略. 白藜芦醇(3', 4', 5-三羟基-反-均二苯代乙烯)是中药大黄、虎杖等的活性成分, 具有抗炎、抗癌、诱导肿瘤细胞凋亡等多种药理特性, 其可通过多种途径对SAP发挥治疗效应[3]. 最近, Madan et al[4]报道, 白藜芦醇可通过线粒体途径诱导肿瘤细胞凋亡. 我们通过建立大鼠SAP模型, 观察白藜芦醇对SAP胰腺腺泡细胞凋亡的影响以及线粒体相关通路的变化规律, 从而探讨其治疗SAP的机制.
清洁级健康Sprague-Dawley大鼠30只, ♂, 体质量238-264 g, 由中国人民解放军军事医学科学院实验动物中心提供, 饲养温度为18℃-24℃, 相对湿度为55%-65%. 白藜芦醇、牛磺胆酸钠、8-oxodG标准品、罗丹明123(Sigma公司), caspase-3, -9 Colorimetric Assay Kit试剂盒(江苏碧云天生物技术研究所). 血清淀粉酶试剂盒(北京科美东雅生物技术有限公司). 线粒体DNA提取试剂盒(上海杰美基因医药科技公司). 细胞色素C、COXⅣ、OGG1和actin抗体、ECL发光底物(Santa Cruz公司). 辣根过氧化物酶标记的羊抗兔IgG(H+L)(TBD公司).
1.2.1 分组及SAP模型制备: 实验大鼠随机分为白藜芦醇治疗组(RES组, n = 10)、SAP模型组(SAP组, n = 10)和假手术对照组(Sham组, n = 10). 各组大鼠术前禁食24 h, 禁水6 h. (1)Sham组: 仅进行开腹手术, 轻轻翻动十二指肠和胰腺数次后关腹; (2)SAP组: 按照本组前期方法[5], 腹腔注射4 g/L戊巴比妥拉钠(60 mg/kg体质量)腹腔麻醉, 上腹部正中切口进腹, 找到大鼠十二指肠和胆胰管后, 用无创血管夹夹闭胆胰管肝端, 用钝头针头经十二指肠浆膜层行胆胰管逆行穿刺, 穿刺成功后, 微量注射器逆行胆胰管内注射50 g/L牛磺胆酸钠(1 mL/kg体质量), 推注速度0.20 mL/min, 推药后用无创血管夹夹闭胆胰管入十二指肠处, 确认大鼠胃、十二指肠间的胰腺组织出现异常, 颜色变为砖红色或出现出血点后拔出针头, 去除血管夹后关腹; (3)RES组: 具体操作同SAP组, 在SAP模型制备成功后5 min内将10 g/L白藜芦醇溶液(1 mL/kg体质量)通过阴茎背静脉注入. 术后15 min Sham组和SAP组以与RES组相同方式注射等体积无菌生理盐水. 制模后6 h大鼠麻醉下打开腹腔, 腹主动脉采血, 静置后离心, 留取血清-20℃保存待测淀粉酶; 迅速切取部分胰腺组织, 其中50 mg, -80℃保存待Western blot实验, 其余立即分离胰腺腺泡细胞和线粒体, 检测相关指标; 切取剩余部分胰腺组织, 置于10%中性磷酸盐缓冲液-甲醛中固定, 石蜡包埋.
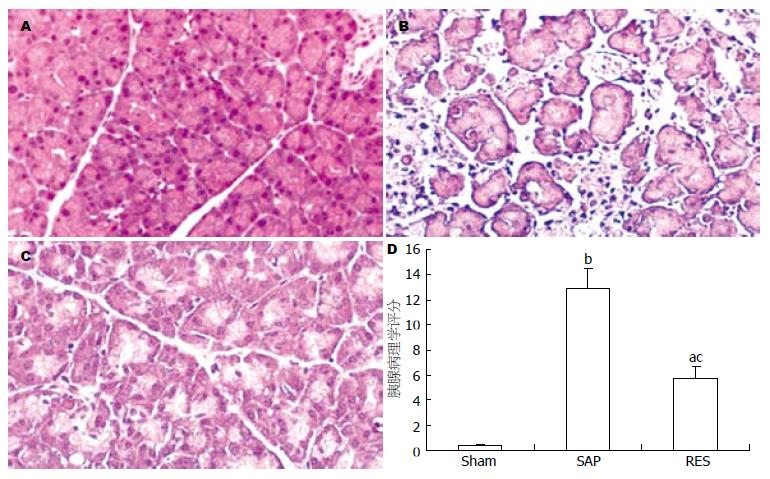
1.2.2 指标检测: (1)血清淀粉酶测定: 严格按照试剂盒说明书操作, CX9全自动生化分析仪(Beckman公司)检测血清淀粉酶. (2)胰腺组织病理学评分: 胰腺组织蜡块行4 μm连续切片, 常规苏木素-伊红(HE)染色. 请两名病理医师按双盲法分别阅片, 每片随机选取5个高倍视野(200 倍), 参照Sha et al[6]镜下病理评分标准对5个单项(水肿、炎性细胞浸润、脂肪坏死、实质坏死、出血灶)进行评分, 5项之和为该标本的病理学评分. (3)胰腺腺泡细胞提取: 参照文献[7], 新鲜胰腺组织迅速放入由4% BSA加0.2 g/L Ⅺ型胶原酶配成的消化液5 mL中, 眼科剪剪碎胰组织, 消化10 min后离心3 min(500 r/min), 弃上清, 收集沉积物PBS液反复清洗3次, 通过200目的铜网过滤和离心(100 g离心)共3次分离得到胰腺腺泡细胞. (4)胰腺腺泡细胞线粒体制备: 参照本组前期方法[8], 将胰腺腺泡细胞800 g离心5 min. 弃沉淀, 上清液于12 000 g离心10 min. 沉淀用介质(120 mmol/L KCl, 20 mmol/L Hepes, 5 mmol/L MgCl2, 1 mmol/L EDTA, pH7.4)悬浮, 以上操作均在冰浴中进行. 线粒体蛋白含量用考马斯亮蓝法测定. (5)流式细胞法检测胰腺腺泡细胞凋亡指数: 取胰腺腺泡细胞, 用冷PBS调至细胞为5×106/L. 加入0.8 mL含RNase的碘化丙啶(PI), 4℃避光15 min. 流式细胞仪检测腺泡细胞凋亡率. (6)线粒体膜电位(ΔΨ)测定: 参照本组前期方法[8], 采用罗丹明123(Rhodamine123)作为荧光探针测定. 在2 mL反应介质(0.25 mol/L Succose, 3.0 mmol/L Hepes, 0.5 mmol/L EDTA, pH7.4)内加入2 μL的0.8 μmol/L Rhodamine123, 荧光分光光度计上设定激发波长500 nm、发射波长525 nm, 检测基础荧光值F1, 测定加入0.5 mg线粒体, 25℃孵育15 min, 测定荧光值F2, 计算ΔF = (F1-F2), 即用线粒体跨膜电位淬灭Rhodamine123的荧光强度量反映ΔΨ. (7)线粒体DNA 8-氧鸟嘌呤(8-oxodG)含量测定: 严格按照试剂盒说明书提取mtDNA. 参照文献[9], 高效液相色谱法(HPLC)检测mtDNA中8-oxodG含量. 色谱柱采用粒径4 μm的C18反相柱(250 mm×4.6 mm), 流动相采用6%甲醇, 12.5 mmol/L柠檬酸, 30 mmol/L氢氧化钠, 25 mmol/L醋酸钠, 10 mmol/L醋酸, 流速0.8 mL/min, 检测波长为260 nm. 称取8-oxodG标准品制备标准应用液, 上述同样条件绘制标准曲线. 计算各样品中8-oxodG的浓度(mg/L). (8)caspase-3, -9活性测定: 严格按照按试剂盒说明书操作, 将提取的胰腺腺泡细胞加入10倍体积的低张力缓冲液, 冰上裂解20 min, 4℃ 3000 g离心5 min, 取上清, 4℃ 10 000 g离心20 min, 取上清, 考马斯亮蓝法测定蛋白含量, 280 nm下读取吸光度值. 再加入1 mL蛋白分析缓冲液和20 μL caspase底物, 37℃避光水浴2 h, 405 nm下读取吸光度值. caspase活性 = A405nm/A280nm.
1.2.3 Western blot法检测细胞色素C的释放: 参照文献[10], 提取细胞质(含细胞核)将提取的胰腺腺泡细胞悬液低速离心于2000 g离心5 min, 使细胞沉淀, 加入500 μL细胞裂解液(250 mmol/L蔗糖, 50 mmol/L Tris-HCl, 1 mmol/L EDTA, 1 mmol/L EGTA, 1 mmol/L二硫苏糖醇, 1 mmol/L PMSF, pH7.4), 冰上裂解30 min, 超声(3-5 s/次, 3次)破碎细胞, 冰浴5 min, 4℃ 10 000 g离心20 min, 取上清, 考马斯亮蓝法测定蛋白含量. 10 µg蛋白质样品经15% SDS-PAGE分离后, 转移于PVDF膜上. 1:1000兔抗大鼠细胞色素C抗体4℃静置孵育过夜, PBS洗涤3次, 再以1:1000辣根过氧化物酶标记的羊抗兔 IgG(H+L)抗体室温孵育1 h, PBS充分洗涤后, 在暗室使用ECL试剂盒发光显影, X光胶片压片曝光. 采用ChampGel 2000凝胶系统分析软件, 扫描定量各条带的相对灰度值, 以SAP组条带灰度值为100%, 其他两组条带灰度值与对照组条带灰度值的比值, 即为其相对表达量(%).
1.2.4 Western blot法检测腺泡细胞线粒体OGG1蛋白表达量: 将提取的胰腺腺泡细胞或线粒体根据样品浓度不同加入2×SDS上样缓冲液, 混合液100℃加热5 min, 冰浴冷却. SDS-PAGE凝胶电泳及Western杂交条件同方法1.2.3. 以Sham组条带灰度值为100%, 其他两组条带灰度值与Sham条带灰度值的比值, 即为其相对表达量(%).
统计学处理 采用SPSS11.0统计分析软件进行处理, 所有结果均以mean±SD表示, 样本间均数比较采用单因素方差分析,P<0.05为具有统计学意义.
与Sham组比较, SAP组和RES组血浆淀粉酶及线粒体DNA 8-oxodG含量均显著升高, 而ΔΨ显著降低. 与SAP组比较, RES组血浆淀粉酶水平及ΔΨ显著降低, 而8-oxodG含量均显著升高(表1).
Sham组胰腺未见炎性改变, 腺泡细胞形态结构正常, 排列紧密. SAP组胰腺大量炎性细胞浸润, 可见部分腺泡结构消失, 小叶结构破坏, 细胞核大量固缩、溶解, 实质出血, 血管扩张, 可见片状脂肪变性、坏死. RES组胰腺组织充血、水肿、炎症细胞浸润、脂肪变性等均较SAP组明显减轻(图1).
与Sham组比较, SAP组和RES组caspase-3, -9活性及胰腺腺泡细胞凋亡率显著升高. 与SAP组比较, 以上指标均显著升高(表2).
Sham组无明显细胞色素C的释放, 蛋白条带仅有清淡显影. SAP组及RES组可见明显细胞色素C释放进入胞质, 且RES组更为显著. 3组胞质中基本无线粒体内膜蛋白COXⅣ检出, 表明本研究提纯的胞质中基本不含线粒体(图2).
与Sham组比较, SAP组OGG1蛋白表达量显著升高(P<0.05), 而RES组OGG1蛋白表达量显著降低(P<0.05, 图3).
SAP发生时最早的病理变化是出现在胰腺腺泡内, 而腺泡细胞的死亡方式与胰腺炎的病情变化有密切的关系[11]. 凋亡和坏死均是细胞受创后的死亡方式, 他们的本质区别在于凋亡不释放细胞内容物和炎症介质, 不引起炎症反应, 而坏死引起强烈炎症反应[12]. 目前较多实验均支持这样一种假说, 即胰腺腺泡细胞的凋亡与胰腺炎的严重程度呈负相关[1]. Luge et al发现抑制腺泡细胞凋亡后, 坏死细胞明显增多, 胰腺炎的严重程度明显加重[13]. 纪涛 et al[14]发现, TNF-α抑制剂可通过上调caspase-3蛋白表达促进SAP胰腺细胞凋亡, 明显改善炎症反应和组织病理学评分. 以上提示诱导胰腺细胞凋亡可能是治疗SAP的一种有效途径.
线粒体异常与胰腺炎的发病密切相关, 线粒体通过影响腺泡细胞钙稳态、能量代谢紊乱及产生活性氧等途径参与SAP的发生及预后[15]. 线粒体是细胞凋亡调控的活动中心. 是细胞凋亡信号途径的重要感受者与放大者. 在细胞凋亡早期, 核染色体DNA还未改变之前, 线粒体即已出现结构和功能的变化, 说明线粒体在细胞凋亡过程中起重要的早期启动作用. 研究表明, 线粒体细胞色素C的释放是凋亡重要的早期事件[16]. 在本研究中, 与Sham组比较, SAP组胰腺腺泡细胞凋亡率增加, 线粒体Δψ显著降低, 细胞色素C释放增加, caspase-3及caspase-9活化增加. 这与Sung et al[17]的研究结果基本一致, 他们的研究还发现, 胰腺腺泡细胞ATP水平与P53、BAX、caspase-3, 9等凋亡因子的表达水平负相关. 这表明线粒体功能失调、线粒体细胞色素C 的释放, 激活caspase-3这条凋亡通路参与了SAP胰腺腺泡细胞凋亡. 研究表明, 病理条件下受损的腺泡细胞发生凋亡可以减少因坏死释放的活性胰酶, 减轻炎症介质的瀑布样级联释放, 这可能是急性胰腺炎时机体的自我保护机制之一[18].
线粒体DNA(mtDNA)是具有复制、转录、翻译等半自主功能的细胞器DNA, 有13种ATP酶和细胞色素氧化酶的编码基因. mtDNA无内含子, 因此任何突变都会影响到其编码的重要功能基因. mtDNA缺乏组蛋白保护, 复制频率高, 且离活性氧(ROS)产生位点极近, 因此对内外环境改变极为敏感. mtDNA突变引起线粒体功能紊乱, 活性氧产生增加, 线粒体膜电位或线粒体膜通透性发生改变, 从而引起细胞凋亡[19]. 在诸多类型的氧化碱基修饰中, 8-氧鸟嘌呤(8-oxo-7, 8-dihydroguanine, 8-oxodG)是最常见也是在诱发突变中有重要意义的一种碱基的氧化修饰. 8-oxodG可以引起复制过程中的dAMP的错配, 从而导致C/G→A/T的颠换突变, 因此与衰老、肿瘤、退行性病变等许多疾病相关[20]. 本研究中, SAP组胰腺腺泡细胞线粒体8-oxodG含量显著高于Sham组, 表明mtDNA氧化损伤参与了SAP的病理过程. 近年来发现, 线粒体内亦存在DNA损伤修复机制, mtDNA中8-oxodG的修复主要通过碱基切除修复(BER)途径[21]. BER过程中首先通过DNA糖基化酶特异性识别氧化碱基. 8-氧鸟嘌呤DNA糖基化酶(8-oxoguanine DNA glycosylase, OGG1)是哺乳动物线粒体最主要的8-oxodG酶[22]. OGG1缺陷小鼠成纤维细胞mtDNA 8-oxodG含量比野生型小鼠高8倍[23]. 线粒体特异性OGG1-α基因突变可导致包括胰腺癌在内的多种恶性肿瘤发生几率增加[24]. 一般认为mtDNA损伤修复是一有益的过程, 对维护细胞正常的生物学功能非常关键. 但近年来的研究表明, mtDNA修复酶表达过高亦会引起恶性病理变化. Li et al[25]研究发现, 对放射治疗抵抗的骨肉瘤其BER另一个关键限速酶脱嘌呤脱嘧啶核酸内切酶-1(APE1)线粒体转位出现较早, 且增加幅度较大. Phadnis et al[26]报道, 线粒体的另外一种糖基化酶Ntg1p过表达并未降低酵母mtDNA点突变率, 反而增加了mtDNA中致突变中介物的表达. mtDNA修复对衰老及退行性疾病的意义尚在广泛争论中. 我们认为在不同的组织, 不同的病程中, mtDNA修复的效应和意义存在差异. 在本研究中, SAP胰腺腺泡细胞线粒体OGG1表达显著升高(P<0.01), 这可能与8-oxodG升高造成组织损伤后激活了机体自我修复机制有关. 抑制胰腺细胞凋亡可加重胰腺炎的病变发展, 因而本研究中OGG1表达升高抑制了腺泡细胞凋亡, 在后期反而增加了SAP的严重程度. 最近Ueta et al[27]的研究表明, 线粒体OGG1过表达增加了口腔鳞癌细胞对γ射线放疗的抵抗性, 而通过RNA干扰技术抑制OGG1、DNA聚合酶γ(POLG)及线粒体转录因子A(Tfam)等线粒体DNA修复相关物质, 可通过促进口腔鳞癌细胞凋亡提高肿瘤放疗效果. 我们推测在SAP治疗中, 抑制线粒体DNA修复系统可能是一个有效的措施.
临床实践及实验研究表明, 白藜芦醇可通过多种机制改善SAP中胰腺的病理损伤, 其中一个重要机制是通过诱导胰腺腺泡细胞凋亡[3,28]. 研究发现, 白藜芦醇能通过上调Bax、Bcl-2及FasL蛋白的表达, 在SAP早期诱导胰腺细胞凋亡[29]. 但目前对于白黎芦醇诱导SAP胰腺腺泡细胞凋亡的具体机制尚不清楚. 本研究中, RES组胰腺腺泡细胞凋亡率显著高于SAP组和Sham组, 线粒体Δψ显著降低, 细胞色素C释放和caspase-3活化进一步增加, 胰腺病理损害明显减轻. 这表明白藜芦醇对重症急性胰腺炎具有治疗作用, 且这种治疗作用可能与通过线粒体凋亡途径促进胰腺细胞凋亡有关. 进一步研究表明, RES组腺泡细胞线粒体8-oxodG较SAP组进一步升高, 而OGG1表达显著低于SAP组. Robb et al[30]报道, 白藜芦醇作用人肺成纤维细胞72h后, 线粒体DNA修复酶中的POLGβ活性显著降低, 这与本研究的结论一致. 白藜芦醇可调控多种组织细胞凋亡[31]. Kao et al[32]报道, 白藜芦醇可通过促进畸胎瘤CD133细胞凋亡, 增加其放疗敏感性. 最近的研究表明, 白藜芦醇可通过抑制JAK/STAT通路和增强线粒体凋亡通路, 诱导人表皮样癌细胞凋亡, 发挥其治疗作用[4]. 因而我们推测, 白藜芦醇可能通过抑制OGG1等线粒体DNA修复酶的修复能力, 增加mtDNA损伤, 引起线粒体功能障碍, 从而激活线粒体凋亡途径, 以诱导损伤胰腺腺泡细胞凋亡, 从而达到对SAP的治疗效果. 抑制线粒体DNA修复系统有望成为治疗SAP的新靶点. 白藜芦醇下调OGG1表达的信号通路以及对于其他线粒体修复酶的影响尚需进一步研究.
重症急性胰腺炎(SAP)病情危重, 病死率高. 近年来研究表明细胞凋亡与SAP病程及预后密切相关, SAP的严重程度与胰腺细胞的凋亡呈负相关, 诱导损伤的胰腺细胞凋亡可能成为治疗SAP的一种有效策略. 基础研究及临床实践表明, 白藜芦醇可通过多种途径对SAP发挥治疗效应. 有报道表明白藜芦醇可通过线粒体途径诱导肿瘤细胞凋亡, 因而通过线粒体途径诱导胰腺腺泡细胞凋亡可能是白藜芦醇对SAP治疗的一种途径.
宋振顺, 教授, 中国人民解放军第四军医大学西京医院肝胆外科; 陈海龙, 教授, 大连医科大学附属第一医院院办
诱导损伤的胰腺细胞凋亡治疗是治疗SAP的重要途径, 而线粒体结构功能与细胞凋亡发生密切相关, 白藜芦醇对相关通路的作用有待进一步研究.
前期研究表明, 白藜芦醇可通过包括诱导胰腺腺泡细胞凋亡在内的多种机制改善SAP中胰腺的病理损伤. 如白藜芦醇能通过上调Bax、Bcl-2及FasL蛋白的表达, 在SAP早期诱导胰腺细胞凋亡. 近几年线粒体DNA修复系统逐渐为研究者认识并重视, 其与细胞凋亡发生在肿瘤细胞中有报道, 但在SAP发生及治疗中的变化规律尚未见报道.
本研究发现, 白藜芦醇可能通过抑制OGG1等线粒体DNA修复酶的修复能力, 增加mtDNA损伤, 引起线粒体功能障碍, 从而激活线粒体凋亡途径, 以诱导损伤胰腺腺泡细胞凋亡, 从而达到对SAP的治疗效果.
本研究进一步证明并揭示白藜芦醇对SAP的治疗作用及具体机制, 提出抑制线粒体DNA修复系统可能是治疗SAP的新靶点, 为临床正确使用白藜芦醇及开发新药提供实验依据.
本研究设计合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Fortunato F, Bürgers H, Bergmann F, Rieger P, Büchler MW, Kroemer G, Werner J. Impaired autolysosome formation correlates with Lamp-2 depletion: role of apoptosis, autophagy, and necrosis in pancreatitis. Gastroenterology. 2009;137:350-360, 360.e1-360.e5. [PubMed] |
| 3. | Szabolcs A, Varga IS, Varga C, Berkó A, Kaszaki J, Letoha T, Tiszlavicz L, Sári R, Lonovics J, Takács T. Beneficial effect of resveratrol on cholecystokinin-induced experimental pancreatitis. Eur J Pharmacol. 2006;532:187-193. [PubMed] |
| 4. | Madan E, Prasad S, Roy P, George J, Shukla Y. Regulation of apoptosis by resveratrol through JAK/STAT and mitochondria mediated pathway in human epidermoid carcinoma A431 cells. Biochem Biophys Res Commun. 2008;377:1232-1237. [PubMed] |
| 6. | Sha H, Ma Q, Jha RK, Xu F, Wang L, Wang Z, Zhao Y, Fan F. Resveratrol ameliorates hepatic injury via the mitochondrial pathway in rats with severe acute pancreatitis. Eur J Pharmacol. 2008;601:136-142. [PubMed] |
| 8. | Bo H, Jiang N, Ma G, Qu J, Zhang G, Cao D, Wen L, Liu S, Ji LL, Zhang Y. Regulation of mitochondrial uncoupling respiration during exercise in rat heart: role of reactive oxygen species (ROS) and uncoupling protein 2. Free Radic Biol Med. 2008;44:1373-1381. [PubMed] |
| 9. | Takai D, Park SH, Takada Y, Ichinose S, Kitagawa M, Akashi M. UV-irradiation induces oxidative damage to mitochondrial DNA primarily through hydrogen peroxide: analysis of 8-oxodGuo by HPLC. Free Radic Res. 2006;40:1138-1148. [PubMed] |
| 10. | 李 光明, 谢 青, 周 霞秋, 俞 红, 郭 清, 廖 丹, 李 定国. 牛磺酸脱氧胆酸损伤线粒体诱导HepG2细胞凋亡. 世界华人消化杂志. 2003;11:1148-1151. [DOI] |
| 11. | Yu JH, Seo JY, Kim KH, Kim H. Differentially expressed proteins in cerulein-stimulated pancreatic acinar cells: implication for acute pancreatitis. Int J Biochem Cell Biol. 2008;40:503-516. [PubMed] |
| 12. | Algül H, Treiber M, Lesina M, Nakhai H, Saur D, Geisler F, Pfeifer A, Paxian S, Schmid RM. Pancreas-specific RelA/p65 truncation increases susceptibility of acini to inflammation-associated cell death following cerulein pancreatitis. J Clin Invest. 2007;117:1490-1501. [PubMed] |
| 13. | Lugea A, Nan L, French SW, Bezerra JA, Gukovskaya AS, Pandol SJ. Pancreas recovery following cerulein-induced pancreatitis is impaired in plasminogen-deficient mice. Gastroenterology. 2006;131:885-899. [PubMed] |
| 14. | 纪 涛, 汤 志刚, 黄 强, 许 戈良, 陈 炯, 李 建生. TNF-α抑制剂对重症急性胰腺炎细胞凋亡及Caspase-3表达的影响. 世界华人消化杂志. 2008;16:3324-3327. [DOI] |
| 15. | Mukherjee R, Criddle DN, Gukovskaya A, Pandol S, Petersen OH, Sutton R. Mitochondrial injury in pancreatitis. Cell Calcium. 2008;44:14-23. [PubMed] |
| 16. | Halangk W, Lerch MM. A unique pancreatic mitochondrial response to calcium and its role in apoptosis. Gut. 2009;58:328-330. [PubMed] |
| 17. | Sung KF, Odinokova IV, Mareninova OA, Rakonczay Z Jr, Hegyi P, Pandol SJ, Gukovsky I, Gukovskaya AS. Prosurvival Bcl-2 proteins stabilize pancreatic mitochondria and protect against necrosis in experimental pancreatitis. Exp Cell Res. 2009;315:1975-1989. [PubMed] |
| 18. | Zhang XP, Chen L, Hu QF, Tian H, Xu RJ, Wang ZW, Wang KY, Cheng QH, Yan W, Li Y. Effects of large dose of dexamethasone on inflammatory mediators and pancreatic cell apoptosis of rats with severe acute pancreatitis. World J Gastroenterol. 2007;13:5506-5511. [PubMed] |
| 19. | Liu CY, Lee CF, Hong CH, Wei YH. Mitochondrial DNA mutation and depletion increase the susceptibility of human cells to apoptosis. Ann N Y Acad Sci. 2004;1011:133-145. [PubMed] |
| 20. | Nakamoto H, Kaneko T, Tahara S, Hayashi E, Naito H, Radak Z, Goto S. Regular exercise reduces 8-oxodG in the nuclear and mitochondrial DNA and modulates the DNA repair activity in the liver of old rats. Exp Gerontol. 2007;42:287-295. [PubMed] |
| 21. | Druzhyna NM, Wilson GL, LeDoux SP. Mitochondrial DNA repair in aging and disease. Mech Ageing Dev. 2008;129:383-390. [PubMed] |
| 22. | Akbari M, Otterlei M, Peña-Diaz J, Krokan HE. Different organization of base excision repair of uracil in DNA in nuclei and mitochondria and selective upregulation of mitochondrial uracil-DNA glycosylase after oxidative stress. Neuroscience. 2007;145:1201-1212. [PubMed] |
| 23. | Bacsi A, Chodaczek G, Hazra TK, Konkel D, Boldogh I. Increased ROS generation in subsets of OGG1 knockout fibroblast cells. Mech Ageing Dev. 2007;128:637-649. [PubMed] |
| 24. | Trapp C, McCullough AK, Epe B. The basal levels of 8-oxoG and other oxidative modifications in intact mitochondrial DNA are low even in repair-deficient (Ogg1(-/-)/Csb(-/-)) mice. Mutat Res. 2007;625:155-163. [PubMed] |
| 25. | Li MX, Wang D, Zhong ZY, Xiang DB, Li ZP, Xie JY, Yang ZZ, Jin F, Qing Y. Targeting truncated APE1 in mitochondria enhances cell survival after oxidative stress. Free Radic Biol Med. 2008;45:592-601. [PubMed] |
| 26. | Phadnis N, Mehta R, Meednu N, Sia EA. Ntg1p, the base excision repair protein, generates mutagenic intermediates in yeast mitochondrial DNA. DNA Repair (Amst). 2006;5:829-839. [PubMed] |
| 27. | Ueta E, Sasabe E, Yang Z, Osaki T, Yamamoto T. Enhancement of apoptotic damage of squamous cell carcinoma cells by inhibition of the mitochondrial DNA repairing system. Cancer Sci. 2008;99:2230-2237. [PubMed] |
| 28. | Wang L, Ma Q, Chen X, Sha H, Ma Z. Effects of resveratrol on calcium regulation in rats with severe acute pancreatitis. Eur J Pharmacol. 2008;580:271-276. [PubMed] |
| 29. | Li ZD, Ma QY, Luo YH. [Effect of resveratrol-induced FasL up-regulation on the apoptosis of pancreatic acinar cells in rats with severe acute pancreatitis]. Nanfang Yike Daxue Xuebao. 2009;29:454-457. [PubMed] |
| 30. | Robb EL, Page MM, Wiens BE, Stuart JA. Molecular mechanisms of oxidative stress resistance induced by resveratrol: Specific and progressive induction of MnSOD. Biochem Biophys Res Commun. 2008;367:406-412. [PubMed] |
| 31. | Fulda S, Debatin KM. Resveratrol modulation of signal transduction in apoptosis and cell survival: a mini-review. Cancer Detect Prev. 2006;30:217-223. [PubMed] |
| 32. | Kao CL, Huang PI, Tsai PH, Tsai ML, Lo JF, Lee YY, Chen YJ, Chen YW, Chiou SH. Resveratrol-induced apoptosis and increased radiosensitivity in CD133-positive cells derived from atypical teratoid/rhabdoid tumor. Int J Radiat Oncol Biol Phys. 2009;74:219-228. [PubMed] |