修回日期: 2009-09-10
接受日期: 2009-09-21
在线出版日期: 2009-10-08
目的: 探讨肝癌经导管动脉栓塞(transcatheter arterial embolization, TAE)对残存肿瘤血管生成的影响.
方法: 建立20只兔VX2肝癌模型. TAE处理组(n = 10), 接受150-250 μm聚乙烯醇经导管肝动脉栓塞; 对照组(n = 10), 接受蒸馏水经导管肝动脉注入模拟TAE. 栓塞后6 h或3 d, 处死实验兔进行肿瘤组织取样, 采用免疫组织化学方法评价样本的血管内皮生长因子(vascular endothelial growth factor, VEGF)蛋白表达和微血管密度(microvessel density, MVD), 微血管标记采用CD31抗体, 实时PCR检测VEGF mRNA表达.
结果: TAE处理组肿瘤呈不完全性中央坏死, 坏死区周围可见肿瘤细胞存活. TAE处理组肿瘤的VEGF蛋白、mRNA水平和平均MVD均显著高于对照组(P = 0.001, 0.000, 0.001). VEGF蛋白水平与MVD呈显著性正相关(r = 0.677, P = 0.001).
结论: 肝癌TAE可激活残存肿瘤血管生成, VEGF在TAE相关性血管生成中发挥重要调节作用.
引文著录: 梁斌, 郑传胜, 冯敢生, 王勇, 赵辉, 夏向文. 经导管动脉栓塞对肝癌血管生成的影响. 世界华人消化杂志 2009; 17(28): 2881-2886
Revised: September 10, 2009
Accepted: September 21, 2009
Published online: October 8, 2009
AIM: To investigate the effect of transcatheter arterial embolization (TAE) on angiogenesis in rabbit VX2 liver tumor.
METHODS: VX2 tumors were implanted in the liver of 20 New Zealand White rabbits. The animals were then divided into two groups: rabbits undergoing TAE with 150-250-μm polyvinyl alcohol particles (TAE group, n = 10) and those undergoing sham embolization with distilled water (control group, n = 10). The animals were sacrificed six hours or three days after TAE, and tumor samples were harvested. Immunohistochemistry was performed to evaluate vascular endothelial growth factor (VEGF) protein expression and microvessel density (MVD). Real-time reverse transcription-polymerase chain reaction (RT-PCR) was performed to examine the expression of VEGF mRNA.
RESULTS: TAE-treated tumors showed incomplete central necrosis with residual viable tumor cells in the periphery. The levels of VEGF protein and mRNA and mean MVD were significantly higher in the TAE group than in the control group (P = 0.001, 0.000 and 0.001, respectively). The expression level of VEGF protein was positively correlated with MVD in residual viable tumor cells (r = 0.677, P = 0.001).
CONCLUSION: TAE can promote angiogenesis in residual rabbit VX2 liver tumor after TAE perhaps in a VEGF-dependent manner.
- Citation: Liang B, Zheng CS, Feng GS, Wang Y, Zhao H, Xia XW. Transcatheter arterial embolization promotes angiogenesis in rabbit VX2 liver tumor. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2881-2886
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2881.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2881
经导管动脉栓塞(transcatheter arterial embolization, TAE)是肝癌经导管介入治疗技术的重要组成部分. 该治疗技术通过栓塞肿瘤供血动脉诱导肿瘤缺血缺氧性坏死, 当结合动脉内灌注化疗药物(即化疗栓塞)或放射性物质(即放疗栓塞), 则可导致更广泛的肿瘤坏死[1]. 以栓塞为基础的介入疗法已成为目前治疗不可切除性肝癌的主要方法. 然而, 二十余年的临床应用结果发现, 介入栓塞作为肝癌姑息性治疗方法, 其近期疗效显著, 但远期疗效仍不够理想. 肝癌栓塞后肿瘤复发和转移是限制其疗效的主要因素[2-3]. 研究证实, 肝癌作为典型的富血管肿瘤[4], 肿瘤血管生成在肝癌的生长和浸润转移等肿瘤生物学方面发挥重要作用[5]. 了解栓塞与血管生成的关系对阐明TAE治疗肝癌的确切疗效具有重要意义. 因此, 我们采用兔VX2肝癌模型研究TAE对肝癌血管生成的影响.
新西兰大白兔, ♂, 体质量3.0-3.5 kg, 购于华中科技大学同济医学院动物学部. VX2瘤株购于中国典型培养物保藏中心. MR成像采用1.5 T MR成像仪(Magnetom Avanto; Siemens medical solutions, Germany). 介入监视采用DSA仪(Angiostar Plus, Siemens medical solutions, Germany). 介入器械均购自泰尔茂公司(Terumo, Japan). 对比剂为欧乃派克(Omnipaque 350; GE Healthcare, Shanghai, China). 二抗试剂盒采用EnVisionTM非生物素检测系统(Dako, Glostrup, Denmark). 一抗分别为小鼠抗VEGF(Millipore, Billerica, USA)、小鼠抗CD31(Dako, Glostrup, Denmark)单克隆抗体. 实时PCR所用试剂包括RNA保存液(Applygen, China)、TRIzol(Invitrogen, Carlsbad, USA)、cDNA第一键合成酶(Toyobo, Japan)和SYBR Green Realtime PCR master mix (Toyobo, Japan).
1.2.1 动物模型、MR成像和实验分组: 新西兰大白兔, 雌雄不限, 体质量3.0-3.5 kg, 动物麻醉采用戊巴比妥钠, 静脉注射, 剂量30 mg/kg体质量. 兔VX2肝癌模型制作: 先将VX2瘤从用于传代的荷瘤兔中取出, 剪成1 mm×1 mm×1 mm大小的瘤组织块, 再将实验用兔全麻后无菌手术下开腹、暴露肝脏, 将瘤组织块直接植入肝左叶内, 植入深度距肝包膜约10 mm. 肿瘤移植后17-18 d, 采用MR成像仪监测VX2癌成瘤情况. 所有动物取仰卧位, 选用6通道体部相控阵线圈联合2通道脊柱相控阵线圈, 进行T2加权MR成像, 参数: TR 3700 ms, TE 87 ms, 层厚4 mm, 层间距 15%, 带宽 168 Hz, 视野200×200 mm2, 矩阵320×320. 成功建立兔VX2肝癌模型20只, 将其分为2组: TAE处理组(n = 10), 采用150-250 μm聚乙烯醇栓塞; 对照组(n = 10), 采用蒸馏水代替聚乙烯醇模拟TAE. 再根据处死时间, 将每组实验兔分成2个亚组: A亚组(TAE处理组5只, 对照组5只), TAE后6 h处死动物; B亚组(TAE处理组5只, 对照组5只), TAE后3 d处死动物.
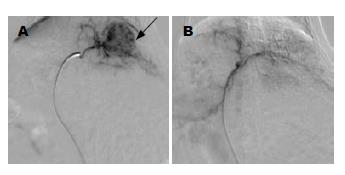
1.2.2 TAE操作: TAE在DSA监测下进行. 实验兔全麻固定, 无菌手术下切开腹股沟皮肤, 暴露股动脉, 直视下采用18G穿刺针穿刺股动脉成功后, 交换导丝, 引入4 F血管鞘, 先采用4 F Cobra导管选择性插入腹腔干, 手推对比剂进行腹腔干造影用以了解腹腔干内脏血管解剖, 再采用2.7 F同轴微导管相继超选择性插入肝总动脉、肝固有动脉和肝左动脉内. 先进行肝固有动脉或肝左动脉选择性血管造影证实移植瘤血供来源于肝左动脉, 之后实施栓塞处理. 栓塞剂采用150-250 μm大小的聚乙烯醇颗粒, 每瓶聚乙烯醇以10 mL对比剂进行混悬, 在透视监测下将0.1-0.4 mL聚乙烯醇混悬液经导管注入肝左动脉内, 栓塞程度以顺行血流的完全停滞为准. 对照组经导管注入0.4 mL蒸馏水代替栓塞剂.
1.2.3 免疫组织化学: TAE后6 h、3 d, 采用静脉注射过量戊巴比妥钠(100 mg/kg体质量)的方法处死实验兔, 肿瘤取样(包括最大层面的肿瘤组织和少量癌旁肝组织), 标本中性甲醛固定, 石蜡包埋, 制成4 μm切片用于组织学染色. 切片采用H-E染色和免疫组织化学染色. 免疫组织化学染色采用EnVisionTM非生物素检测系统(Dako, Denmark). 简单步骤如下: 柠檬酸盐缓冲液(0.01 mol/L, pH6.0)微波抗原修复, 3%的H2O2孵育10 min阻断内源性过氧化物酶, 分别滴加小鼠抗VEGF(工作浓度,1:50)和小鼠抗CD31(工作浓度, 1:20) mAb, 4℃孵育过夜, EnVisionTM二抗育温孵育30 min, DAB显色, 苏木素复染. 磷酸盐缓冲液代替一抗作阴性对照. 免疫组织化学染色由2位病理科医师采用盲法进行评价, 差异采用商讨显微镜方式解决. 所有切片均在光镜下全面观察. 根据所有视野内阳性染色细胞的百分比, 将VEGF蛋白水平分为4级: -, 无染色; +, <10%的细胞出现胞质染色; ++, 10%-50%的胞质染色; +++, >50%的胞质染色[6]. MVD采用Weidner et al介绍的方法进行评价: 首先在低倍镜(×40)下预览切片, 找出血管密集区(即热点), 然后在高倍镜(×200)下分别计数5个不同视野内的微血管, 任一被CD31染色的与邻近组织成分区分开的内皮细胞或细胞束均被视为一支血管数, 以5个高倍视野的微血管平均数作为该切片的MVD值[7].
1.2.4 实时PCR: VEGF mRNA表达采用实时PCR进行检测. 实验兔处死后, 收集肿瘤标本并置于RNA保存液中-70℃保存. TRIzol提取细胞总RNA, 各样本取1 μg总RNA, 用cDNA第一链合成酶逆转录成第一链cDNA. PCR引物序列如下: VEGF, 5'-GCAGAAGAAGGAGACAATAAACC-3', 5'-GCACGCAGGAAGGCTTGAATA-3'; β-actin, 5'-CGAGATCGTGCGGGACAT-3', 5'-CAGGAAGGAGGGCTGGAAC-3'. 实时PCR反应采用SYBR Green Realtime PCR master mix, 反应体系25 μL. PCR程序: 50℃ 2 min, 1次循环; 95℃ 2 min, 1次循环; 95℃ 15 s, 60℃ 15 s, 72℃ 45 s, 40次循环; 收集荧光, 绘制解离曲线. 每个标本PCR重复3次, 取均值. 采用2-ΔΔCt方法分析VEGF相对基因表达[8].
统计学处理 采用SPSS13.0统计软件, t检验比较TAE-处理组与对照组之间肿瘤直径的差异, Mann-Whitney U检验比较两组间VEGF mRNA及其蛋白和MVD的差异, Spearman's相关分析检测VEGF蛋白与MVD的关系. P<0.05为差异有统计学意义.
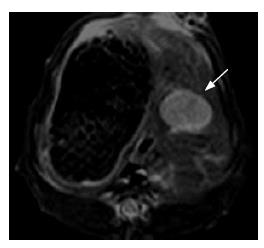
MR图像显示所有移植肿瘤生长于兔肝左叶内(图1). TAE处理组和对照组肿瘤的直径分别1.24±0.25 cm和1.33±0.26 cm, 两组间差异无统计学意义(P = 0.439). 20只实验动物成功实施TAE(图2).
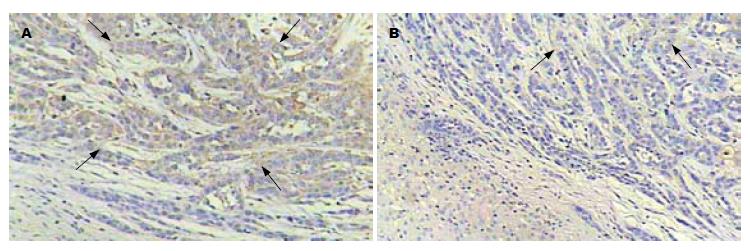
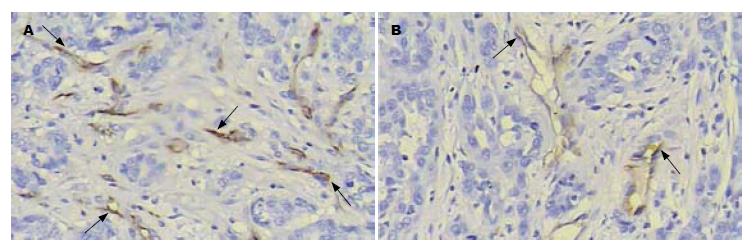
TAE处理组肿瘤的坏死程度明显大于对照组. 尽管TAE处理组肿瘤显示了大范围的中央性坏死, 但周边区域仍可见肿瘤细胞存活. VEGF蛋白呈浆染色. 该蛋白主要表达于分布在坏死区周围和肿瘤边缘的存活肿瘤细胞内(图3), 然而在血管内皮细胞和癌旁肝细胞内也发现有VEGF蛋白表达. TAE处理组肿瘤的VEGF蛋白水平明显高于对照组(表1). 肿瘤内微血管呈不均匀分布, 血管密集区位于肿瘤侵犯缘(图4). TAE处理组肿瘤的平均MVD明显高于对照组. 尽管6 h处死的处理组肿瘤MVD较对照组升高, 但差异无统计学意义; 相比之下, 3 d处死的肿瘤两组间MVD差异显著(表1).
| 分组 | VEGF蛋白水平 | P值 | VEGF mRNA(mean±SD) | P值 | MVD(mean±SD) | P值 | |||
| 0 | + | ++ | +++ | ||||||
| 6 h | |||||||||
| TAE组(n = 5) | 0 | 0 | 3 | 2 | 0.031 | 3.51±2.16 | 0.009 | 20.40±6.39 | 0.094 |
| 对照组(n = 5) | 0 | 3 | 2 | 0 | 0.62±0.28 | 14.44±2.83 | |||
| 3 d | |||||||||
| TAE组(n = 5) | 0 | 0 | 2 | 3 | 0.020 | 4.64±2.27 | 0.009 | 33.04±7.99 | 0.009 |
| 对照组(n = 5) | 0 | 3 | 2 | 0 | 0.63±0.26 | 13.80±3.52 | |||
| 合计 | |||||||||
| TAE组(n = 10) | 0 | 0 | 5 | 5 | 0.001 | 4.07±2.17 | 0.000 | 26.72±9.54 | 0.001 |
| 对照组(n = 10) | 0 | 6 | 4 | 0 | 0.63±0.25 | 14.12±3.03 | |||
TAE处理组和对照组VX2肿瘤均检测有VEGF mRNA表达. TAE处理组VEGF mRNA表达水平明显高于对照组(表1).
VX2肿瘤VEGF蛋白水平与MVD呈正相关(r = 0.677, P = 0.001).
TAE通过栓塞肿瘤供血动脉可诱导肿瘤缺血缺氧以及后继的肿瘤坏死, 当结合动脉内灌注化疗药物(即化疗栓塞)或放射性物质(即放疗栓塞), 则可导致更广泛的肿瘤坏死[9]. 以栓塞为基础的经导管介入技术已成为目前治疗不可切除性肝癌的主要方法[1]. TAE治疗肝癌的目的在于祛除肿瘤血管, 但是由于肝癌血供的复杂性以及TAE技术的局限性, 栓塞肿瘤供养血管是不可能完全的[10-12]. 这使得TAE后肝癌病灶坏死不够彻底, 在肿瘤周边常有不同程度的肿瘤细胞存活[13]. 这些残存的肿瘤细胞很可能会产生适应性基因改变并调整其生物学进程, 如激活肿瘤血管生成, 以避免肿瘤缺血缺氧性损伤.
VEGF是血管生成的重要启动子, 而MVD标志血窦毛细血管化状态, 两者最常用于评价肿瘤血管生成[5]. 有关TAE对肝癌血管生成的影响已经在人肝细胞癌及几种动物肝癌模型中得到研究. 然而研究结果存在争议. 大多数研究发现经TAE处理的肝癌VEGF表达和MVD较未经TAE处理的肝癌明显升高[14-18]. 但也有报道显示TAE并不增加肝癌VEGF表达和MVD[19].
与以往大多数研究结果一样, 本研究发现TAE处理组VX2肿瘤VEGF mRNA、蛋白水平及平均MVD较对照组明显升高, 并且肿瘤的VEGF蛋白表达与MVD相关. 这些数据表明肝癌TAE激活残存肿瘤血管生成可能是更为普遍的现象, 而VEGF在TAE相关性血管生成中发挥重要调节作用.
根据对不同处死时间点血管生成的观察, 我们发现TAE后6 h和3 d两组间的VEGF mRNA和蛋白水平存在显著性差异; 然而, 尽管两组间MVD在不同处死时间点均有差异, 但差异仅在TAE后3 d有统计学意义. 我们推测本结果可能与缺氧诱导血管生成的机制有关. 众所周知, VEGF是缺氧反应基因之一, 其表达受缺氧诱导, 反应迅速, 并可持续高水平表达直到缺氧刺激解除[20]. 肝癌TAE后残存肿瘤细胞由于血供相对减少而处于缺血缺氧状态, 存活的肿瘤细胞可以感受缺氧并上调VEGF基因表达. 本实验显示VEGF在TAE后6 h及3 d的高表达很可能是TAE产生的肿瘤内缺氧引起的. 相比之下, MVD作为血窦毛细血管化的标志, 代表血管化程度. 肝癌中的血管生成同样遵循血管生成的基本原理, 即包括内皮细胞的激活、增殖和迁移, 以及后续的新生肿瘤血管的形成、稳定和成熟, 该过程通常需要在受到血管源性因子的调节后数小时才能完成[5]. 本实验显示MVD的动态变化, 很可能与检测时间点的选择有关. 很可能6 h期限不足以让残存肝癌形成足够数量的新生血管, 而3 d代表适合的时间点采用免疫组织化学方法检测肿瘤新生血管化情况.
另外, 本研究发现大量VEGF阳性细胞位于肿瘤坏死区周围, 进一步证实了VEGF的过表达与TAE产生的肿瘤内缺氧有关, 因为研究已经证实肿瘤坏死周围区域距离血管最远, 代表最大程度的缺氧[21]. 然而在肿瘤边缘也可见到成簇的VEGF阳性细胞. 我们认为这种现象与TAE诱导缺氧肿瘤VEGF表达的推断并不矛盾, 因为研究发现可变的缺氧带可出现在远离坏死的肿瘤区域[22]. 是否这些出现VEGF阳性表达的肿瘤边缘区域存在缺氧; 或是否有独立于缺氧的其他因素(如生长因子、细胞因子和激素等)作用导致VEGF在这些区域表达[23], 有待进一步研究证实. 另一方面, 本研究显示肿瘤新生血管密集区主要位于肿瘤对外侵犯缘, 该发现可能与VEGF是通过旁分泌方式刺激肿瘤血管生成的机制有关[24].
总之, 本研究结果表明肝癌TAE可诱导残存肿瘤VEGF过表达, 进而促进肿瘤新生血管形成. 这可能对TAE治疗肝癌的疗效产生负面影响. 因此, 有必要采用TAE与抗血管生成的综合治疗策略, 以提高肝癌介入疗效.
TAE是肝癌经导管介入治疗技术的重要组成部分. 该治疗技术通过栓塞肿瘤供血动脉诱导肿瘤缺血缺氧性坏死, 达到控制肝癌的目的. 然而, TAE作为肝癌姑息性治疗方法, 其近期疗效显著, 但远期疗效仍不够理想. 肝癌TAE后肿瘤复发和转移是限制其疗效的主要因素.
丁惠国, 主任医师, 首都医科大学附属北京佑安医院肝病消化科
血管生成在肿瘤的生长和浸润转移等关键生物学方面发挥重要作用. 肝癌属于富血管肿瘤, 了解栓塞与血管生成的关系对阐明TAE治疗肝癌的确切疗效具有重要意义.
以往相关研究的结果存在争议, 如Gupta et al采用大鼠NF13762肝肿瘤模型进行实验, 发现经TAE处理的动物血清VEGF水平和肿瘤组织MVD较未经TAE处理的肝癌明显升高; 而Li et al报道栓塞并不增加大鼠Walker-256肝肿瘤的血管生成水平.
本研究采用标准TAE技术处理兔VX2肝肿瘤模型, 动态研究TAE后残存肿瘤组织的VEGF mRNA、蛋白水平及MVD, 并对VEGF蛋白与MVD进行相关分析, 用于评价TAE对肝癌血管生成的影响, 以及了解VEGF在TAE相关性肿瘤血管生成中的作用.
肝癌TAE可通过上调VEGF表达激活残存肿瘤血管生成. 因此, 有必要采用TAE与抗血管生成的综合治疗策略, 以提高肝癌介入疗效.
本研究选题新颖, 设计合理, 对进一步提高原发性肝癌的治疗效果具有一定的指导意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Brown DB, Gould JE, Gervais DA, Goldberg SN, Murthy R, Millward SF, Rilling WS, Geschwind JF, Salem R, Vedantham S. Transcatheter therapy for hepatic malignancy: standardization of terminology and reporting criteria. J Vasc Interv Radiol. 2007;18:1469-1478. [PubMed] |
| 2. | Lee JK, Chung YH, Song BC, Shin JW, Choi WB, Yang SH, Yoon HK, Sung KB, Lee YS, Suh DJ. Recurrences of hepatocellular carcinoma following initial remission by transcatheter arterial chemoembolization. J Gastroenterol Hepatol. 2002;17:52-58. [PubMed] |
| 3. | Liou TC, Shih SC, Kao CR, Chou SY, Lin SC, Wang HY. Pulmonary metastasis of hepatocellular carcinoma associated with transarterial chemoembolization. J Hepatol. 1995;23:563-568. [PubMed] |
| 4. | Breedis C, Young G. The blood supply of neoplasms in the liver. Am J Pathol. 1954;30:969-977. [PubMed] |
| 5. | Semela D, Dufour JF. Angiogenesis and hepatocellular carcinoma. J Hepatol. 2004;41:864-880. [PubMed] |
| 6. | Yamaguchi R, Yano H, Iemura A, Ogasawara S, Haramaki M, Kojiro M. Expression of vascular endothelial growth factor in human hepatocellular carcinoma. Hepatology. 1998;28:68-77. [PubMed] |
| 7. | Weidner N, Semple JP, Welch WR, Folkman J. Tumor angiogenesis and metastasis--correlation in invasive breast carcinoma. N Engl J Med. 1991;324:1-8. [PubMed] |
| 8. | Schmittgen TD, Zakrajsek BA, Mills AG, Gorn V, Singer MJ, Reed MW. Quantitative reverse transcription-polymerase chain reaction to study mRNA decay: comparison of endpoint and real-time methods. Anal Biochem. 2000;285:194-204. [PubMed] |
| 9. | Liapi E, Georgiades CC, Hong K, Geschwind JF. Transcatheter arterial chemoembolization: current technique and future promise. Tech Vasc Interv Radiol. 2007;10:2-11. [PubMed] |
| 10. | Goseki N, Nosaka T, Endo M, Koike M. Nourishment of hepatocellular carcinoma cells through the portal blood flow with and without transcatheter arterial embolization. Cancer. 1995;76:736-742. [PubMed] |
| 11. | Kim HC, Chung JW, Lee W, Jae HJ, Park JH. Recognizing extrahepatic collateral vessels that supply hepatocellular carcinoma to avoid complications of transcatheter arterial chemoembolization. Radiographics. 2005;25 Suppl 1:S25-S39. [PubMed] |
| 12. | Charnsangavej C, Chuang VP, Wallace S, Soo CS, Bowers T. Angiographic classification of hepatic arterial collaterals. Radiology. 1982;144:485-494. [PubMed] |
| 13. | Kim YB, Park YN, Park C. Increased proliferation activities of vascular endothelial cells and tumour cells in residual hepatocellular carcinoma following transcatheter arterial embolization. Histopathology. 2001;38:160-166. [PubMed] |
| 14. | Li X, Feng GS, Zheng CS, Zhuo CK, Liu X. Expression of plasma vascular endothelial growth factor in patients with hepatocellular carcinoma and effect of transcatheter arterial chemoembolization therapy on plasma vascular endothelial growth factor level. World J Gastroenterol. 2004;10:2878-2882. [PubMed] |
| 15. | Suzuki H, Mori M, Kawaguchi C, Adachi M, Miura S, Ishii H. Serum vascular endothelial growth factor in the course of transcatheter arterial embolization of hepatocellular carcinoma. Int J Oncol. 1999;14:1087-1090. [PubMed] |
| 16. | Liao XF, Yi JL, Li XR, Deng W, Yang ZF, Tian G. Angiogenesis in rabbit hepatic tumor after transcatheter arterial embolization. World J Gastroenterol. 2004;10:1885-1889. [PubMed] |
| 17. | Gupta S, Kobayashi S, Phongkitkarun S, Broemeling LD, Kan Z. Effect of transcatheter hepatic arterial embolization on angiogenesis in an animal model. Invest Radiol. 2006;41:516-521. [PubMed] |
| 18. | Wang B, Xu H, Gao ZQ, Ning HF, Sun YQ, Cao GW. Increased expression of vascular endothelial growth factor in hepatocellular carcinoma after transcatheter arterial chemoembolization. Acta Radiol. 2008;49:523-529. [PubMed] |
| 19. | Li X, Feng GS, Zheng CS, Zhuo CK, Liu X. Influence of transarterial chemoembolization on angiogenesis and expression of vascular endothelial growth factor and basic fibroblast growth factor in rat with Walker-256 transplanted hepatoma: an experimental study. World J Gastroenterol. 2003;9:2445-2449. [PubMed] |
| 20. | Shweiki D, Neeman M, Itin A, Keshet E. Induction of vascular endothelial growth factor expression by hypoxia and by glucose deficiency in multicell spheroids: implications for tumor angiogenesis. Proc Natl Acad Sci U S A. 1995;92:768-772. [PubMed] |
| 21. | Kaur B, Khwaja FW, Severson EA, Matheny SL, Brat DJ, Van Meir EG. Hypoxia and the hypoxia-inducible-factor pathway in glioma growth and angiogenesis. Neuro Oncol. 2005;7:134-153. [PubMed] |
| 22. | Helmlinger G, Yuan F, Dellian M, Jain RK. Interstitial pH and pO2 gradients in solid tumors in vivo: high-resolution measurements reveal a lack of correlation. Nat Med. 1997;3:177-182. [PubMed] |
| 23. | Hoeben A, Landuyt B, Highley MS, Wildiers H, Van Oosterom AT, De Bruijn EA. Vascular endothelial growth factor and angiogenesis. Pharmacol Rev. 2004;56:549-580. [PubMed] |