修回日期: 2009-08-27
接受日期: 2009-08-31
在线出版日期: 2009-09-28
目的: 考察去氨微乳结肠定向除氨作用, 期望为肝性脑病的防治提供一种更直接有效的新方法.
方法: 将去氨微乳放入含不同氨浓度的人工结肠液中10 h, 体外模拟胃肠转运时间与pH环境的实验; 参照国际检测氨的方法分别测氨浓度变化, 计算氨清除率; 在氨检测装置中比较去氨微乳、空白微乳、水及乳果糖对氨的清除作用.
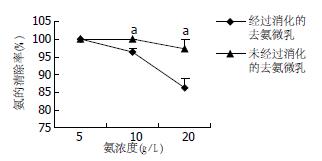
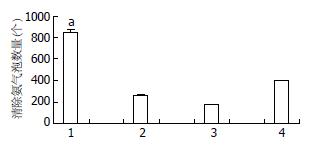
结果: 去氨微乳使含氨5 g/L与10 g/L的结肠液氨浓度均下降为0 g/L, 使含氨20 g/L的结肠液氨浓度下降为0.521±0.135 g/L(P<0.05). 在含氨10 g/L与20 g/L的人工结肠液中对氨的清除率较在含酶的人工胃液与小肠液消化中显著提高(100%±0.00% vs 96.41%±0.84%; 97.29%±2.67% vs 86.42%±2.63%, 均P<0.05). 去氨微乳清除氨的效果明显优于空白微乳、水及乳果糖.
结论: 去氨微乳本身具有很好的除氨作用, 为清除肠道氨提供了新的方法, 但其作用会受到胃与小肠消化的影响, 需进一步优化其配方.
引文著录: 王爱红, 段志军, 田舸, 张文君, 贺高红. 去氨微乳的结肠定向除氨作用. 世界华人消化杂志 2009; 17(27): 2821-2824
Revised: August 27, 2009
Accepted: August 31, 2009
Published online: September 28, 2009
AIM: To investigate whether ammonia-removing microemulsion (ARM) can specifically remove ammonia from artificial colonic fluid and explore the potential role of ARM in the prevention and treatment of hepatic encephalopathy.
METHODS: ARM was mixed with artificial colonic fluid containing different concentrations of ammonia for ten hours. Meanwhile, ARM was successively mixed with artificial gastric juice for 2 h, artificial small intestinal juice for 3 h and artificial colonic fluid for 10 h to mimic gastrointestinal transit and pH environment. Ammonia concentrations in the fluid were then measured using a standard technique, and the ammonia removal rate was calculated. The ammonia removal efficiency achieved using ARM was compared with that achieved using empty microemulsion, water and lactulose.
RESULTS: After mixing with ARM, the ammonia concentrations decreased to 0 g/L in the artificial colonic fluid initially containing 5 g/L or 10 g/L of ammonia, and to 0.521 ± 0.135 g/L in the fluid containing 20 g/L of ammonia. The ammonia removal rate achieved in artificial colonic fluid containing 10 or 20 g/L of ammonia was significantly higher than that in the artificial gastric juice and small intestinal juice containing enzymes (100% ± 0.00% vs 96.41% ± 0.84%, and 97.29% ± 2.67% vs 86.42% ± 2.63%, respectively; both P < 0.05). ARM achieved a higher ammonia removal efficiency than empty microemulsion, water and lactulose.
CONCLUSION: ARM shows a very good ammonia-removing effect and thus provides a new approach for removal of colonic ammonia. However, the digestive fluids in the stomach and small intestine may weaken such ammonia-removing effect.
- Citation: Wang AH, Duan ZJ, Tian G, Zhang WJ, He GH. Targeted removal of ammonia from the colon using ammonia-removing microemulsion. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2821-2824
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2821.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2821
氨中毒学说在肝性脑病(hepatic encephalopathy, HE)发病机制中处于中心地位[1]. 去氨一直是HE防治的主要措施[2-3]. 低蛋白或禁蛋白饮食也在HE防治中被采纳[2]. 然而对于常存在低蛋白血症的肝病患者, 过分限制蛋白反而恶化了其营养状况, 使其生存质量明显下降[4-5]. 因此, 既要预防HE又要保证蛋白营养, 其解决的最好办法是及时高效地清除肠道氨, 但目前能够保证患者日常预防应用的口服清除肠道氨的方法尚少, 其主要问题在于目前的方法无显著提高直接去氨能力, 清除率不高. 我们初步探讨了特制的去氨微乳对人工结肠液中氨的去除效果, 期望为进一步优化去氨微乳建立实验依据, 为肠道氨的清除提供一种新的可行的方法.
W/O型去氨微乳、空白微乳由大连理工大学膜科学与技术中心制备. 氨水为天津福晨化学试剂厂分析纯. 盐酸为天津瑞金特化学品有限公司分析纯. 乳果糖口服液为丹东康复制药有限公司产品. 胃蛋白酶(上海贝基生物科技有限公司); 胰酶(合肥博美生物科技有限责任公司). 精密pH试纸(上海三爱思试剂有限公司); 电子天平(FA1104, 上海精科天平有限公司); 磁力加热搅拌器(79-1, 国华电器有限公司); 数显恒温水浴锅(HH-8, 国华电器有限公司). 甲基红-次甲基蓝指示液配制(将1 g/L次甲基蓝乙醇溶液与1 g/L甲基红乙醇溶液1:2混合); pH指示剂配制(甲基红1.5 mg、溴麝香草酚蓝60 mg、酚酞64 mg溶于50%乙醇100 mL, 用0.1 mol/L NaOH调至绿色), 变色范围pH1-14.
1.2.1 人工胃肠液的配制: 按中国药典2005年版, 人工胃液: 取稀盐酸16.4 mL, 加水800 mL与胃蛋白酶10 g, 摇匀后, 加水稀释至1000 mL即得; 人工小肠液: pH6.8取磷酸二氢钾6.8 g, 加水500 mL使溶解, 用0.1 mol/L氢氧化钠溶液调节pH值至6.8, 取胰酶10 g, 加水适量使溶解, 将2液混合后, 加水稀释至1000 mL即得; 人工结肠液: pH7.8磷酸氢二钾5.59 g与磷酸二氢钾0.41 g, 加水溶成1000 mL即得. 含氨的人工结肠液的配制: 分别称取5、10和20 g氨水加上述人工结肠液稀释至1000 mL, 即得浓度分别为5、10和20 g/L的含氨结肠液备用.
1.2.2 去氨微乳对人工结肠液中氨清除作用: 将去氨微乳放入含氨的人工结肠液, 10 h后静置分层留取结肠液; 模拟全胃肠道转运时间和pH环境: 去氨微乳依次放入人工胃液2 h, 静置分层, 移入人工小肠液3 h, 静置分层, 移入含氨的人工结肠液10 h, 静置分层留取结肠液(去氨微乳与人工液体体积1:1的比例). 将上述含氨的人工结肠液加2滴甲基红-次甲基蓝混合指示液, 参照国际标准(ISO 6353/2-1983)规定的检测氨的方法: 用盐酸标准滴定溶液[C(HCl) = 0.5 mo1/L]滴定含氨结肠液至红色. 利用公式计算氨的浓度g/L = 所用盐酸体积×标定后盐酸浓度×0.01703/含氨结肠液体积(分层后). 氨清除率 = (加入去氨微乳前氨浓度-加入去氨微乳后氨浓度)/加入去氨微乳前氨浓度.
1.2.3 去氨微乳和乳果糖去氨作用的比较: 在锥形瓶中加入氯化铵及氢氧化钙固体, 加热可产生氨. 取玻璃管分别精密加入去氨微乳、空白微乳、水、乳果糖各3 mL及通用指示剂作为受试液, 此管上开口处塞入湿润的广泛pH试纸. 组装成氨检测装置, 当湿润的试纸开始变蓝时, 指示受试液氨饱和, 通过记录管中受试液吸附的氨气数比较受试液的去氨作用.
统计学处理 用SPSS13.0软件, 采用配对t检验, P<0.05有统计学意义.
含氨5 g/L及10 g/L的结肠液中氨浓度均降为0 g/L, 含氨20 g/L的结肠液中氨浓度变为0.521±0.135 g/L, 差异有统计学意义(P<0.01).
在含氨10 g/L及20 g/L的人工结肠液中对氨的清除率分别为100%±0.00%和97.29%±2.67%; 在经过含酶的人工胃液和小肠液消化后, 清除率分别为96.41%±0.84%和86.42%±2.63%, 与未经消化的去氨微乳比较去氨效果有所下降(P<0.05, 图1).
去氨微乳清除氨效果明显优于空白微乳、水和乳果糖(图2).
HE是由严重肝病引起的、代谢紊乱、中枢神经系统功能失调的综合征, 表现为性格改变、行为异常、智能障碍, 重者昏迷, 严重影响生活质量并可危及生命. 发病机制是复杂, 涉及多种物质代谢异常. 其中氨中毒学说已被广泛接受, 有学者[6]认为严重肝病患者的高血氨水平往往发生更多的肝性脑病等并发症. 而胃肠道是氨产生的主要来源, 其主要产生部位在结肠. 我们用醋酸作为氨的捕集剂, 不被胃肠道吸收的二甲基硅油作为外油相制备了W/O去氨微乳, 用来清除结肠中的氨. 去氨微乳利用酸碱中和的原理, 将人工结肠液中的氨迅速直接通过外油相被内相中和清除. 目前临床上口服清除肠道氨的措施主要有口服不吸收的双糖类如乳果糖、乳梨醇、益生菌以及一些抗菌药物. 乳果糖等双糖类在结肠被乳酸菌属和粪链球菌分解为乳酸和醋酸以酸化肠道, 并可改变肠道菌群来减少氨的生成和吸收[7]; 益生菌通过调整肠道菌群, 降低肠道pH值, 减少氨的生成[8]; 口服新霉素、卡那霉素、替硝唑等可减少细菌对蛋白质的分解, 从而减少氨和内毒素的产生[9-11]. 由作用机制可见这些措施发挥清除肠道氨的作用受到肠道菌群和pH环境的影响, 且不吸收糖类有腹泻的不良反应, 抗生素对肝肾功等的影响也使其长期应用受到了限制[12-13]. 我们配制的人工结肠液未加入结肠菌, 可见去氨微乳同这些措施相比, 发挥除氨作用不需要结肠菌群的作用, 能直接除氨, 可能为结肠中氨的清除提供了一种新的有效的方法.
胃肠转运时间和胃肠道的pH是影响口服药物释药速度和释药位置的主要因素. 我们进一步采取了胃肠转运时间和pH相结合的方法考察去氨微乳的除氨作用, 去氨微乳经过含酶的人工胃液和小肠液消化后, 除氨效率有所下降, 但在含氨20 g/L的人工结肠液中除氨效率仍在85%以上. 且本实验简易的氨检测装置中去氨微乳直接除氨作用明显优于现有药物乳果糖. 去氨微乳对于结肠中氨的清除不失为一种有效的方法. 早在1973年, Li et al和Cahn et al就提出采用液膜法可直接除去水溶液中的弱酸盐和弱碱盐. 对于碱性药物或毒物, 如氨可以通过内包酸性捕集剂加以去除[14]. Asher et al[15]制成以酒石酸作为氨的捕集剂的液膜体系证实可捕集肠道中的氨. 本校和中国科学院大连化学物理研究所也曾合作制备了一种内相包封盐酸的稳定的W/O型乳状液膜-甲l号治疗氨中毒效果明显. 然而, 对于乳化液膜来说, 最大问题是其不稳定, 保存期短, 而同属于液膜技术分支的微乳则完全可以克服这一缺点. 微乳除了具有乳液的一般特征外, 还具有粒径小、透明、稳定和靶向释药等特点. 他由水、油、表面活性剂和助表面活性剂4部分组成, 各部分按适当比例混合, 自发形成, 呈各向同性、透明、热力学稳定的分散体系, 易于制备和保存. 将药物制备成微乳制剂, 可达到较高的稳定性, 具有使药物免受降解, 缓慢释放药物, 从而作用于病变部位, 减小药物毒性, 提高生物利用度等优点. 20世纪80年代后作为药物载体受到医药界的重视. Actis et al[16]对口服环孢菌素微乳的长效生物利用度方面做了详细的研究, 表明环孢菌素的微乳制剂可以对药物起到缓释作用, 并在一定程度上增加了药物的生物利用度. 国内王建磊 et al[17]制备的包封胰岛素的W/O型载药微乳液具有良好的耐热、耐酸、耐盐稳定性, 缓释效果显著. 赵健 et al[18]将胰岛素微乳用于大鼠结肠给药模型取得较好的降糖效果.
我们制备的口服去除肠道氨的W/O型的去氨微乳, 期望实现通过胃肠道维持完整不破乳, 在结肠中吸附并包裹氨排出体外-提出了一种不同于以往微乳的药物作用模式. 但微乳的应用中仍存在一些问题: 高浓度的表面活性剂和助表面活性剂是否对人体有不良反应; 口服后可被大量的胃液稀释, 如何保持其稳定性. 因此, 我们还需进一步优化微乳配方, 寻找对人体没有副作用的表面活性剂和助活剂, 减少表面活性剂和助表面活性剂用量, 提高其胃肠道稳定性, 并应用于动物实验进一步考察改进.
氨中毒学说在肝性脑病发病机制中处于中心地位, 对于常存在低蛋白血症的肝病患者, 既要预防肝性脑病又要保证蛋白营养, 其解决的最好办法是及时高效地清除肠道氨, 但目前口服清除肠道氨的方法无显著提高直接去氨能力, 清除率有待提高.
高泽立, 副教授, 上海交通大学医学院附属第九人民医院周浦分院消化科.
本研究利用微乳的独特性, 初步探讨了特制的去氨微乳对人工结肠液中氨的去除效果. 期望为进一步优化去氨微乳建立实验依据, 为肠道氨的清除提供一种新的可行的方法.
本研究以液膜去氨研究为基础, 打破了以往人们对微乳在药物释放方面研究的传统观念. 期待微乳在胃和小肠保持完整, 到达结肠吸附氨并携氨排出体外, 不增加代谢产物.
本研究提供的载药体系和作用模式有望为清除胃肠道毒素的研究和应用提供新方法和新思路; 还可能为口服药物治疗的研究和应用开辟了新途径.
本研究初步探讨了特制的去氨微乳对人工结肠液中氨的去除效果, 实验严谨, 方法可行, 为临床治疗急性肝性脑病提供了新的思路.
编辑: 李军亮 电编:何基才
| 1. | Shawcross DL, Olde Damink SW, Butterworth RF, Jalan R. Ammonia and hepatic encephalopathy: the more things change, the more they remain the same. Metab Brain Dis. 2005;20:169-179. [PubMed] [DOI] |
| 2. | 陆 再英, 钟 南山. 内科学. 第7版. 北京: 人民卫生出版社 2008; 463-468. |
| 3. | Av SP. Hepatic encephalopathy: pathophysiology and advances in therapy. Trop Gastroenterol. 2007;28:4-10. [PubMed] |
| 4. | Tözün N. Influence of the metabolic complications of liver cirrhosis on dietary intake. Med Sci Monit. 2000;6:1223-1226. [PubMed] |
| 5. | Mullen KD, Dasarathy S. Protein restriction in hepatic encephalopathy: necessary evil or illogical dogma? J Hepatol. 2004;41:147-148. [PubMed] [DOI] |
| 6. | Bhatia V, Singh R, Acharya SK. Predictive value of arterial ammonia for complications and outcome in acute liver failure. Gut. 2006;55:98-104. [PubMed] [DOI] |
| 7. | Shuliat'ev IS, Il'chenko LIu, Vinnitskaia EV, Petrakov AV, Sil'verstrova SIu. [Lactulose in treatment of hepatic encephalopathy in patient with liver cirrhosis]. Eksp Klin Gastroenterol. 2002;38-41, 127. [PubMed] |
| 8. | Bongaerts G, Severijnen R, Timmerman H. Effect of antibiotics, prebiotics and probiotics in treatment for hepatic encephalopathy. Med Hypotheses. 2005;64:64-68. [PubMed] [DOI] |
| 9. | Williams R, Bass N. Rifaximin, a nonabsorbed oral antibiotic, in the treatment of hepatic encephalopathy: antimicrobial activity, efficacy, and safety. Rev Gastroenterol Disord. 2005;5 Suppl 1:S10-S18. [PubMed] |
| 10. | Zeneroli ML, Avallone R, Corsi L, Venturini I, Baraldi C, Baraldi M. Management of hepatic encephalopathy: role of rifaximin. Chemotherapy. 2005;51 Suppl 1:90-95. [PubMed] [DOI] |
| 11. | Gasztonyi B, Hunyady B. [Clinical and pharmacological aspects of rifaximin, local antibiotic therapy in intestinal disorders]. Orv Hetil. 2004;145:2177-2181. [PubMed] |
| 12. | Als-Nielsen B, Gluud LL, Gluud C. Nonabsorbable disaccharides for hepatic encephalopathy. Cochrane Database Syst Rev. 2004;CD003044. [PubMed] |
| 13. | Maddrey WC. Role of antibiotics in the management of hepatic encephalopathy. Rev Gastroenterol Disord. 2005;5 Suppl 1:S3-S9. [PubMed] |
| 14. | 张 瑞华. 液膜在生物化学和医学上的应用. 江西师范大学学报(自然科学版). 1989;13:91-96. |
| 15. | Asher WJ, Vogler TC, Bovée KC, Holtzapple PG, Hamilton RW. Projections and measurements of in vivo performance of liquid membrane capsules. Kidney Int Suppl. 1976;S254-S258. [PubMed] |
| 16. | Actis GC, Lagget M, Rizzetto M, Fadda M, Palmo A, Pinna-Pintor M, Morino F. Long-term efficacy of oral microemulsion cyclosporin for refractory ulcerative colitis. Minerva Med. 2004;95:65-70. [PubMed] |