修回日期: 2009-08-24
接受日期: 2009-08-31
在线出版日期: 2009-09-28
目的: 筛选并克隆人胃癌细胞cDNA文库中与三叶因子2(trefoil factor family 2, TFF2)蛋白相互作用的蛋白基因.
方法: RT-PCR方法验证胃癌细胞存在TFF2 mRNA表达; PCR法扩增TFF2基因, NotⅠ与SalⅠ双酶切后定向克隆到酵母表达载体pDEST32, 构建TFF2的诱饵质粒; Western blot验证TFF2诱饵质粒在酵母细胞中相应融合蛋白的表达; 将诱饵质粒和人胃癌-cDNA文库猎物质粒共同转化MaV203酵母感受态细胞, 通过营养缺陷型培养基(Ura、His)与X-gal进行3重筛选阳性克隆, 提取阳性克隆质粒测序, 应用蛋白质数据库及生物信息学技术, 对测序结果进行分析.
结果: RT-PCR法证实胃癌细胞中存在TFF2 mRNA表达; 构建pDEST32-TFF2诱饵表达质粒成功; Western blot法证实诱饵质粒转化酵母细胞后正确表达TFF2-GAL4DBD融合蛋白; 通过酵母双杂交筛选胃癌细胞cDNA文库, 共获得35个表达His、Ura及X-gal报告基因的阳性克隆, 其中测序成功为16个克隆, 包含12个已知蛋白基因与4个未知功能基因.
结论: 从胃癌细胞cDNA文库中筛选出多种TFF2相互作用蛋白基因, 其可能与胃癌的发生发展密切相关.
引文著录: 詹晓娟, 任建林, 许鸿志, 董菁, 周飞, 潘金水, 肖鸿敏. 三叶因子2相互作用蛋白基因在胃癌细胞cDNA文库中的筛选. 世界华人消化杂志 2009; 17(27): 2767-2772
Revised: August 24, 2009
Accepted: August 31, 2009
Published online: September 28, 2009
AIM: To identify and clone genes encoding human trefoil factor 2 (TFF2)-interacting proteins by screening a cDNA library of gastric cancer cells.
METHODS: The expression of TFF2 mRNA in gastric cancer was verified by reverse transcription-polymerase chain reaction (RT-PCR). The TFF2 gene was amplified by PCR, double digested with Not I and Sal I, and cloned into yeast expression vector pDEST32 to construct TFF2 bait plasmid. The expression of TFF2-GAL4DBD fusion protein by the bait plasmid in yeast cells was confirmed by Western blot. The TFF2 bait plasmid and a prey plasmid (containing a cDNA library of human gastric cancer cells) were co-transfected into Mav203 competent yeast cells. The positive clones were isolated using selective medium and sequenced. The sequenced genes were then compared with sequences deposited in the GenBank database.
RESULTS: RT-PCR analysis proved that TFF2 mRNA was expressed in gastric cancer. The pDEST32-TFF2 bait plasmid was successfully constructed. Western blot analysis confirmed that the TFF2 bait plasmid could correctly express the TFF2-GAL4DBD fusion protein. A total of 35 positive clones were obtained from the yeast two-hybrid screening. Sixteen positive clones were successfully sequenced, of which 12 represented known genes and 4 unknown genes.
CONCLUSION: Multiple genes encoding TFF2-interacting proteins were identified from the cDNA library of gastric cancer cells. These genes may be closely associated with the development and progression of gastric cancer.
- Citation: Zhan XJ, Ren JL, Xu HZ, Dong J, Zhou F, Pan JS, Xiao HM. Identification of genes encoding human trefoil factor 2-interacting proteins by screening a cDNA library of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2767-2772
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2767
三叶因子家族(trefoil factor family, TFF)是一群主要由胃肠道黏液细胞分泌的小分子多肽. 目前在哺乳动物体内发现的三叶肽(trefoil peptide)有3种, 即乳癌相关肽(pS2或TFF1)、解痉多肽(SP或TFF2)和肠三叶因子(ITF或TFF3), 他们的基因密集在染色体21q22.3上[1], 其共同特征为含一特殊结构域-P结构域. 由一段38-39个氨基酸序列通过3个分子内的二硫键相互连接, 使整个肽链扭曲、折叠形成三叶形结构, 由此得名[2-3]. 这种三叶形结构的稳定性使TFF具有明显的抗蛋白酶水解、抗酸消化及耐热特性, 因而能在消化系复杂的环境中保持生物活性. TFF通过C端Cys-X-X模序形成二硫键, 产生单体、同源二聚体、异源二聚体3种形式. Calnan et al[4]研究发现TFF1二聚体活性较单体形式更高.
TFF2是TFF成员之一, 含2个三叶结构域, 其单体分子由130个氨基酸组成[5], 生理情况下主要在胃体及胃窦的黏液颈细胞和下段十二指肠腺细表达[6-7], 但在病理条件下这种表达专一性消失[8], 他可在胃肠道黏膜损伤部位表达[9], 且在损伤部位的表达较正常黏膜明显增高. TFF2具有黏膜保护、上皮重建修复、信号传导、调节细胞凋亡、促进血管生成等[10]功能. 1982年由Jorgensen et al[11]在猪胰腺中提取胰岛素过程中首次分离得到. Thim et al[12]将TFF和黏蛋白混合, 用流变法测定混合后黏液黏度改变, 发现TFF2加入胃黏蛋白后形成了弹性凝胶, 黏度增加了10倍, 正因为TFF2对黏蛋白的强亲和力, 使他能参与胃黏膜保护及重建功能. May et al[13]发现TFF2在人体胃内是以糖基化的活化形式发挥功能的. Farrell et al[14]制作了TFF2基因敲除小鼠模型, 发现TFF2通过促进损伤上皮再生、减少胃酸分泌机制发挥上皮重建修复功能. 同时发现所有小鼠模型胃上皮细胞没有发生癌变, 推测TFF2可能不具有肿瘤抑制作用. Dhar et al[15]应用免疫组织化学染色方法检测111例手术切除的胃癌标本, 44%的肿瘤组织TFF2染色阳性, 其中弥漫性胃癌和伴淋巴结转移组织表达更甚, 同时测定肿瘤组织中血管密度, 发现TFF2表达阳性的肿瘤组织血管密度高于TFF2表达阴性组织. 这些表明TFF2在胃癌的浸润和转移中起到了重要作用, 是胃癌的不良预后因子, 但其作用机制迄今尚未明确.
有多种证据表明[16-17], 三叶因子可能通过与特定受体或蛋白质结合而发挥其生理功能, 但其结合蛋白或受体及在细胞中的信号转导途径尚未明确. 国外有不少学者多年来致力于这方面的研究, 也获得了一些TFF2结合蛋白, 但一致性差. 2000年, Thim et al[18]提取猪TFF2作为配体进行亲和层析, 发现小肠环磷腺苷cAMP受体转导蛋白CRP-ductin(muclin). 2004年, Ottoet al[19]在鼠胃中从TFF2-碱性磷酸酶融合蛋白结合伴吕中分离出blottin. 目前还没有进一步行突变分析来阐明实际的TFF2结合位点, 至今仍不知晓这2种蛋白的功能. 近年来, 酵母双杂交技术被引进于结合蛋白的筛检, 但国内外尚未发现关于酵母双杂交技术用于TFF2结合蛋白筛选的报道. 为进一步研究TFF2在胃癌浸润和转移中的作用机制, 本文采用酵母双杂交技术筛选人胃癌细胞cDNA文库中TFF2结合蛋白基因, 间接推测TFF2的功能及在胃癌中的可能作用机制.
Proquest2酵母双杂交系统、酵母感受态、醋酸锂、X-a-半乳糖苷酶(Gal)、pENTR11质粒、BP反应试剂盒、LR反应试剂盒、酵母细胞质粒提取试剂盒等购自Invitrogen公司; 限制性内切酶、T4 DNA连接酶、Taq酶、dNTP、DNA Marker等购自TaKaRa公司; 酵母YPAD培养基、不含氨基酸的酵母氮碱基等购自Oxoid公司; 各种氨基酸及质粒提取试剂盒等购自博大泰克公司; PCR引物合成、测序由上海英骏公司处理; 酵母裂解液、化学发光试剂购自Phemo公司; 反转录-聚合酶链反应(RT-PCR)试剂盒购自上海飞捷生物技术有限公司; 大肠杆菌DH5α, 人胃癌细胞cDNA文库, 本实验室保存.
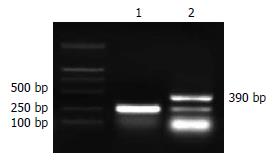
1.2.1 RT-PCR法验证TFF2 mRNA表达: 用1640+胎牛血清培养基培养胃癌细胞株SGC7901, 收集两板对数生长期细胞(>106), 按RT-PCR试剂盒步骤, 提取胃癌细胞总RNA, 逆转录合成cDNA, 分别以TFF2上下游引物(上游5'-ATG GTC GAC ATG GGA CGG CGA GAC GCC CA-3'; 下游5'-A CCG CGG CCG CTA GTA ATG GCA GTC TTC CAC AGA C-3', 产物长度为390 bp)、DAPDH上下游引物(上游5'-TGA AGG TCG GAG TCA ACG G-3', 下游5'-TGG AAG ATG GTG ATG GGA T-3', 产物长度为223 bp)配置PCR反应体系, 取PCR产物15 μL加5×Loading Buffer 4 μL 10 g/L琼脂糖凝胶电泳80 V, 30 min, 染色后凝胶成像仪成像.
1.2.2 诱饵质粒载体的构建: 购买TFF2-PCMV-SP6(GenBank: NM_005423.3), 聚合酶链反应(PCR)法扩增TFF2蛋白编码基因, 引入SalⅠ及NotⅠ酶切位点. 连接到含attP位点的pENTR11质粒中构建入门克隆, 再与含attR位点的pDEST32质粒经LR反应获得诱饵载体pDEST32-TFF2(gateway技术), 酶切及PCR鉴定后送测序鉴定. 在大肠杆菌中扩增、提取诱饵质粒.
1.2.3 优化3AT浓度、验证TFF2靶蛋白表达: 将pDEST32-TFF2诱饵质粒与pDEST22空猎物载体, 共同转化至Mav203酵母感受态细胞中, SD/-Leu/-Trp两缺固体培养基上生长, 挑取阳性克隆接种于分别含0-100 mmol/L浓度梯度氨基三唑(3-Aminotriazole, 3AT)的SD/-Leu/-Trp/-His三缺培养基上, 观察Mav203细胞的生长情况, 确定最低抑制自激活作用(指Mav203细胞自身能少量表达His)的3AT浓度.
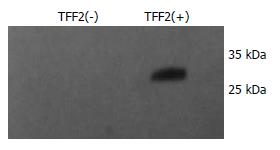
挑取两缺固体培养基上生长的阳性克隆, 用SD/-Leu一缺液体培养基摇菌过夜, 测A值为0.5-1.0, 4000 r/min离心收集阳性克隆细胞, 细胞干称质量, 加入等体积酵母裂解液裂解细胞, 12 000 r/min离心保留上清备用. 将样品及阴性对照(仅pDEST32空诱饵载体转化的Mav203细胞)的裂解上清液加入SDS上样缓冲液后100℃煮沸10 min, 迅速置入-20℃ 2 min使蛋白充分变性. 15% SDS-PAGE胶电泳跑胶, 积层胶60 V, 60 min; 分离胶80 V, 150 min, 直至溴芬兰跑至胶底缘. 80 V电转90 min将胶上的蛋白质电转移到PVDF膜. 5% BSA+TBST液封闭膜1 h, 与1:1000抗-TFF2鼠单克隆抗体+BSA 4℃孵育过夜, TBST在室温下脱色摇床上洗脱3次, 每次10 min. 与1:2000羊抗鼠二抗室温孵育2 h, TBST在室温下脱色摇床上洗脱3次, 每次10 min. 增强化学发光法进行放射自显影.
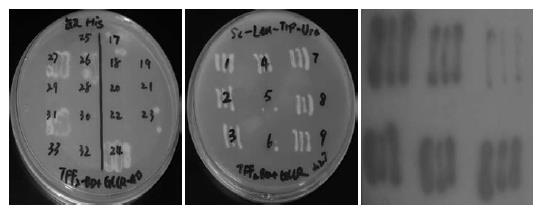
1.2.4 酵母双杂交及阳性克隆的筛选: 将pDEST32-TFF2与pDEST22-胃癌细胞cDNA文库共同转化到Mav203酵母细胞中, 转化菌液于含优化浓度3AT的SD/-Leu/-Trp/-His三缺培养基上生长, 所得克隆为表达His报告基因的克隆. 将上述克隆接种于SD/-Leu/-Trp/-Ura三缺培养基上, 所得克隆为表达His与Ura报告基因的克隆. 最后将上述克隆接种于YPAD培养皿上(含影印硝酸纤维素膜), 培养2 d后, 将影印膜上扩增的克隆用足量液氮裂解, 置于含X-gal底物的Z-buffer反应体系, 变为蓝色克隆为含有α-半乳糖苷酶活性的阳性菌落, 即为表达His、Ura、LacZ报告基因的阳性克隆.
1.2.5 阳性克隆的生物信息学分析: 共获得35个表达His、Ura、X-gal报告基因的阳性克隆, 提取酵母质粒. 应用Invitrogen公司提供的插入胃癌cDNA文库序列两端的pDEST22质粒上引物进行PCR验证, 上游引物: TCGATGATGAAGATACCCCACC, 下游引物: CTCGACGTCTTACTTACTTAGC, 阳性克隆长度约为1800 bp的等长片段. 转化大肠杆菌后送DNA测序. 提交GenBank比对, 进行生物信息学分析.
RT-PCR反应产物经10 g/L琼脂糖凝胶电泳, 可见223 bp的GAPDH内参对照条带和390 bp的TFF2特异性扩增条带(图1).
构建pDEST32-TFF2经PCR、双酶切验证成功后送测序, 提交GenBank比对后序列正确. 诱饵质粒转化酵母细胞后Western blot法可见TFF2 GAL4DBD融合蛋白表达(约31 kDa, 图2).
共转化了pDEST32-hTFF2与空猎物载体pDEST22酵母细胞MaV203可在3AT浓度20 mmol/L以下的SD/-Leu/-Trp/-His培养基上生长, 在20 mmol/L以上浓度3AT的培养基上则未见生长. 由此确定最低抑制hTFF2自激活作用的3AT浓度为20 mmol/L.
诱饵及猎物载体共转化Mav203酵母细胞后, 表达His+、Ura+、LacZ报告基因的情况如图3所示.
共获得35个表达His、Ura、X-gal报告基因的阳性克隆, 其中测序成功16个克隆, 包含12个已知蛋白基因和4个未知功能基因. 将测序成功的12个蛋白基因翻译成氨基酸序列, 与GenBank蛋白数据库进行同源性比较, 获得候选的TFF2结合蛋白的基因序列和功能(表1).
| 基因名 | GenBank号 | 基因长(aa) | 基因位置 |
| 醛酮还原酶1C1 | NM_001353.5 | 320 | 292-1252 |
| 胃蛋白酶A前体 | XM_001129398.1 | 334 | 160-1164 |
| 免疫球蛋白受体 | NM_002644.2 | 208 | 3641-4266 |
| 丙酮酸激酶 | NM_182471.1 | 142 | 2072-2498 |
| 含硒蛋白质 | NM_003009.2 | 253 | 134-893 |
| 原肌球蛋白 | NM_001018020.1 | 143 | 1367-1797 |
| 丛生蛋白 | NM_203339.1 | 326 | 577-1555 |
| 多配体聚糖 | NM_002999.2 | 167 | 1725-2228 |
| SP3转录因子 | NM_003111.3 | 296 | 1902-2792 |
| 四聚蛋白重复域 | NM_003314.1 | 321 | 1-965 |
| WD Repeat | NM_018031.2 | 291 | 966-1702 |
| Domain (WDR6) | |||
| 细胞角蛋白7 | NM_005556.3 | 245 | 966-1702 |
该实验应用Invitrogen公司酵母双杂交系统筛选人胃癌文库中与TFF2蛋白候选结合蛋白, 通过对已知候选蛋白功能的综述探讨, 推测TFF2蛋白可能与上述候选蛋白相互作用后间接启动了胃癌发生的信号转导通路、抑制肿瘤细胞凋亡、促进肿瘤转移等机制参与了胃癌的发生发展机制.
值得关注的一个候选结合蛋白是肿瘤型M2丙酮酸激酶(M2-pyruvate kinase, M2-PK), 为丙酮酸激酶(PK)家族的成员之一, 是糖酵解途径的一个关键酶, 在三磷酸核苷(ATP)的合成过程中也起着决定性作用, 有2种结构基因(L基因、M基因)和4种同工酶(L-PK、R-PK、M1-PK、M2-PK), 这4种同工酶的分布表达具有组织特异性, M2-PK主要分布于胃、肠、肺、胚胎以及增殖或未分化的组织中. Schneider et al[20]认为M2-PK可作为检测胃肠癌的具有重要价值的新肿瘤标志物. Kim et al[21]认为M2-PK与其他经典肿瘤标志物结合, 可显著提高各种癌症诊断的灵敏度. Hardt et al[22]认为M2-PK和已知的肿瘤标志物相比, 在诊断胃肠癌方面的灵敏度至少是等效的, 在结直肠癌中敏感性甚至优于CEA, 同时还可以粪便作为非侵袭性筛查, 其灵敏度达到68.8%-91.0%, 在结直肠癌筛查中甚至优于大便潜血实验. 研究发现, M2-PK在肿瘤细胞中呈过度表达. M2-PK对底物ADP的亲和力大, 对ATP抑制敏感性低, 且不受激素和饮食调节, 故M2-PK可加快糖酵解速度, 为肿瘤细胞的快速增殖提供能量. 因此设想M2-PK蛋白与TFF2蛋白相互作用后促进胃癌细胞在缺氧环境下加快糖酵解速度、为胃癌细胞的快速增殖提供能量基础? 这一机制为今后胃癌的能量代谢研究提供了可能的研究方向.
值得关注的另一个候选蛋白是AKR1C1, 属于醛酮还原酶(aldo-keto reductases, AKRs)超家族中的AKR1C亚型中的一员. AKR1C1又称20α-羟基类固醇脱氢酶, 是目前唯一已知的NADPH依赖性3-酮类固醇还原酶, 具有3β-HSD活性, 能专一性的使5α-双氢睾酮(5α-DHT)转换为3β-双氢雄酮. 3β-双氢雄酮是一种天然的雌激素受体β(ERβ)的促凋亡性配体, 而TFF基因SP1启动子旁存在着雌激素反应元件(estrogen response elements, ERE), 因此设想TFF蛋白是否与雌激素受体相关AKR1C1相互作用、并通过共同的雌激素调节途径参与胃癌细胞的代谢机制? 该机制有待进一步研究.
值得关注的另外一个候选蛋白是细胞角蛋白7(cytokeratin 7, CK7), 是上皮细胞骨架的组成成分, 表达于上皮来源的组织或细胞中. Kirchner et al[25]经实验表明, 成人胃癌中CK7阳性表达的上皮细胞是一种去分化细胞, 具有干细胞的某些特征, 如低增殖性、胎儿样特征, 致使胃上皮细胞经由肠化生、上皮内瘤变向早期胃癌发展. Gulmann et al[26]经试验表明, CK7在胃、食管、胃食管交界处腺癌3处中的表达模式无明显差异, 因此CK7阳性不能作为进一步鉴别胃癌、食管癌、胃食管交界处癌的肿瘤标志物. 因此我们设想是否CK7蛋白与TFF2蛋白结合后诱导胃黏膜上皮去分化参与胃癌的形成?该机制有待今后进一步研究.
实验室筛选到多配体聚糖(syndecan 4, SDC4), Bass et al[27]研究发现SDC4是一种广泛存在的跨膜蛋白多糖, 是一种细胞信号转导受体, 其胞质区域与一系列信号蛋白、结构蛋白相互作用, 胞外区域与一系列配体相结合, 如生长因子、胞外基质蛋白等, 胞内外结构域共同参与跨膜受体的活化, 参与G蛋白、PKC等信号通路的调节. 实验室还筛选到四聚蛋白重复域(tetratricopeptide repeat domain 1, TTR1), Marty et al[28]认为TTR1作为异源三聚体G蛋白和小GTP酶相互作用的衔接蛋白, 与活化Ras蛋白结合后参与G蛋白信号通路介导的蛋白质相互作用. 因此推测TFF2蛋白与SCD4或TTCI蛋白直接或间接相互作用启动了胃癌发生机制的信号转导通路, 为今后胃癌信号转导通路的研究提供了思路.
实验室筛选到SP3转录因子(SP3 transcription factor), 除了已知的双向调节基因转录功能, Essafi-Benkhadir et al[29]证实SP3还具有诱导细胞凋亡、促进肿瘤侵袭的双重作用; 筛选到丛生蛋白(clusterin, CLU), 他是一种分泌性糖蛋白, Jones et al[30]认为CLU能参与膜脂循环、细胞凋亡、作为应激诱导的分泌性伴侣蛋白等功能; 筛选到WDR6蛋白, Li et al[31]认为WDR6主要发挥一系列重要生物学功能如信号转导、转录调节、凋亡等, 同时还与一些疾病相关. 因此推测TFF2蛋白可能与SP3、CLU、WDR6等蛋白相互作用, 启动了抑制肿瘤细胞的凋亡、延迟细胞G1-S期转变使细胞更多地保持在G1期从而降低肿瘤细胞的增殖率、上调抑癌基因的表达等机制, 发挥促进或抑制肿瘤生长转移的功能, 为今后进一步研究TFF2蛋白抗癌或促癌机制的研究提供了思路.
总之, 我们筛选到多个TFF2相互作用蛋白, 通过对12个已知候选蛋白功能的综述探讨, 验证了TFF2蛋白可能具有胃黏膜保护、参与胃癌的发生发展功能, 与目前已知的TFF2功能相一致, 为今后研究TFF2在胃癌中的具体作用机制提供了可能的研究思路. 该实验不足之处在于酵母双杂交技术存在一定的假阳性, 虽然本实验采用的是Invitrogen公司的酵母双杂交系统ProQuestTM, 该系统特点是利用低复制质粒控制猎物基因表达, 联合3个报告基因系统以有效的控制双杂交实验中的假阳性, 因此上述候选结合蛋白与TFF2靶蛋白结合的可靠性需要进一步后续验证工作如哺乳细胞双杂交、免疫共沉淀、激光共聚焦等细胞学方法进一步研究证实.
三叶因子2(TFF2)具有胃黏膜保护功能, 在胃癌的发生发展中起到重要作用. 但其在胃癌的浸润和转移中的作用机制尚未阐明.
葛海燕, 教授, 同济大学附属第十人民医院普通外科; 陈其奎, 教授, 中山大学附属第二医院消化内科.
国内外致力于寻找TFF2结合蛋白, 以期深入探讨TFF2在胃癌中作用机制, 尚未达成一致意见.
2000年, Thim et al提取猪TFF2作为配体进行亲和层析, 发现小肠环磷腺苷cAMP受体转导蛋白CRP-ductin(muclin); 2004年, Otto et al在鼠胃中从TFF2-碱性磷酸酶融合蛋白结合伴吕中分离出blottin. 目前还没有进一步行突变分析来阐明实际的TFF2结合位点, 至今仍不知晓这2种蛋白的功能.
本研究首次将酵母双杂交技术用于胃癌细胞中TFF2结合蛋白基因筛选, 并验证了TFF2蛋白可能具有胃黏膜保护、参与胃癌的发生与发展的功能.
本研究通过对筛选的候选蛋白功能的综述探讨, 验证了TFF2蛋白可能具有胃黏膜保护、参与胃癌的发生发展功能, 与目前已知的TFF2功能相一致, 为今后研究TFF2在胃癌中的具体作用机制提供了可能的研究思路.
本文初步筛选并克隆人胃癌细胞cDNA文库中与三叶因子2蛋白相互作用蛋白的基因, 具有一定的理论意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Seib T, Blin N, Hilgert K, Seifert M, Theisinger B, Engel M, Dooley S, Zang KD, Welter C. The three human trefoil genes TFF1, TFF2, and TFF3 are located within a region of 55 kb on chromosome 21q22.3. Genomics. 1997;40:200-202. [PubMed] [DOI] |
| 3. | Thim L. Trefoil peptides: from structure to function. Cell Mol Life Sci. 1997;53:888-903. [PubMed] [DOI] |
| 4. | Calnan DP, Westley BR, May FE, Floyd DN, Marchbank T, Playford RJ. The trefoil peptide TFF1 inhibits the growth of the human gastric adenocarcinoma cell line AGS. J Pathol. 1999;188:312-317. [PubMed] [DOI] |
| 5. | Taupin D, Podolsky DK. Trefoil factors: initiators of mucosal healing. Nat Rev Mol Cell Biol. 2003;4:721-732. [PubMed] [DOI] |
| 6. | Hoffmann W, Jagla W, Wiede A. Molecular medicine of TFF-peptides: from gut to brain. Histol Histopathol. 2001;16:319-334. [PubMed] [DOI] |
| 7. | Semple JI, Newton JL, Westley BR, May FE. Dramatic diurnal variation in the concentration of the human trefoil peptide TFF2 in gastric juice. Gut. 2001;48:648-655. [PubMed] [DOI] |
| 8. | Ribieras S, Tomasetto C, Rio MC. The pS2/TFF1 trefoil factor, from basic research to clinical applications. Biochim Biophys Acta. 1998;1378:F61-F77. [PubMed] [DOI] |
| 10. | Mashimo H, Wu DC, Podolsky DK, Fishman MC. Impaired defense of intestinal mucosa in mice lacking intestinal trefoil factor. Science. 1996;274:262-265. [PubMed] [DOI] |
| 11. | Jorgensen KH, Thim L, Jacobsen HE. Pancreatic spasmolytic polypeptide (PSP): I. Preparation and initial chemical characterization of a new polypeptide from porcine pancreas. Regul Pept. 1982;3:207-219. [PubMed] [DOI] |
| 12. | Thim L, Madsen F, Poulsen SS. Effect of trefoil factors on the viscoelastic properties of mucus gels. Eur J Clin Invest. 2002;32:519-527. [PubMed] [DOI] |
| 13. | May FE, Semple JI, Newton JL, Westley BR. The human two domain trefoil protein, TFF2, is glycosylated in vivo in the stomach. Gut. 2000;46:454-459. [PubMed] [DOI] |
| 14. | Farrell JJ, Taupin D, Koh TJ, Chen D, Zhao CM, Podolsky DK, Wang TC. TFF2/SP-deficient mice show decreased gastric proliferation, increased acid secretion, and increased susceptibility to NSAID injury. J Clin Invest. 2002;109:193-204. [PubMed] [DOI] |
| 15. | Dhar DK, Wang TC, Tabara H, Tonomoto Y, Maruyama R, Tachibana M, Kubota H, Nagasue N. Expression of trefoil factor family members correlates with patient prognosis and neoangiogenesis. Clin Cancer Res. 2005;11:6472-6478. [PubMed] [DOI] |
| 16. | Tan XD, Hsueh W, Chang H, Wei KR, Gonzalez-Crussi F. Characterization of a putative receptor for intestinal trefoil factor in rat small intestine: identification by in situ binding and ligand blotting. Biochem Biophys Res Commun. 1997;237:673-677. [PubMed] [DOI] |
| 17. | Newton JL, Allen A, Westley BR, May FE. The human trefoil peptide, TFF1, is present in different molecular forms that are intimately associated with mucus in normal stomach. Gut. 2000;46:312-320. [PubMed] [DOI] |
| 18. | Thim L, Mortz E. Isolation and characterization of putative trefoil peptide receptors. Regul Pept. 2000;90:61-68. [PubMed] [DOI] |
| 19. | Otto WR, Patel K, McKinnell I, Evans MD, Lee CY, Frith D, Hanrahan S, Blight K, Blin N, Kayademir T. Identification of blottin: a novel gastric trefoil factor family-2 binding protein. Proteomics. 2006;6:4235-4245. [PubMed] [DOI] |
| 20. | Schneider J, Schulze G. Comparison of tumor M2-pyruvate kinase (tumor M2-PK), carcinoembryonic antigen (CEA), carbohydrate antigens CA 19-9 and CA 72-4 in the diagnosis of gastrointestinal cancer. Anticancer Res. 2003;23:5089-5093. [PubMed] [DOI] |
| 21. | Kim CW, Kim JI, Park SH, Han JY, Kim JK, Chung KW, Sun HS. [Usefulness of plasma tumor M2-pyruvate kinase in the diagnosis of gastrointestinal cancer]. Korean J Gastroenterol. 2003;42:387-393. [PubMed] [DOI] |
| 22. | Hardt PD, Ewald N. Tumor M2 pyruvate kinase: a tumor marker and its clinical application in gastrointestinal malignancy. Expert Rev Mol Diagn. 2008;8:579-585. [PubMed] [DOI] |
| 23. | Penning TM, Byrns MC. Steroid hormone transforming aldo-keto reductases and cancer. Ann N Y Acad Sci. 2009;1155:33-42. [PubMed] [DOI] |
| 24. | Rizner TL, Smuc T, Rupreht R, Sinkovec J, Penning TM. AKR1C1 and AKR1C3 may determine progesterone and estrogen ratios in endometrial cancer. Mol Cell Endocrinol. 2006;248:126-135. [PubMed] [DOI] |
| 25. | Kirchner T, Muller S, Hattori T, Mukaisyo K, Papadopoulos T, Brabletz T, Jung A. Metaplasia, intraepithelial neoplasia and early cancer of the stomach are related to dedifferentiated epithelial cells defined by cytokeratin-7 expression in gastritis. Virchows Arch. 2001;439:512-522. [PubMed] [DOI] |
| 26. | Gulmann C, Counihan I, Grace A, Patchett S, Leen E, Leader M, Kay E. Cytokeratin 7/20 and mucin expression patterns in oesophageal, cardia and distal gastric adenocarcinomas. Histopathology. 2003;43:453-461. [PubMed] [DOI] |
| 27. | Bass MD, Humphries MJ. Cytoplasmic interactions of syndecan-4 orchestrate adhesion receptor and growth factor receptor signalling. Biochem J. 2002;368:1-15. [PubMed] [DOI] |
| 28. | Marty C, Browning DD, Ye RD. Identification of tetratricopeptide repeat 1 as an adaptor protein that interacts with heterotrimeric G proteins and the small GTPase Ras. Mol Cell Biol. 2003;23:3847-3858. [PubMed] [DOI] |
| 29. | Essafi-Benkhadir K, Grosso S, Puissant A, Robert G, Essafi M, Deckert M, Chamorey E, Dassonville O, Milano G, Auberger P. Dual role of Sp3 transcription factor as an inducer of apoptosis and a marker of tumour aggressiveness. PLoS One. 2009;4:e4478. [PubMed] [DOI] |
| 30. | Jones SE, Jomary C. Clusterin. Int J Biochem Cell Biol. 2002;34:427-431. [PubMed] [DOI] |
| 31. | Li D, Roberts R. WD-repeat proteins: structure characteristics, biological function, and their involvement in human diseases. Cell Mol Life Sci. 2001;58:2085-2097. [PubMed] [DOI] |