修回日期: 2009-08-02
接受日期: 2009-09-07
在线出版日期: 2009-09-18
目的: 观察DcR3对SWF480结肠癌细胞系放疗前疗效评估的价值, 以及应用siRNA沉默DcR3基因对增强放疗敏感性的作用.
方法: ELISA方法检测经不同剂量放射性137Cs照射的SW480结肠癌细胞中DcR3的含量, 应用siRNA技术, 构建小双链DNA, 克隆入表达载体, 转染入经放射性照射的SW480细胞及对照组细胞. 应用图像分析系统进行记录细胞集落数量, 流式细胞仪检测细胞凋亡状况.
结果: 与对照组相比, 不同时间和不同剂量放射线照射后, SW480细胞DcR3含量均有增加(P<0.05), 当照射10 G、48 h后, 其含量明显增加. 经5 G 137Cs照射后的DcR3-siRNA-SW480转染的细胞集落数量减少. DcR3-siRNA照射的SW480细胞M1期峰值明显增高, 凋亡小体明显增加.
结论: DcR3高表达可能对放射线抵抗性有一定预示作用, DcR3-siRNA可增强SW480结肠癌细胞对放射性照射的敏感性.
引文著录: 王鲁平, 杨善明, 张鲁榕. DcR3-siRNA对SW480结肠癌细胞系放射治疗敏感性的增强作用. 世界华人消化杂志 2009; 17(26): 2722-2726
Revised: August 2, 2009
Accepted: September 7, 2009
Published online: September 18, 2009
AIM: To investigate whether small interfering RNA (siRNA) targeting decoy receptor 3 (DcR3) can sensitize colon cancer cells (SW480) to radiation treatment and analyze the significance of DcR3 expression in the prediction of radiation resistance in colon cancer before radiotherapy.
METHODS: After SW480 cells were irradiated with different doses of 137Cs gamma rays for different durations, the expression levels of DcR3 were determined by enzyme-linked immunosorbent assay (ELISA). An expression vector expressing siRNA targeting DcR3 was then constructed. After the expression vector was transfected into irradiated and unirradiated SW480 cells, the colony formation ability of these cells was determined by colony formation assay, and cell apoptosis was analyzed by flow cytometry.
RESULTS: Compared with unirradiated SW480 cells, the expression level of DcR3 increased in SW480 cells irradiated with different doses of 137Cs gamma rays for different durations, especially remarkable in cells irradiated with 10 Gy 137Cs gamma rays (P < 0.05). Compared with irradiated untransfected SW480 cells and unirradiated transfected SW480 cells, the colony formation was enhanced, the M1 peak in cell cycle was elevated and the number of apoptotic bodies increased in irradiated transfected SW480 cells.
CONCLUSION: siRNA targeting DcR3 can sensitize colon cancer cells (SW480) to radiation treatment. High DcR3 expression may predict the development of radiation resistance in colon cancer.
- Citation: Wang LP, Yang SM, Zhang LR. Small interfering RNA targeting decoy receptor 3 sensitizes colon cancer cells (SW480) to radiation treatment. Shijie Huaren Xiaohua Zazhi 2009; 17(26): 2722-2726
- URL: https://www.wjgnet.com/1009-3079/full/v17/i26/2722.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i26.2722
现代放射治疗的目的是提高肿瘤细胞对放射性物质的敏感性, 限制或降低其对正常组织细胞的作用. 但一些患者对放射治疗具有抵抗性. 有文献提出暴露在放射线下的细胞可诱导某些基因的表达, 这些基因涉及靶细胞生存和凋亡的信号传导[1]. 放射抵抗性即是与凋亡有关的基因转录和对抗凋亡的信号传导处于平衡状态. 肿瘤细胞的凋亡与Fas和FasL活性关系密切, 其活性对放射治疗后肿瘤细胞的凋亡起主要作用[2]. 诱捕受体3(decoy receptor 3, DcR3)属肿瘤坏死因子受体家族, 被认为是通过阻断FasL而减少细胞凋亡, 保护肿瘤细胞生长的分泌性基因. 我们的前期研究发现通过阻断外源性及内源性FasL, DcR3可保护乳癌细胞生长; 伴有淋巴结转移的癌[3]、及食管鳞状上皮高级别异型增生DcR3表达均明显增高[4]; 并发现经转染的DcR3-siRNA(RNA干扰)-SW480结肠癌细胞, 其DcR3 mRNA表达降低, 肿瘤细胞的生长数量减少, 凋亡表达增加[5]. 本研究检测SW480人结肠细胞癌细胞系在不同时间、不同放射剂量下的DcR3表达含量, 并观察应用siRNA沉默DcR3基因表达后SW480细胞数量及凋亡状况的变化, 观察DcR3对放疗前疗效评估的价值以及应用siRNA沉默DcR3基因对增强放疗敏感性的作用.
结肠癌细胞系SW480来自American Type Culture Collection细胞库; 培养基为含有100 mL/L胎牛血清(FBS)的DMEM细胞培养液. 转染后的SW480细胞培养条件为在上述培养基中加入G418(800 mg/L). 在进行ELISA检测及放射性处理以前, 更换10 mL/L FBS+DMEM. 于放射性实验室对SW480细胞进行不同剂量137Cs 2.5, 5, 10 Gy/min照射. 进行基因转染以前, 更换进入不含OPTI-MEM1的血清中过夜. pSilencer 2.1-U6nHygro-DcR3-dsDNA质粒(含沉默DcR3基因片段)由王鲁平医师在美国Gerogetown1大学Lombardi癌症研究中心构建并经测序与GenBank中的序列一致. Silencer siRNA Cocktail试剂盒购自美国Ambion公司; 胎牛血清、DMEM细胞培养液、G418购自Gibco公司; DcR3一抗由Sunghee Kim和张鲁榕教授惠赠; BCA蛋白检测试剂盒购自Pierce, Rockford IL公司.
1.2.1 筛选小干扰DcR3-RNA基因: 使用"Silencer siRNA Cocktail试剂盒"(美国Ambion公司)选择2个siRNA靶位点, 靶位点1(F1R1)核苷酸95-123, 靶位点2(F2R2)核苷酸247-265. 使用Online BLAST软件与GenBank中其他基因进行比较, 排除所选择靶序列与其他基因有显著性同源. F1R1 ACACCCACCTACCCCTGGC(95-123), F2R2 CTACCTGGAGCGCTGCCGC(247-265). 经基因测序证实片段序列无误.
1.2.2 构建表达载体: 将双链DNA分别克隆进入载体, 具体步骤: F1R1和F2R2双链DNA, pSilencer 2.1-U6nHygro(美国Ambion公司)各2-3 g/L, 加入50 μL conpenent细胞(大肠杆菌), 4℃, 30 min, 42℃, 15 s, 放置冰上1-2 min, 加入9倍体积SOC, 37℃, 震荡1 h, 铺于Agarose+LB培养板上, 震荡37℃过夜. 次日挑选1个克隆加入100 mL LB及卡那霉素30 mg/L, 震荡37℃过夜. 将上清弃之, 应用试剂盒纯化沉淀物中DNA(QIAprep Miniprep Kit美国), 琼脂糖凝胶电泳检测纯化物. 限制性内切酶切上述质粒, (BamHⅠ+HindⅢ), 纯化酶切产物(QIAquick gel Etraction Kit美国). 连接酶连接载体及DcR3-DNA片段. 碱裂解法大量提取纯化该质粒DNA. 吸光度值(A值)测量DNA浓度.
1.2.3 磷酸钙稳定转染法: pSilencer 2.1-U6nHygro-DcR3-dsDNA稳定转染进入SW480结肠癌细胞系. 转染前16-20 h用胰酶消化对数生长期细胞, 将细胞移置100 mm培养皿中, 细胞数1×106在100 mL/L的胎牛血清DMEM中. 转染前4 h, 再次换培养液. 配置转染液: 依次加入H2O, DNA, CaCl2, 及2×BBS, 缓慢小心混合, 静置45 min, 缓慢加入细胞内, 30 mL/L CO2孵育箱中培养. 第3天加入G418(800 mg/L FBS-DMEM), 培养筛选.
1.2.4 ELISA方法检测经137Cs放射处理SW480细胞中DcR3的表达: 挑选可在G418环境下生长的转染SW480细胞集落, DcR3-ELISA方法检测FBS-DMEM(培养液上清)中各组细胞DcR3的表达含量: ELISA程序如下: 09E02抗DcR3 mAb包被ELISA板过夜, 次日洗板, 5% BSA封阻. 加入不同浓度DcR3纯标准和各待测样品4℃过夜或37℃ 3 h. 充分洗板, 生物素标记的12B03抗DcR3抗体加入板中, 室温孵育1 h. Tween-20-TBS洗板4次. AP-Streptavidin 1 h. AP底物显色, A405下读数.
1.2.5 细胞集落形成实验: 经不同剂量、不同时间放射性137Cs处理各组及对照组SW480细胞(2×104)培养在底层为100 g/L胎牛血清的DMEM中(含有0.36%的Agarose), 上层为0.6% Agarose/100 g/L胎牛血清的DMEM培养液中, 2 wk后, 应用图像分析系统进行细胞集落数量的记录.
1.2.6 流式细胞分析DcR3-SW480-siRNA细胞对凋亡的影响: 收获DcR3-SW480-siRNA培养细胞及对照组细胞, 应用流式细胞仪(Becton Dickinson)检测其凋亡活性. Propidium 碘细胞染色暗室中90 min. 流式细胞分析Sub-G1含量. 每份标本对10 000个细胞进行分析记数. 使用细胞Quest Program进行细胞质和量的分析. 放射性照射的DcR3-SW480-siRNA细胞及对照组细胞应用多克隆兔抗Fas、Fas-L(Oncogene Inc)抗体孵育, FITC连接羊抗兔IgG作为二抗. 阳性细胞表达的百分比为荧光及免疫特殊染色阳性细胞.
统计学处理 结果以mean±SD表示, 并应用Student's检验.
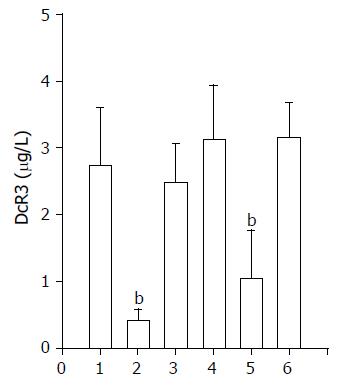
实验共设置6组, 第1组为36 h对照组; 第2组为36 h F1R1-DcR3-siRNA-SW480处理组; 第3组为36 h F2R2-DcR3-siRNA-SW480处理组; 第4组48 h对照组; 第5组为48 h F1R1-DcR3-siRNA-SW480处理组, 第6组为48 h F2R2-DcR3-siRNA-SW480处理组. 与对照组相比, 第2组和第5组的DcR3蛋白质表达水平均明显下降, 即36 h F1R1 siRNA处理组和48 h F1R1 siRNA处理组DcR3蛋白质含量下降, 统计学处理有明显差异(P<0.001, 图1).
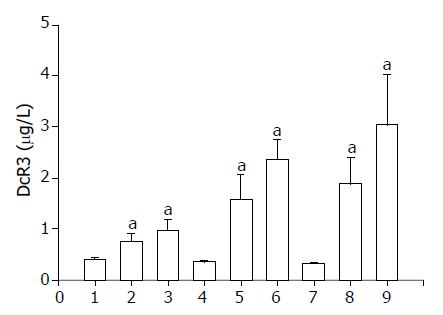
SW480细胞系表达较高水平DcR3 mRNA及蛋白含量, 但经过放射性137Cs照射其培养上清液中DcR3表达是否有改变尚不清楚. 应用ELISA方法检测经不同时间、不同剂量137Cs处理的 SW480细胞系中DcR3含量, 其结果显示不同时间和不同剂量放射性照射, 其DcR3含量明显不同. 与对照组相比, 当加入10 G、48 h后, 其含量明显增加(图2).
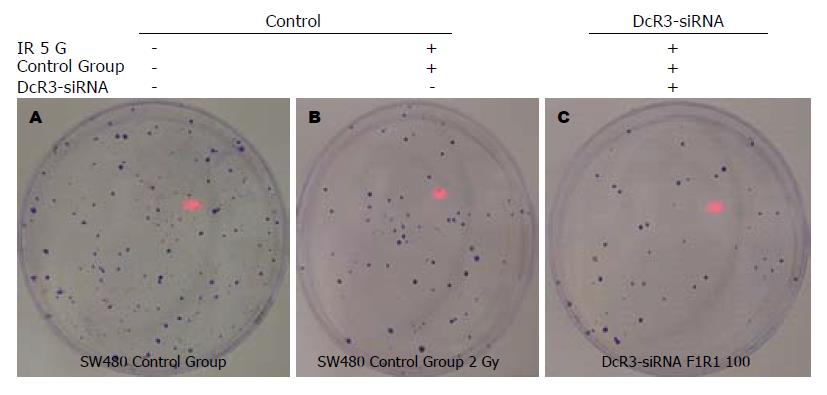
经5G放射性137Cs照射后的DcR3-SW480-siRNA转染细胞, 与未加DcR3-SW480-siRNA转染细胞、仅经过放射性137Cs处理的对照组SW480细胞相比, 肿瘤细胞克隆数量减少(图3).
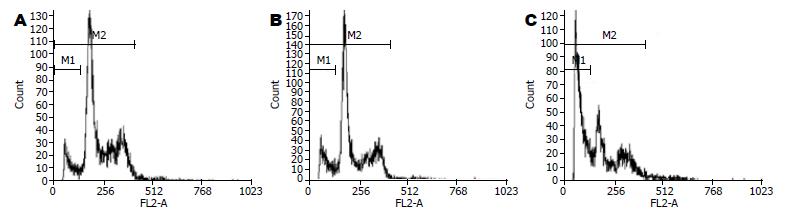
DcR3-siRNA照射的细胞, 与对照组细胞相比, M1期峰值明显增高, 其凋亡小体明显增加(图4).
现代放射治疗的目标是最大限度的杀伤肿瘤细胞, 最低程度的损伤正常细胞, 并在此前提下选择尽可能小的剂量. 要达到这一目标需要增强放疗的敏感性, 增加放疗后肿瘤细胞凋亡的数量. FasL是T淋巴细胞毒素及自然杀伤细胞的主要效应因子, 其主要功能是与细胞表面的Fas受体结合, 并通过一系列FADD/caspases而诱导凋亡, 对肿瘤细胞凋亡起着关键作用. DcR3目前认为是一个具有拮抗凋亡, 促进细胞生长的新基因. 研究表明DcR3发挥其重要生物学功能, 是因其可结合3个重要的凋亡配基: FasL, LIGHT, TLIA, 与其竞争死亡受体, 阻断其诱导凋亡的作用[6-8]. DcR3阻断FasL诱导凋亡的作用是否影响放疗后肿瘤细胞的凋亡没有文献报告. 本文首次观察经放射性照射后的SW480细胞中DcR3含量, 并为DcR3-siRNA减少放射治疗的抵抗性增强敏感性提供依据.
DcR3在许多肿瘤组织中显示过表达, 胃肠道癌、结肠癌[9]、肺癌[10]、肝癌[11]、EBV/HTLV-1阳性的淋巴瘤均伴有DcR3基因扩增或蛋白水平高表达[12]. 我们的研究结果提示DcR3在乳腺癌中的表达率为62%, 而乳腺良性病变无表达, 伴有淋巴结转移的乳腺癌DcR3表达率明显升高达80%[3]. 在此基础上, 我们应用siRNA技术, 阻断DcR3基因表达, 观察DcR3基因沉默对人SW480结肠癌细胞恶性表型的影响. 结果表明, 转染的DcR3-siRNA-SW480-F1R1细胞DcR3 mRNA表达明显降低. 与对照组相比, 转染的DcR3-siRNA-F1R1 SW480肿瘤细胞数量明显减少. 经统计学处理差异显著(P<0.05). 经DcR3-siRNA处理的细胞, 凋亡抗体PARP及caspase3的表达增强[5]. 提示应用DcR3-siRNA技术, 阻断了DcR3的基因表达, 可能使其不能与重要的凋亡配基FasL, LIGHT, TLIA结合, 由此介导肿瘤细胞产生凋亡, 肿瘤细胞的生长数量减少.
本实验结果显示, 与对照组相比, 经放射性5、10 G处理后的SW480细胞上清液中的DcR3含量从24 h便开始上升, 48 h明显上升. 这一结果提示放射性照射后确实有上调DcR3的作用, 引起这一变化的机制尚待研究. 进一步的实验发现未经放射处理的对照组SW480细胞与经5 G放射处理的SW480细胞相比, 细胞数量变化不明显. 这一结果提示可能是由于经放射性处理后DcR3含量升高, 阻断了FasL诱导凋亡的作用, 削弱放射性的作用; 从另一方面提示肿瘤细胞DcR3含量高可能是预示放疗效果欠佳的标志. 我们在以往研究的基础上[5]应用siRNA技术沉默DcR3基因转录及蛋白表达, 并观察DcR3-siRNA放射性SW480细胞的生长和凋亡情况. 经5 G放射性137Cs处理后的DcR3-SW480-siRNA转染细胞组, 与未经DcR3-siRNA转染、仅经过放射性137Cs处理组和纯SW480对照组细胞相比, 肿瘤细胞克隆数量减少. 流式细胞检测显示DcR3-siRNA处理组的放射性细胞, 与对照组细胞相比, M1期峰值明显增高, 其凋亡小体明显增加. 实验结果提示DcR3高表达可能是放射治疗抵抗性的标志之一; DcR3-siRNA阻断或减弱DcR3的表达, 放射线与DcR3-siRNA联合治疗能促进肿瘤细胞的凋亡, 增强SW480细胞对放射线的敏感性. 其机制尚待研究. 我们先前的实验研究表明, DcR3对乳腺癌MDA435细胞生长有明显促进作用, 但加入外源性FasL后, 细胞增殖明显减少[3]. 可以解释DcR3-siRNA增强放射治疗敏感性的作用, 可能是间接激活了FasL的诱导凋亡作用.
通过基因正义及沉默的方法增强放射治疗敏感性近年已有一些报告. 如重组人P53腺病毒(rAd-P53)联合放射治疗对人淋巴瘤细胞的抑制作用及其辐射增敏性研究[13]、表皮生长因子受体反义RNA联合放射治疗直肠癌的研究[14], 我们考虑放射治疗抵抗性主要是与细胞凋亡有关的基因抑制, 因此选择了DcR3这一抑制细胞凋亡的基因, 实验结果显示放射照射后的人结肠癌SW480细胞中DcR3含量升高; 经siRNA沉默该基因后, 肿瘤细胞生长数量明显减少, 凋亡数量增加. 该研究为预测患者对放射治疗是否敏感, 用基因方法增强放疗敏感性提供一定理论依据.
现代放射治疗的目标是最大限度的杀伤肿瘤细胞, 最低程度的损伤正常细胞, 并在此前提下选择尽可能小的剂量. FasL是T淋巴细胞毒素及自然杀伤细胞的主要效应因子, 其主要功能是与细胞表面的Fas受体结合, 并通过一系列FADD/caspases而诱导凋亡, 对肿瘤细胞凋亡起着关键作用. DcR3目前认为是一个具有拮抗凋亡, 促进细胞生长的新基因.
王晓艳, 副教授, 中南大学湘雅三医院消化内科
本文首次观察经放射性照射后的SW480细胞中DcR3含量, 并为DcR3-siRNA减少放射治疗的抵抗性增强敏感性提供依据.
本研究结果显示放射照射后的人结肠癌SW480细胞中DcR3含量升高; 经siRNA沉默该基因后, 肿瘤细胞生长数量明显减少, 凋亡数量增加. 该研究为预测患者对放射治疗是否敏感, 用基因方法增强放疗敏感性提供一定理论依据.
本研究实验设计合理, 具有很好的临床应用前景.
编辑: 李军亮 电编:何基才
| 1. | Mirzaie-Joniani H, Eriksson D, Sheikholvaezin A, Johansson A, Löfroth PO, Johansson L, Stigbrand T. Apoptosis induced by low-dose and low-dose-rate radiation. Cancer. 2002;94:1210-1214. [PubMed] [DOI] |
| 2. | Shinomiya N. New concepts in radiation-induced apoptosis: 'premitotic apoptosis' and 'postmitotic apoptosis'. J Cell Mol Med. 2001;5:240-253. [PubMed] [DOI] |
| 3. | 王 鲁平, 陈 键, 宁 浩勇, 刘 光, 丁 华野, 虞 积耀, Charles B, Underhill , 张 鲁榕. TR6在人乳腺癌中的功能、表达和意义. 诊断病理学杂志. 2005;12:133-136. |
| 4. | Li H, Zhang L, Lou H, Ding I, Kim S, Wang L, Huang J, Di Sant'Agnese PA, Lei JY. Overexpression of decoy receptor 3 in precancerous lesions and adenocarcinoma of the esophagus. Am J Clin Pathol. 2005;124:282-287. [PubMed] [DOI] |
| 6. | Connolly K, Cho YH, Duan R, Fikes J, Gregorio T, LaFleur DW, Okoye Z, Salcedo TW, Santiago G, Ullrich S. In vivo inhibition of Fas ligand-mediated killing by TR6, a Fas ligand decoy receptor. J Pharmacol Exp Ther. 2001;298:25-33. [PubMed] |
| 7. | Timmer T, de Vries EG, de Jong S. Fas receptor-mediated apoptosis: a clinical application? J Pathol. 2002;196:125-134. [PubMed] [DOI] |
| 8. | Yu KY, Kwon B, Ni J, Zhai Y, Ebner R, Kwon BS. A newly identified member of tumor necrosis factor receptor superfamily (TR6) suppresses LIGHT-mediated apoptosis. J Biol Chem. 1999;274:13733-13736. [PubMed] [DOI] |
| 9. | Bai C, Connolly B, Metzker ML, Hilliard CA, Liu X, Sandig V, Soderman A, Galloway SM, Liu Q, Austin CP. Overexpression of M68/DcR3 in human gastrointestinal tract tumors independent of gene amplification and its location in a four-gene cluster. Proc Natl Acad Sci U S A. 2000;97:1230-1235. [PubMed] [DOI] |
| 10. | Pitti RM, Marsters SA, Lawrence DA, Roy M, Kischkel FC, Dowd P, Huang A, Donahue CJ, Sherwood SW, Baldwin DT. Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer. Nature. 1998;396:699-703. [PubMed] [DOI] |
| 11. | Wu Y, Han B, Sheng H, Lin M, Moore PA, Zhang J, Wu J. Clinical significance of detecting elevated serum DcR3/TR6/M68 in malignant tumor patients. Int J Cancer. 2003;105:724-732. [PubMed] [DOI] |
| 12. | Ohshima K, Haraoka S, Sugihara M, Suzumiya J, Kawasaki C, Kanda M, Kikuchi M. Amplification and expression of a decoy receptor for fas ligand (DcR3) in virus (EBV or HTLV-I) associated lymphomas. Cancer Lett. 2000;160:89-97. [PubMed] [DOI] |
| 13. | Marquardt F, Rödel F, Capalbo G, Weiss C, Rödel C. Molecular targeted treatment and radiation therapy for rectal cancer. Strahlenther Onkol. 2009;185:371-378. [PubMed] [DOI] |
| 14. | Senzer N, Nemunaitis J. A review of contusugene ladenovec (Advexin) p53 therapy. Curr Opin Mol Ther. 2009;11:54-61. [PubMed] |