修回日期: 2009-08-27
接受日期: 2009-09-07
在线出版日期: 2009-09-18
目的: 观察烫伤大鼠伤后不同时间Peyer's结细胞总数及淋巴细胞亚群在营养支持影响下的变化形式, 了解不同肠内营养支持对Peyer's结内细胞亚群的影响.
方法: 选取健康SD大鼠, 随机分为标准肠内营养组(EN组, n = 32)和谷氨酰胺补给组(EN+Gln组, n = 32), 制成烫伤动物模型(30% TBSAⅢ度烫伤), 伤后早期分别给予标准肠内营养制剂(能全力)和标准肠内营养制剂+谷氨酰胺, 于伤后第1、4、7、10天观察Peyer's结细胞总数及进行流式细胞仪细胞亚群(CD3+、CD45Ra+、CD3+/CD4+、CD3+/CD8+)分析.
结果: 烫伤后Peyer's结淋巴细胞总数在伤后1 d明显减少, 主要体现为B细胞总数的减少, EN+Gln组在伤后7 d时淋巴细胞总数恢复至伤前水平[(5.29±1.03)×106vs (6.13±1.14)×106, P>0.05], 而EN组没有恢复; EN+Gln组B细胞比例及总数在7、10 d时与伤前比较无明显差异[(2.87±0.69)×106, (3.05±0.72)×106vs (3.29±0.62)×106, P>0.05], 而EN组B细胞总数在10 d时与伤前比较明显减少[(2.07±0.63)×106vs (3.29±0.62)×106, P<0.05]; CD4+和CD8+细胞在伤后两组变化不明显.
结论: 肠内谷氨酰胺补给支持能快速有效地促进Peyer's结淋巴细胞增殖, 尤其是B细胞, 增加Peyer's结内淋巴细胞总数; 有利于肠道免疫屏障的恢复和强化.
引文著录: 邓志云, 郭光华, 邢娟娟, 赵晓雷, 崔泉, 杨毅. 早期肠内谷氨酰胺补给对烫伤大鼠Peyer's结淋巴细胞亚群的影响. 世界华人消化杂志 2009; 17(26): 2679-2685
Revised: August 27, 2009
Accepted: September 7, 2009
Published online: September 18, 2009
AIM: To investigate the changes in the number of total lymphocytes and each lymphocyte subpopulation in Peyer's patches in scalded rats receiving different nutrition support, and examine the effects of glutamine (Gln) supplementation on intestinal immunity.
METHODS: Healthy adult Sprague-Dawley rats were subjected to a 30% TBSA third-degree scald injury to induce scald injury. Scalded rats were randomly divided into standard enteral nutrition group (EN group) and glutamine supplementation group (EN plus Gln group). Rats in the EN group were fed standard enteral nutrition (Nutrison Multi Fibre) while those in the EN plus Gln group were fed standard enteral nutrition plus Gln. The number of total lymphocytes and each lymphocyte subpopulation in Peyer's patches were then determined by flow cytometry on days 1, 4, 7 and 10 after feeding.
RESULTS: The number of total lymphocytes, especially B lymphocytes, in Peyer's patches significantly decreased in response to scald induction. The number of total lymphocytes in Peyer's patches in rats in the EN plus Gln group, but not in the EN group, returned to normal on day 7 after scald induction [(5.29 ± 1.03) × 106vs (6.13 ± 1.14) × 106, P > 0.05]. The total number of B cells in Peyer's patches in rats in the EN plus Gln group on days 7 and 10 showed no significant changes when compared with pre-induction value [(2.87 ± 0.69) × 106 and (3.05 ± 0.72) × 106vs (3.29 ± 0.62) × 106, respectively; both P> 0.05]. In contrast, the total number of B cells in Peyer's patches in rats in the EN group on day 10 was significantly lower than pre-induction value [(2.07 ± 0.63) × 106vs (3.29 ± 0.62) × 106; P < 0.05]. Scald induction had no significant effect on the number of CD4+ and CD8+ lymphocytes (both P > 0.05).
CONCLUSION: The number of total lymphocytes decreases significantly in response to scald induction. Early enteral glutamine supplementation can promote lymphocyte proliferation, increase the number of total lymphocytes (especially B cells) in Peyer's patches, and enhance intestinal immunity in scalded rats.
- Citation: Deng ZY, Guo GH, Xing JJ, Zhao XL, Cui Q, Yang Y. Effects of early enteral glutamine supplementation on lymphocyte subpopulations in Peyer's patches in scalded rats. Shijie Huaren Xiaohua Zazhi 2009; 17(26): 2679-2685
- URL: https://www.wjgnet.com/1009-3079/full/v17/i26/2679.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i26.2679
黏膜免疫系统的主要功能是对黏膜表面吸入或食入的大量种类繁杂的抗原进行准确识别和作出迅速正确的反应, 对有害抗原或病原体产生高效的体液和细胞免疫, 进行有效的免疫排斥或排除(immune exclusion or immune elimination)[1-4]. 在烧(创)伤后肠黏膜的缺血缺氧性损害、炎性介质和细胞因子的瀑式释放、高代谢引起营养代谢底物的缺乏等应激性变化可造成肠黏膜免疫屏障的破坏, 细菌和内毒素移位, 继而启动多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS); 有研究表明肠道屏障损伤与机体低水平谷氨酰胺(Gln)有关[5-6]. 我们于严重烫伤后早期对大鼠肠内Gln补给, 评价早期肠内添加Gln的营养支持对严重烫伤大鼠肠道Peyer's结淋巴细胞亚群影响.
成年健康SD大鼠72只, 体质量220-250 g, 雌雄兼用, 由南昌大学医学院医学实验动物科学部提供(动物合格证: 医动字021-9602). 雌雄分笼, 适应性喂养1 wk, 自由摄水饮食. FITC-CD3/PE-CD45Ra试剂盒和PE-CD4/TRI-CD8试剂盒购自Serotec公司; 谷氨酰胺由重庆药友制药有限公司惠赠; 流式细胞检(FACSC alibur流式细胞仪, BD公司)由南昌大学一附院流式细胞室完成.
1.2.1 大鼠烫伤模型的制作: SD大鼠随机分为2组, 即肠内营养组(EN组)和EN+Gln组, 2组所有大鼠均制成烫伤模型, 每组32只. 另取8只作为伤前对照, 制成假烫模型, 所得数据作为伤前参考值. 大鼠烫伤前禁食12 h, 10 g/L戊巴比妥钠(40 mg/kg)腹腔麻醉, 电推去毛, 称其质量后采用本实验中心自制蒸汽烫伤控制器, 设定压力为0.03 mPa, 温度108℃, 持续8 s, 造成总体表面积(TBSA)为30%的Ⅲ度烫伤. 伤后立即腹腔注射平衡液50 mL/kg抗休克. 将大鼠放入限制笼内饲养, 实验过程中室温保持在25℃左右, 相对湿度40%左右, 创面外用碘伏消毒, 实验室每天紫外线消毒. 于伤后1, 4, 7和10 d检测观察指标, 在每个时间点每组大鼠均为8只.
1.2.2 营养液的配制与供给: 2组大鼠给予同等热量的肠内营养物. EN组给予整蛋白型肠内营养剂能全力(nutrison multi fibre), EN+Gln组在此基础上添加Gln 0.3 g/(kg·d); 2组在层流台上将各种营养成分混匀后分装, 4℃保存, 用时复温到37℃. 伤后4 h开始灌喂营养液, 按每天731.5 kJ/kg的标准供给[7], 每天计划量分3-5次喂完, 不限饮水.
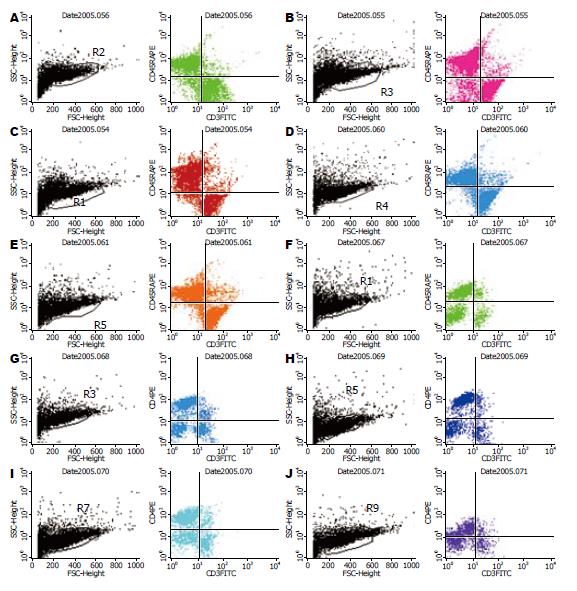
1.2.3 指标检测: (1)Peyer's结细胞的分离: Peyer's结细胞的分离按Janu et al[8]的方法进行, 具体操作步骤如下: 取大鼠回肠, 盐水冲洗肠腔, 眼科剪分离Peyer's结置于无菌培养皿中, 注射器针头撕碎, 50 kU/LⅠ型胶原酶的RPMI 1640 15 mL中37℃持续振荡并孵育60 min, 在胶原酶消化后, 细胞悬液通过200目过滤器过滤收集过滤液, Percoll梯度离心, 0.4% typan鉴定活细胞数目并计数细胞总数, 过滤液1500转离心10 min, 去上清, RPMI 1640洗涤2次后, 将细胞悬浮于含10% FBS的RPMI 1640中. 调节细胞浓度至1×109/L, 流式细胞仪待测. (2)流式细胞仪分析: 取Peyer's结细胞悬液2 mL加入专用FALCON管中, 每管1 mL. 各管中每管加入4 mL生理盐水洗涤, 1500 r/min, 离心10 min, 弃上清液, 摇匀, 然后在1号管加入FITC标记的抗CD3 mAb和PE标记的抗CD45Ra mAb, 2号管加入PE标记的抗CD4 mAb和TRI标记的抗CD8 mAb, 充分混匀, 室温避光静置15 min后, 上流式细胞仪检测. 流式细胞仪激发光为488 nm氢离子激光, 接收通道FS(前向散射)、SS(侧向散射). 观察CD3+、CD3+/CD45Ra+细胞及CD3+/CD4+细胞同CD3+/CD8+细胞的分群情况, 使用Cell-quest软件分析数据.
统计学处理 所有数据均用SPSS10.0统计软件进行分析, 用mean±SD进行统计描述, 同种处理不同时间间比较及同一时间内不同处理组间比较均采用单因素方差分析. P<0.05为差异有显著性意义, P<0.01为差异极显著.
伤后1 d时2组Peyer's结细胞总数与伤前比较明显减少(P<0.01); 4 d时2组与伤前比较仍呈减少状态(P<0.05或0.01), 7、10 d时EN组与伤前比较细胞总数仍保持较低水平(P>0.05), EN+Gln组与伤前比较差异无显著性意义(P>0.05). 组间比较伤后1、4 d时2组间差异无显著统计学意义(P>0.05); 7、10 d时EN+Gln组细胞总数明显高于EN组(P<0.05), 说明在促进Peyer's结细胞增殖方面EN+Gln优于前者(表1).
在CD3+细胞总数方面, 1 d时2组与伤前比较其总数明显减少(P<0.05), 后逐步升高, 各组其他时间点与伤前比较差异无显著性意义(P>0.05). 组间比较比较EN组、EN+Gln组在不同的时间点差异均无显著性意义(P>0.05, 表2).
在烫伤后1 d时2组CD45Ra+细胞的百分比均下降(P<0.05), 给予肠内营养支持后逐步回升, EN+Gln组 在4、7、10 d时与伤前比较差异无显著性意义(P>0.05); EN组在4、7 d时均低于伤前(P<0.05), 10 d时与伤前比较差异无显著性意义(P>0.05). 组间比较, 7 d时与EN组比较, EN+Gln组CD45Ra+细胞的百分比明显高于前者(P<0.05); 说明谷氨酰胺补给支持能更快地恢复Peyer's结CD45Ra+细胞的正常比率.
2组在烫伤后1、4 d与伤前比较其CD45Ra+细胞总数明显减少(P<0.01或0.05), 后逐步升高, EN+Gln组在7、10 d时与伤前比较差异无显著性意义(P>0.05), 而EN组CD45Ra+细胞总数在7、10 d时仍低于伤前(P<0.01或0.05). 组间比较EN+Gln组在7、10 d时CD45Ra+细胞总数明显高于EN组(P<0.05); 相对于标准肠内营养, 谷氨酰胺补给能有效地促进Peyer's结B细胞的增殖(表3).
伤后1 d时EN组Peyer's结CD4+细胞的百分比升高, 与伤前比较差异有显著性意义(P<0.05), 在肠内营养支持后其百分比逐渐下降, 各组其他时间点与伤前比较差异无显著性意义(P>0.05). 2组组间比较均无显著性差异(P>0.05), 说明2组动物Peyer's结CD4+细胞比例变化相似. 伤后各时间点CD3+/CD4+细胞总数2组均减少, 但与伤前比较差异无显著性意义(P>0.05). 2组组间比较均无显著性意义(P>0.05), 说明2组 动物Peyer's结CD3+/CD4+细胞总数在伤后变化不明显(表4).
在伤后1 d时EN组CD8+细胞的百分比明显上升(P<0.05); 后逐渐恢复正常, 在其他时间点各组与伤前比较差异均无统计学意义(P>0.05). 组间比较在各个时间点EN组及EN+Gln组之间差异均无显著性意义(P>0.05, 表5).
| 分组 | 伤前值 | 细胞百分数(%) | 伤前值 | 细胞总数(×106) | ||||||
| 1 d | 4 d | 7 d | 10 d | 1 d | 4 d | 7 d | 10 d | |||
| EN组 | 8.2±2.3 | 12.3±3.1a | 9.7±3.2 | 10.2±3.8 | 9.2±3.1 | 0.49±0.12 | 0.42±0.15 | 0.39±0.12 | 0.45±0.17 | 0.43±0.16 |
| EN+Gln组 | 9.4±2.6 | 9.1±3.8 | 9.2±3.5 | 8.6±3.3 | 0.37±0.11 | 0.43±0.19 | 0.47±0.18 | 0.46±0.14 | ||
在伤后1 d时2组CD3+/CD8+细胞的总数减少, 但与伤前比较差异无显著性意义(P>0.05); 后逐渐升高, 在其他时间点与伤前比较差异均无显著性意义(P>0.05). 在各个时间点2组组间比较之间差异均不明显(表5, 图1).
Peyer's结是肠系膜相关淋巴组织(gut-associated lymphoid tissue, GALT)的主要成员之一, 其中心区域是B细胞的富含区, 并具有生发中心, 主要含IgA+淋巴母细胞即sIgA阳性细胞, 是黏膜分泌IgA细胞的主要来源, 也是小肠内诱导免疫应答的最重要部位[9-10]. 在肠道黏膜免疫系统中, Peyer's结淋巴细胞直接参与了肠道抗原的识别、呈递和免疫效应, 他们的功能和状态直接反映了肠道黏膜免疫系统的功能和状态; 因此可以说Peyer's结构成了肠道免疫屏障的基础, 维护和优化Peyer's结内细胞结构、功能状态对于宿主的防御和维持内环境的稳定极为重要[10-13].
较多的报道指出谷氨酰胺可通过提高机体细胞免疫功能促进短半衰期蛋白质合成、调节局部及全身细胞因子的产生, 维护肠道黏膜结构及功能的完整, 从而对严重烧(创)伤及外科大手术后的免疫抑制起正向调节作用[14-17]. 本实验中我们在伤后早期即对烫伤动物进行肠内较大剂量的Gln补给, 在实验中对烧伤大鼠回肠Peyer's结淋巴细胞进行分离并计数细胞总数, 发现烧伤后各组动物Peyer's结内的淋巴细胞明显减少并持续一定时间, 2组烫伤动物在伤后第1天时与伤前比较明显减少, 这提示Peyer's结内淋巴细胞减少是烧伤后肠道免疫屏障损害的一个重要原因. 典型肠道的Peyer's结分为生发中心及富含B细胞的边缘带; 诱导部位通过冠状层与肠上皮隔离开来, 冠状层主要由B细胞、T细胞以树突状细胞及巨噬细胞构成. 大量证据表明: 诱导部位在局部免疫中起着主要作用, 包括抗原的提呈及信号传导、淋巴细胞的产生及致敏[18]; 涉及这些过程的主要包括特异IgA效应的B细胞, 记忆B细胞以及T细胞. 抗原通过M细胞转运至黏膜下的树突状细胞和巨噬细胞并提呈抗原给CD4+ T细胞和naive B细胞, T、B细胞最终分别成熟, 成为黏膜免疫组织的细胞因子产生细胞和浆细胞[19-20]. 这也可以解释维护Peyer's结的功能状态的重要意义. Langkamp-Henken et al[21]在研究中已发现蛋白质-热量营养不良、Gln缺乏等可引起GALT的功能的改变. 已有研究表明创伤后由于肠道血流的低灌注状态以及肠黏膜通透性升高, Peyer's结的淋巴细胞暴露于大量的肠腔抗原, 引起Peyer's结萎缩、凋亡致细胞数目明显减少[22]; 烫伤组烧伤后1 d细胞数目减少尤为明显, 后逐渐增加, 但EN组在实验观察时间内并没有恢复伤前水平, 而EN+Gln组在7、10 d其细胞总数高于前者且接近伤前水平, 这说明在促进伤后Peyer's结淋巴细胞增殖方面优于前者. 我们认为这可能与较大剂量的谷氨酰胺肠内补给有关. Lai et al[23]利用脓毒症的动物模型, 观察Gln补给对肠黏膜免疫的影响, 发现Gln可增加Peyer's结淋巴细胞数, 促进淋巴细胞增殖以及sIgA的分泌; 研究发现在饥饿等情况下Gln缺乏会引起细胞能量的匮乏, 肠壁中IgA+浆细胞、CD4+和CD8+淋巴细胞数明显减少, 而添加Gln后胆汁中sIgA含量和肠道T、B淋巴细胞数量与正常动物相比无显著差异[24]. 另外早期肠内Gln补给能选择性增加回肠末端血流量从而改善肠道相关淋巴组织GALT血流分布, 是促进Peyer's结淋巴细胞增殖的机制之一. 这些研究和报道无疑阐明了Gln补给在改善烧(创)伤后肠道免疫屏障功能方面的正向作用; 屏障功能的改善减少了肠腔抗原对Peyer's结细胞的刺激, 从而启动局部免疫的良性循环.
为了了解不同营养支持后Peyer's结内T、B细胞亚群的改变, 我们利用流式细胞仪对Peyer's结内细胞进行了亚群分析. 发现B细胞的百分比在烫伤后1 d时2组均下降, 而T细胞的百分比在伤后1 d时2组反而上升, 这说明二者对烧伤后的反应程度是不一致的. 在细胞总数方面两者均是下降的, 尤其在1 d时为明显, 后逐步升高并逐渐恢复. Ayala et al[25]利用脓毒症的模型, 观察大鼠肠道免疫功能的变化发现Peyer's结内细胞大量凋亡, Peyer's结细胞数目明显减少, 且细胞减少主要局限于B细胞系内. 这也证实既定的细胞系如T细胞、B细胞、巨噬细胞等, 在创伤等应激状态下, 对诱导细胞凋亡的过程反应是不同的. 这不仅在于其各自所处的内环境不同, 而是他们的存在/分化状态、肠腔内抗原类物质移位及能影响凋亡过程的细胞因子在局部的浓度或产生的变化的结果[26]. 在本实验中观察到相对于T细胞, B细胞减少更为明显, 我们推测是由于胃肠缺血等原因所致黏膜屏障降低引起Peyer's结细胞暴露于大量肠腔抗原; 已有大量的研究表明创伤、休克、感染等可导致肠腔接受肠源性抗原负荷增加[27-28]; 在我们以前的研究中已证实烧伤能引起血浆内毒素上升、全身炎症反应及相关淋巴细胞凋亡调节因子的产生与释放直接或间接诱导Peyer's结淋巴细胞凋亡[29]. Chung et al[30]利用脓毒症的动物模型发现内毒素或LPS能激活Fas/FasL通路诱导T、B的凋亡. 在一定程度上讲Peyer's结B细胞系的变化也是烧伤后Peyer's结特征性改变之一, 这将最终引起B细胞生发中心的功能性损害. 肠黏膜sIgA分泌细胞、固有层浆细胞大多起源Peyer's结, 经归巢最后定殖于固有层, Peyer's结的损害最终将影响局部的浆细胞的数量及肠黏液sIgA的分泌.
就营养支持后T、B细胞亚群总数变化方面, 尽管烧伤后EN+Gln组和EN组B细胞分别在4、10 d时恢复正常比例, 但EN组B细胞总数还是低于伤前水平, 而EN+Gln组在7 d时则接近伤前水平. T细胞总数在肠内营养支持后逐渐恢复正常水平且2组无差异, 这提示: 一方面Gln提高Peyer's结细胞总数主要是通过快速地促进B细胞的增殖, 另一方面Gln有可能通过改变T细胞亚群的功能状态而提高局部的免疫功能.
Peyer's结内B细胞的增殖和活化有赖于CD4+ T细胞的调控, mAb选择性地删除CD4+ T细胞后, 小鼠肠黏膜对口服痢疾疫苗不能产生有效的免疫应答, 提示小鼠肠黏膜免疫应答的产生必须有CD4+ T细胞的参与[31-32]. 为此我们观察了T细胞CD4+和CD8+亚群的变化. 在T细胞亚群中, CD4+细胞的百分比在伤后1 d时2组均明显上升, 在肠内营养支持后其百分比逐渐下降; 对此我们考虑一方面是由于B细胞亚群过度减少引起, 但在其细胞总数上还是明显减少的. CD4+细胞起着诱导B细胞分化的作用, 他通过分泌细胞因子促进B细胞增殖成熟, 但烧伤使其数量受到打击, 暗示上述因素可能主要影响CD4+的诱导过程或直接作用于B细胞.
总之, 本实验证实了烫伤明显地损害了Peryer's的免疫功能, 并了解了Peyer's结淋巴细胞亚群在烫伤影响下的变化形式, 体现为B淋巴细胞为主要损害对象, 其总数明显减少, 导致体液免疫损害, 从而使机体对外来抗原的反应与清除作用减弱, 处于易感状态. 相对于普通肠内营养制剂, 早期肠内补给Gln能快速有效地促进Peyer's结淋巴细胞增殖, 尤其是B细胞, 有利于肠道免疫屏障的恢复和优化.
在烧(创)伤后肠黏膜的缺血缺氧性损害、炎性介质和细胞因子的瀑式释放、高代谢引起营养代谢底物的缺乏等应激性变化可造成肠黏膜免疫屏障的破坏, 细菌和内毒素移位, 继而启动多器官功能障碍综合征. Peyer's结是肠系膜相关淋巴组织(GALT)的主要成员之一, 在肠道黏膜免疫系统中, 其淋巴细胞直接参与了肠道抗原的识别、呈递和免疫效应, 他们的功能和状态直接反映了肠道黏膜免疫系统的功能和状态. 因此可以说Peyer's结构成了肠道免疫屏障的基础, 维护和优化Peyer's结内细胞结构、功能状态对于宿主的防御和维持内环境的稳定极为重要.
程爱群, 主任医师, 上海华东医院普外科
Lai et al利用脓毒症的动物模型, 观察Gln补给对肠黏膜免疫的影响, 发现Gln可增加Peyer's结淋巴细胞数, 促进淋巴细胞增殖以及sIgA的分泌; 研究发现在饥饿等情况下Gln缺乏会引起细胞能量的匮乏, 肠壁中IgA+浆细胞、CD4+和CD8+淋巴细胞数明显减少, 而添加Gln后胆汁中sIgA含量和肠道T、B淋巴细胞数量与正常动物相比无显著差异.
本实验证实了烫伤明显地损害了Peryer's的免疫功能, 并了解了Peyer's结淋巴细胞亚群在烫伤影响下的变化形式, 体现为B淋巴细胞为主要损害对象, 其总数明显减少; 导致体液免疫损害, 从而使机体对外来抗原的反应与清除作用减弱, 处于易感状态.
本研究提示相对于普通肠内营养制剂, 早期肠内补给Gln能快速有效地促进Peyer's结淋巴细胞增殖, 尤其是B细胞, 有利于肠道免疫屏障的恢复和优化.
本研究的设计、方法和数据的收集处理比较合理, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Hermsen JL, Gomez FE, Maeshima Y, Sano Y, Kang W, Kudsk KA. Decreased enteral stimulation alters mucosal immune chemokines. JPEN J Parenter Enteral Nutr. 2008;32:36-44. [PubMed] [DOI] |
| 2. | Kang W, Kudsk KA. Is there evidence that the gut contributes to mucosal immunity in humans? JPEN J Parenter Enteral Nutr. 2007;31:246-258. [PubMed] [DOI] |
| 4. | Suzuki K, Fagarasan S. How host-bacterial interactions lead to IgA synthesis in the gut. Trends Immunol. 2008;29:523-531. [PubMed] [DOI] |
| 5. | O'Hara JR, Buret AG. Mechanisms of intestinal tight junctional disruption during infection. Front Biosci. 2008;13:7008-7021. [PubMed] |
| 6. | Bonet A, Grau T. [Glutamine, an almost essential amino acid in the critically ill patient]. Med Intensiva. 2007;31:402-406. [PubMed] [DOI] |
| 8. | Janu P, Li J, Renegar KB, Kudsk KA. Recovery of gut-associated lymphoid tissue and upper respiratory tract immunity after parenteral nutrition. Ann Surg. 1997;225:707-715; discussion 715-717. [PubMed] [DOI] |
| 9. | Casola S, Rajewsky K. B cell recruitment and selection in mouse GALT germinal centers. Curr Top Microbiol Immunol. 2006;308:155-171. [PubMed] [DOI] |
| 11. | Kwa SF, Beverley P, Smith AL. Peyer's patches are required for the induction of rapid Th1 responses in the gut and mesenteric lymph nodes during an enteric infection. J Immunol. 2006;176:7533-7541. [PubMed] |
| 12. | Forchielli ML, Walker WA. The role of gut-associated lymphoid tissues and mucosal defence. Br J Nutr. 2005;93 Suppl 1:S41-S48. [PubMed] [DOI] |
| 13. | Fagarasan S. Evolution, development, mechanism and function of IgA in the gut. Curr Opin Immunol. 2008;20:170-177. [PubMed] [DOI] |
| 14. | 宋 怀宇, 姜 春华, 杨 建荣, 陈 秋虹, 黄 钧, 梁 列新. 谷氨酰胺颗粒对重度慢性乙型病毒性肝炎患者肠道通透性、内毒素血症与肝功能的影响. 世界华人消化杂志. 2009;17:1247-1252. [DOI] |
| 15. | Calder PC. Immunonutrition in surgical and critically ill patients. Br J Nutr. 2007;98 Suppl 1:S133-S139. [PubMed] [DOI] |
| 16. | Juang P, Fish DN, Jung R, MacLaren R. Enteral glutamine supplementation in critically ill patients with burn injuries: a retrospective case-control evaluation. Pharmacotherapy. 2007;27:11-19. [PubMed] [DOI] |
| 17. | Wernerman J. Role of glutamine supplementation in critically ill patients. Curr Opin Anaesthesiol. 2008;21:155-159. [PubMed] [DOI] |
| 18. | Brandtzaeg P, Sollid LM, Thrane PS, Kvale D, Bjerke K, Scott H, Kett K, Rognum TO. Lymphoepithelial interactions in the mucosal immune system. Gut. 1988;29:1116-1130. [PubMed] [DOI] |
| 19. | Rey J, Garin N, Spertini F, Corthésy B. Targeting of secretory IgA to Peyer's patch dendritic and T cells after transport by intestinal M cells. J Immunol. 2004;172:3026-3033. [PubMed] |
| 20. | Uhlig HH, Mottet C, Powrie F. Homing of intestinal immune cells. Novartis Found Symp. 2004;263:179-188; discussion 188-192, 211-218. [PubMed] |
| 21. | Langkamp-Henken B, Glezer JA, Kudsk KA. Immunologic structure and function of the gastrointestinal tract. Nutr Clin Pract. 1992;7:100-108. [PubMed] [DOI] |
| 22. | Fan J, Xie Y, Li X, Guo G, Meng Q, Xiu Y, Li T, Feng W, Ma L. The influence of Peyer's patch apoptosis on intestinal mucosal immunity in burned mice. Burns. 2009;35:687-694. [PubMed] [DOI] |
| 23. | Lai YN, Yeh SL, Lin MT, Shang HF, Yeh CL, Chen WJ. Glutamine supplementation enhances mucosal immunity in rats with Gut-Derived sepsis. Nutrition. 2004;20:286-291. [PubMed] [DOI] |
| 25. | Ayala A, Xin Xu Y, Ayala CA, Sonefeld DE, Karr SM, Evans TA, Chaudry IH. Increased mucosal B-lymphocyte apoptosis during polymicrobial sepsis is a Fas ligand but not an endotoxin-mediated process. Blood. 1998;91:1362-1372. [PubMed] |
| 26. | Ayala A, Karr SM, Evans TA, Chaudry IH. Factors responsible for peritoneal granulocyte apoptosis during sepsis. J Surg Res. 1997;69:67-75. [PubMed] [DOI] |
| 27. | Wells CL, Barton RG, Wavatne CS, Dunn DL, Cerra FB. Intestinal bacterial flora, intestinal pathology, and lipopolysaccharide-induced translocation of intestinal bacteria. Circ Shock. 1992;37:117-123. [PubMed] |
| 28. | Foitzik T, Kruschewski M, Kroesen AJ, Hotz HG, Eibl G, Buhr HJ. Does glutamine reduce bacterial translocation? A study in two animal models with impaired gut barrier. Int J Colorectal Dis. 1999;14:143-149. [PubMed] [DOI] |
| 30. | Chung CS, Wang W, Chaudry IH, Ayala A. Increased apoptosis in lamina propria B cells during polymicrobial sepsis is FasL but not endotoxin mediated. Am J Physiol Gastrointest Liver Physiol. 2001;280:G812-G818. [PubMed] |
| 31. | Stenstad H, Ericsson A, Johansson-Lindbom B, Svensson M, Marsal J, Mack M, Picarella D, Soler D, Marquez G, Briskin M. Gut-associated lymphoid tissue-primed CD4+ T cells display CCR9-dependent and -independent homing to the small intestine. Blood. 2006;107:3447-3454. [PubMed] [DOI] |
| 32. | 张 亚东, 高 杰英, 彭 虹, 邢 丽, 曾 关富. CD4+ T细胞在痢疾疫苗诱导小鼠肠粘膜免疫应答中的作用. 细胞与分子免疫学杂志. 1999;15:115-117. |