修回日期: 2009-08-04
接受日期: 2009-08-24
在线出版日期: 2009-09-18
目的: 探讨腹内高压对肠道氧化还原状态的影响及其致肠黏膜屏障损伤机制, 为临床研究提供实验依据.
方法: 健康成年新西兰兔21只, 采用氮气气腹法制作腹内高压动物模型, 按IAP大小分为正常对照组、10、20、30 mmHg组, 按IAP维持时间分为1、2 h组, 每组3只. 制备肠黏膜组织匀浆上清液, 检测丙二醛(MDA)、氧化型谷胱甘肽(GSSG)、还原型谷胱甘肽(GSH)含量, 总抗氧化能力(T-AOC), 谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)酶活性, RT-PCR检测肠黏膜组织GPx基因表达.
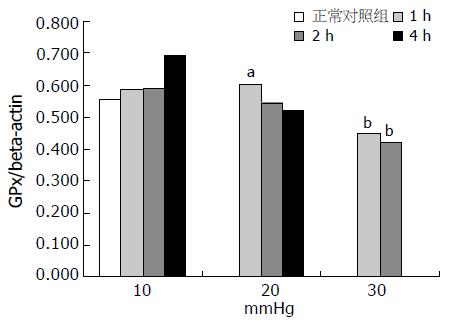
结果: 氧化性物质MDA、GSSG随时间延长及压力增高含量增加, 还原性物质GSH及T-AOC随时间延长及压力增高含量降低, GSH/GSSG比率在压力升高至20 mmHg时显著降低; GPx、CAT、SOD酶活性呈现先增高后降低的趋势, 20 mmHg 1 h GPx基因表达明显高于正常对照组(0.600 vs 0.556, P<0.05), 但随时间延长逐渐降低, 30 mmHg作用1、2 h均显著低于正常对照组(0.450, 0.420 vs 0.556, 均P<0.01).
结论: 腹内高压可导致肠道氧化还原状态失衡, 是导致肠黏膜屏障功能损害的重要因素.
引文著录: 程君涛, 李小毅, 冯智, 张诚华, 肖光夏. 腹内高压对肠黏膜氧化还原状态的影响. 世界华人消化杂志 2009; 17(26): 2673-2678
Revised: August 4, 2009
Accepted: August 24, 2009
Published online: September 18, 2009
AIM: To investigate the effect of intra-abdominal hypertension (IAH) on redox imbalance in intestinal mucosa in rabbits and explore the contribution of IAH to impairment of intestinal barrier function.
METHODS: Intra-abdominal hypertension was induced in rabbits by intraperitoneal injection of gaseous nitrogen. A pressure of 0, 10, 20 or 30 mmHg was applied, respectively. The duration of pressure application was one or two hours. The contents of malondialdehyde (MDA), reduced glutathione (GSH), oxidized glutathione (GSSG), and total antioxidant capacity (TAC) as well as the activity of catalase (CAT), superoxide dismutase (SOD) and glutathione peroxidase (GPx) in the intestine were determined. The expression of GPx mRNA in the intestine was detected using reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The contents of MDA and GSSG in intestinal mucosa increased with the increase in IAP or the duration of pressure application, while the contents of GSH and TAC showed a downward trend. The GSH/GSSG ratio dropped significantly when IAP increased to 20 mmHg. The activity of CAT, SOD and GPx increased when IAP was below 20 mmHg, but decreased when IAP exceeded 30 mmHg. The expression level of GPx mRNA in rabbits having an IAP of 20 mmHg for one hour was significantly higher than that in normal controls (0.600 vs 0.556, P < 0.05). In contrast, the expression levels of GPx mRNA in rabbits having an IAP of 30 mmHg for one or two hours were significantly lower than that in normal controls (0.450 and 0.420vs 0.556, respectively; both P < 0.01).
CONCLUSION: Elevated IAP can induce marked oxidative stress and redox imbalance in intestinal mucosa in rabbits and may therefore be an important factor leading to impairment of intestinal barrier function.
- Citation: Cheng JT, Li XY, Feng Z, Zhang CH, Xiao GX. Elevated intra-abdominal pressure induces marked oxidative stress and redox imbalance in intestinal mucosa in rabbits. Shijie Huaren Xiaohua Zazhi 2009; 17(26): 2673-2678
- URL: https://www.wjgnet.com/1009-3079/full/v17/i26/2673.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i26.2673
腹内高压(intra-abdominal hypertension, IAH)是多种内外科危重疾病的并发症, IAH持续发展是导致腹腔间隙综合征(intra-abdominal compartment syndrome, ACS)与多脏器功能衰竭的重要原因, 其危害性近年来逐渐被人们认识和重视[1-4]. 我们已发现, IAH可导致肠道血流量大幅度降低、肠道细菌内毒素移位、并导致肠黏膜屏障的损害[5-6]. 为进一步探索IAH致肠黏膜屏障损伤机制, 本研究通过对肠黏膜氧化还原相关酶的检测及基因分析, 揭示IAH对肠道氧化还原的影响, 为临床防治相关疾病提供实验依据.
健康成年新西兰兔21只, 体质量2.5-3.0 kg, 雌雄不限, 购于中国人民解放军第三军医大学大坪医院动物中心. BSA、考马氏亮蓝G-250购于Pierce公司. 丙二醛(malondialdehyde, MDA)、氧化型谷胱甘肽(oxidized glutathione, GSSG)与还原型谷胱甘肽(reduced glutathione, GSH)比率、总抗氧化能力(total-antioxidative capacity, T-AOC)检测试剂盒及谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)酶活性检测试剂盒购于南京建成生物公司. Tripure购于Roche公司. RT-PCR试剂盒购于Promega公司. Agarose(ultra pure)购于Sigma公司. 电动匀浆机(上海仪器厂). 紫外分光光度计(Biochrom Ltd, 美国). PCR仪(Hybide, 美国). 电泳仪(BIO-RAD, 美国). 凝胶扫描成像系统(BIO-RAD, 美国).
1.2.1 造模及分组: 采用氮气气腹法[5], 按腹内压力(intra-abdominal pressure, IAP)大小分为: 正常对照组、10、20、30 mmHg组, 按IAP维持时间分为1、2 h, 每组3只. 维持腹内压至相应时相点后, 开腹, 距屈氏韧带下5 cm处游离10-20 cm长肠段, 沿肠系膜侧纵向剖开, 4℃预冷生理盐水冲洗干净, 于冰上刮取肠黏膜, 滤纸吸干水分, 分装于冻存管, 置液氮保存备用. 从液氮中取出冻存之肠黏膜组织, 称质量, 按每100 mg肠黏膜组织加入1 mL生理盐水, 于冰水浴中电动匀浆器中充分匀浆; 离心(3000 r/min, 4℃, 10 min); 取上清液, 分装, -20℃保存待测.
1.2.2 肠黏膜组织中氧化性物质含量检测: (1)MDA: 采用硫代巴比妥酸法测定. (2)GSSG: 采用谷胱甘肽还原酶循环法测定.
1.2.3 肠黏膜组织中还原性物质含量检测: (1)GSH: 谷胱甘肽还原酶循环法检测. (2)T-AOC: 采用分光光度法.
1.2.4 氧化还原相关酶活性检测: (1)GPx酶活性测定: 分光光度法. (2)CAT酶活性测定: 紫外分光光度法. (3)SOD酶活性测定: 黄嘌呤氧化酶法.
1.2.5 RT-PCR检测肠黏膜组织GPx基因表达: (1)引物设计与合成: 检索GenBank, 得到新西兰兔GPx mRNA序列(X13837)以及内参照基因beta-actin mRNA序列(AF309819), 应用分子生物学软件Primer Premier设计引物序列如下: GPx: 正义5'-TGT GCG GCT CGT ATG GC-3', 反义5'-CTT GGC GTT CTC CTG ATG C-3'; beta-actin: 正义5'-CGT GCG GGA CAT CAA GGA-3', 反义5'-AGG AAG GAG GGC TGG AAC A-3'. GPx扩增目的基因片断大小为252 bp, beta-actin扩增目的基因片断大小为177 bp. 由TaKaRa公司合成引物. RT-PCR基因检测: 应用Promega RT-PCR试剂盒, 一步法检测基因表达. 2%琼脂糖(Agarose)凝胶电泳, 通过对比beta-actin内参照基因, 半定量法测定GPx的基因表达差异. 图像分析及定量: 采用BIO-RAD公司软件Quantity One, 对电泳产物行光密度测定及对比分析.
统计学处理 所有数据以mean±SD表示, 采用SPSS11.0行统计学分析. 组内数据应用配对t检验, 组间比较采用Student'st检验, 以P<0.05为有显著性差异.
实验以3个不同压力(10、20、30 mmHg)分别作用1、2 h, 检测肠黏膜组织中氧化性物质MDA、GSSG以及还原性物质GSG、T-AOC含量, 结果见表1.
| 正常对照组 | 10 mmHg | 20 mmHg | 30 mmHg | ||||
| 1 h | 2 h | 1 h | 2 h | 1 h | 2 h | ||
| MDA(nmol/mg protein) | 0.211±0.042 | 0.185±0.085 | 0.256±0.059 | 0.436±0.055a | 0.533±0.091b | 0.853±0.101b | 1.203±0.130b |
| GSH(mg/mg protein) | 34.73±3.69 | 34.24±4.52 | 36.18±4.21 | 28.55±2.33a | 30.01±3.11a | 24.48±1.72b | 22.35±1.68b |
| GSSG(mg/mg protein) | 4.88±0.83 | 5.12±1.03 | 4.65±0.95 | 11.32±1.33b | 12.85±1.11b | 23.55±2.55b | 24.82±2.68b |
| T-AOC(U/mg protein) | 12.6±3.7 | 11.2±4.4 | 13.3±4.9 | 9.5±2.3a | 8.2±3.1a | 5.3±1.6b | 4.4±1.8b |
2.1.1 MDA含量: 正常对照组肠黏膜组织MDA含量平均为0.211 nmol/mg protein, 10 mmHg组1、2 h分别为0.185 nmol/mg protein、0.256 nmol/mg protein, 与正常对照组无显著差异; 20 mmHg组1、2 h分别为0.436、0.533 nmol/mg protein, 30 mmHg组1、2 h分别为0.853、1.203 nmol/mg protein, 20、30 mmHg各组与正常对照组相比皆显著增高(P<0.05, 0.01); 相关分析显示, MDA含量与时间及压力大小呈显著正相关(r = 0.8602、0.9091, 均P<0.01).
2.1.2 GSH含量: 正常肠黏膜组织中GSH含量平均为34.73 mg/mg protein, 10 mmHg组各时相点与正常组均无显著性差异; 20 mmHg作用1、2 hGSH含量分别为28.55、30.01 mg/mg protein, 与正常对照组相比均显著降低(均P<0.05), 但各时相点间无明显差异; 30 mmHg作用1、2 h GSH含量进一步降低, 分别为24.48、22.35 mg/mg protein.
2.1.3 GSSG含量: 正常肠黏膜组织中GSSG含量平均为4.88 mg/mg protein, 10 mmHg组各时相点与正常组均无明显差异; 20 mmHg作用1、2 h GSSG含量分别为11.32、12.85 mg/mg protein, 与正常对照组相比均显著增高(P<0.01); 30 mmHg作用1、2 h GSSG含量进一步增高, 分别为23.55、24.82 mg/mg protein.
2.1.4 T-AOC: 正常肠黏膜组织总抗氧化能大小平均为12.6 U/mg protein, 随压力的增高及时间的延长逐渐下降, 至30 mmHg 2 h总抗氧化能力降低至4.4 U/mg protein, 比正常对照组下降了67%.
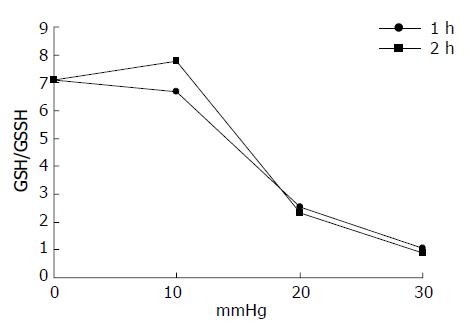
正常肠黏膜组织中GSH/GSSG比率为7.12; 压力升高至20 mmHg时显著降低, 1、2 h分别为2.52、2.34 mmHg; 30 mmHg时进一步降低, 1、2 h分别为1.04、0.90(图1).
结果表明不同压力大小及作用时间可改变氧化还原相关酶GPx、CAT、SOD的活性, 见表2.
| 正常对照组 | 10 mmHg | 20 mmHg | 30 mmHg | ||||
| 1 h | 2 h | 1 h | 2 h | 1 h | 2 h | ||
| GPx(U/mg protein) | 35.12±3.78 | 37.74±2.57 | 35.32±2.40 | 46.87±4.36b | 42.65±3.85b | 48.07±2.75b | 23.23±3.17b |
| CAT(U/g protein) | 121.6±13.7 | 116.2±14.4 | 125.3±15.9 | 157.1±18.3a | 113.2±10.1a | 145.3±19.6a | 80.4±13.8b |
| SOD(nU/mg protein) | 652.5±32.1 | 667.1±43.2 | 638.9±45.7 | 632.5±35.3 | 461.2±41.1b | 585.1±39.6a | 420.4±41.8b |
2.3.1 GPx酶活性: 正常肠黏膜组织中GPx酶活性平均为35.12 U/mg protein, 10 mmHg组各时相点与正常组均无明显差异; 20 mmHg 1 h GPx酶活性为46.87 U/mg protein, 与正常对照组相比显著增高(P<0.01), 但随时间延长逐渐降低, 显著低于正常对照组(P<0.05); 30 mmHg 1 h GPx 酶活性为48.07 U/mg protein, 明显高与正常对照组(P<0.01), 2 h即显著降低, 达23.23 U/mg protein(P<0.01).
2.3.2 CAT酶活性: 正常肠黏膜组织CAT酶活性平均为121.6 U/g protein, 10 mmHg组各时相点与正常组均无明显差异; 20 mmHg 1 h CAT酶活性显著增高至157.1 U/g protein(P<0.05), 但随时间延长逐渐降低; 30 mmHg 1 h CAT酶活性为145.3 U/g protein, 高与正常对照组(P<0.05), 但2 h即显著降低, 达80.4 U/g protein (P<0.01).
2.3.3 SOD酶活性: 正常肠黏膜组织SOD酶活性平均为652.5 nU/mg protein, 10 mmHg各时相点SOD酶活性无明显改变; 20 mmHg 1 h无显著差异, 2 h明显降低至461.2 nU/mg protein(P<0.01); 30 mmHg 1 h SOD酶活性即出现明显下降(P<0.05), 2 h进一步降低.
GPx mRNA基因表达在10 mmHg 1、2 h改变不明显; 20 mmHg 1 h基因表达明显高于正常对照组(P<0.05), 但随时间延长逐渐降低; 30 mmHg作用1、2 h均显著低于正常对照组(均P<0.01, 图2-3).
稳定的氧化还原状态(redox state)是机体正常代谢的重要保证[7]. 各种因素所导致的活性氧基团(reactive oxygen species, ROS)在体内蓄积可引发氧化应激(oxidative stress)[8], 造成氧化还原失衡(redox imbalance), 是导致多种疾病产生的重要原因[9-10]. 我们以往研究表明[11], IAH可导致呼吸、循环功能的紊乱, 并显著降低肠黏膜血流量. 本实验进一步证实, IAH可导致肠道氧化还原状态的改变, 这可能是导致肠黏膜屏障功能损害的重要原因之一.
氧自由基的生成主要通过黄嘌呤氧化酶系和髓过氧化物酶系, 黄嘌呤在黄嘌呤氧化酶及水分子、氧分子的作用下, 生成过氧化氢自由基和尿酸, 过氧化氢与超氧阴离子反应生成羟自由基, 最终生成LPO, 其中主要为MDA, 故检测肠黏膜组织中MDA含量, 可反应肠道脂质过氧化损伤[12]. 本研究表明, 肠黏膜组织MDA含量在腹内压20 mmHg作用1 h即显著增高, 且与时间及压力正相关. 提示IAH可导致氧自由基产生增多并造成肠黏膜细胞的脂质过氧化损坏. 在IAH作用下, 肠黏膜血流量急剧下降, 肠道缺血缺氧, 导致活性氧自由基大量生成. 氧自由基可触发细胞膜上多聚不饱和脂肪酸发生脂质过氧化链式反应, 破坏内质网、溶酶体、线粒体等生物膜结构并导致细胞功能的紊乱或死亡[13-14].
还原型GSH是组成机体抗氧化系统的主要成分, 在拮抗外源性毒物、氧自由基损伤、调节机体免疫功能、维持细胞蛋白质结构和功能、抑制细胞凋亡等方面起着重要作用[15]. GSH是由谷氨酸、半胱氨酸、甘氨酸组成的三肽物质, 其活性中心位于半胱氨酸α-氨基上的巯基(-SH). 其抗氧化机制, 一方面可与毒物分子直接结合降低毒性, 另一方面可通过氧化还原反应降低毒性分子的氧化能力, 保护含巯基的酶与蛋白质. GSH可通过提供H+拮抗氧自由基, 其本身在GPx作用下被氧化成GSSG, 后者通过NADPH, 在谷胱甘肽还原酶作用下还原成GSH, 构成动态平衡, 故检测GSH、GSSG及其比率变化可反映组织氧化还原状态的改变. 本研究表明, 腹内压20 mmHg作用1 h即可导致GSH的降低以及GSSG的升高, GSH/GSSG比率随腹内压力的增高及作用时间的延长显著下降. T-AOC测定结果也显示肠黏膜组织总抗氧化能力随压力增高逐渐下降, 至30 mmHg 2 h, 总抗氧化能力比正常对照组下降了67%. 结合MDA检测结果, 说明腹内压的增高及持续存在可导致肠道的氧化还原失衡.
正常状态下, 体内氧化性物质与抗氧化性物质通过各种酶及蛋白质的精密基因表达调控, 保持氧化还原状态处于动态平衡[16]. 抗氧化酶系统在活性氧清除过程中起着关键作用. 超氧阴离子在超氧化物歧化酶SOD(包括Mn-SOD和Cu/Zn-SOD)作用下发生电子转移, 生成H2O2, 后者在CAT作用下转变成无毒性的H2O分子, 达到氧自由基的清除. GPx是催化还原GSH与H2O2反应的关键酶, 在清除过氧化氢自由基、保护细胞免受过氧化损伤过程中起重要作用[17]. 我们研究表明, 腹内压20 mmHg作用1 h, SOD改变不明显, CAT以及GPx活性明显高于正常对照组; 30 mmHg作用2 h显著低于正常对照组. GPx基因表达检测结果显示, 20 mmHg 1 h基因表达明显高于正常对照组, 但随时间延长逐渐降低; 30 mmHg作用1、2 h均显著低于正常对照组. 细胞内GSH/GSSG比率的改变, 作为一种信号, 可激活JNK、P38、PI-3K以及AP-1、NF-κB等细胞内信号传导系统, 调控炎性细胞因子及抗氧化酶系统的基因表达. 腹内压作用初期酶活性的增高可能与氧自由基的大量生成、机体代偿性提高抗氧化酶的基因表达有关, 但随时间延长, GSH/GSSG比率下降, 基因表达受抑, 抗氧化酶活性随之出现降低.
总之, IAH可导致肠道氧化还原状态的严重失衡, 是造成肠黏膜损伤的重要因素. 本研究结果有助于对IAH及ACS临床救治措施的制定提供一种新的思路.
腹内高压及腹腔间隙综合征(或称腹腔室隔综合征)是近年来逐渐被认识和重视的临床危重并发症, 病死率高, 病例报道逐年增多, 但有关此方面的基础研究相对缺乏.
许文燮, 教授, 上海交通大学生命科学院生物医学工程系; 程爱国, 教授, 华北煤炭医学院临床医学系
腹内高压形成原因、对机体重要脏器功能的影响已成为目前研究的重点和热点, 如何早期干预, 防止腹内高压持续发展导致多器官功能障碍是当前亟待研究解决的关键问题.
本文进一步揭示存在肠道氧化还原状态的失衡, 并提出可能是导致肠道功能衰竭的重要因素.
及时监测和早期治疗性干预措施是降低腹内高压、腹腔间隙综合征导致多脏器功能衰竭的关键, 本文研究结果或可为进一步防治措施的制定提供一定的实验依据.
本研究目的明确, 方法先进, 统计学恰当, 结论可靠, 对腹内高压及腹腔间隙综合征临床救治措施的制定提供了一种新的思路.
编辑: 李军亮 电编:何基才
| 1. | Malbrain ML, Vidts W, Ravyts M, De Laet I, De Waele J. Acute intestinal distress syndrome: the importance of intra- abdominal pressure. Minerva Anestesiol. 2008;74:657-673. [PubMed] |
| 2. | Chen H, Li F, Sun JB, Jia JG. Abdominal compartment syndrome in patients with severe acute pancreatitis in early stage. World J Gastroenterol. 2008;14:3541-3548. [PubMed] |
| 3. | Sugrue M, Buhkari Y. Intra-abdominal pressure and abdominal compartment syndrome in acute general surgery. World J Surg. 2009;33:1123-1127. [PubMed] |
| 7. | Matés JM, Segura JA, Alonso FJ, Márquez J. Intracellular redox status and oxidative stress: implications for cell proliferation, apoptosis, and carcinogenesis. Arch Toxicol. 2008;82:273-299. [PubMed] |
| 8. | Bánhegyi G, Benedetti A, Csala M, Mandl J. Stress on redox. FEBS Lett. 2007;581:3634-3640. [PubMed] |
| 9. | Biolo G, Antonione R, De Cicco M. Glutathione metabolism in sepsis. Crit Care Med. 2007;35:S591-S595. [PubMed] |
| 10. | Babu GN, Kumar A, Chandra R, Puri SK, Singh RL, Kalita J, Misra UK. Oxidant-antioxidant imbalance in the erythrocytes of sporadic amyotrophic lateral sclerosis patients correlates with the progression of disease. Neurochem Int. 2008;52:1284-1289. [PubMed] |
| 12. | Ozmen MM, Zulfikaroglu B, Besler TH, Col C, Cinel L, Cinel I. The correlation between reactive oxygen species and histopathology of the liver, gut, and kidneys in animals with elevated intra-abdominal pressure. J Laparoendosc Adv Surg Tech A. 2009;19:339-343. [PubMed] |
| 15. | Alisi A, Piemonte F, Pastore A, Panera N, Passarelli C, Tozzi G, Petrini S, Pietrobattista A, Bottazzo GF, Nobili V. Glutathionylation of p65NF-kappaB correlates with proliferating/apoptotic hepatoma cells exposed to pro- and anti-oxidants. Int J Mol Med. 2009;24:319-326. [PubMed] |
| 16. | Foyer CH, Noctor G, Buchanan B, Dietz KJ, Pfannschmidt T. Redox Regulation in Photosynthetic Organisms: Signaling, Acclimation, and Practical Implications. Antioxid Redox Signal. 2009;11:861-905. [PubMed] |
| 17. | Toppo S, Vanin S, Bosello V, Tosatto SC. Evolutionary and structural insights into the multifaceted glutathione peroxidase (Gpx) superfamily. Antioxid Redox Signal. 2008;10:1501-1514. [PubMed] |