修回日期: 2009-05-13
接受日期: 2009-05-18
在线出版日期: 2009-09-08
EDNRB/EDN3/ECE-1信号传导通路在胚胎发育期神经嵴细胞分化、迁移、发育为神经节细胞的过程中起到关键作用. 内皮素B受体(endothelin receptor type B, EDNRB)基因突变导致该信号传导通路异常, 神经嵴细胞迁移停顿, 远端结直肠肌层间和黏膜下神经丛神经节细胞缺如而发生先天性巨结肠.
引文著录: 张万里, 王国斌, 陶凯雄. 内皮素B受体基因与先天性巨结肠关系的研究进展. 世界华人消化杂志 2009; 17(25): 2607-2611
Revised: May 13, 2009
Accepted: May 18, 2009
Published online: September 8, 2009
The endothelin receptor type B (EDNRB)/endothelin-3 (EDN3)/endothelin-converting enzyme-1 (ECE-1) signaling pathway plays an important role in the differentiation and migration of neural crest cells to form ganglion cells during embryonic development. Mutations in the EDNRB gene can give rise to abnormalities in the EDNRB/EDN3/ECE-1 signaling pathway and terminate the migration of neural crest cells. The absence of ganglion cells in the myenteric and submucosal plexuses of the distal colon and rectum results in the development of Hirschsprung's disease.
- Citation: Zhang WL, Wang GB, Tao KX. Advances in research of the relationship between endothelin receptor type B and Hirschsprung's disease. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2607-2611
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2607.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2607
先天性巨结肠(Hirschsprung's disease, HD)又称无神经节细胞症, 是一种受环境与遗传因素共同影响的神经嵴细胞源性多基因性疾病, 在新生儿中发病率约1/5000, 男女发病率之比为4:1[1]. 其发病机制为患儿在胚胎发育过程中, 遗传因素和环境因素造成神经嵴细胞分化、迁移、发育障碍, 肌层和黏膜下神经丛的神经节细胞缺如, 导致受累肠段异常收缩, 近端肠段代偿性扩张与肥厚[2-3]. HD可以分成两类表型: 病变不超过乙状结肠上部占患者总数80%的短节段表型(short-segment HSCR)和病变到达乙状结肠底部占患者总数20%的长节段表型(long-segment HSCR)[4]. 根据发病来源分类又分成散发性和家族性, 其中家族性约占20%. HD的基本病理变化是在肠壁肌间和黏膜下的神经丛内缺乏神经节细胞, 无髓鞘性的副交感神经纤维数量增加且变粗, 病变肠段痉挛状态, 90%左右的病例无神经节细胞肠段位于直肠和乙状结肠远端, 个别病例甚至波及全结肠、末端回肠或仅在直肠末端[5]. HD的发病机制目前认为与环境因素和遗传因素相关, 其中环境因素在HD发生中起着更为重要的作用. 迄今为止, 已经发现内皮素B受体(endothelin receptor type B, EDNRB)、原癌基因(ret proto-oncogene, RET)[6]、胶质细胞源性神经营养因子(glial cell derived neurotrophic factor, GDNF)、NRTN[7]、内皮素转换酶1(endothelin converting enzyme 1, ECE1)[8]、内皮素3(endothelin 3, ET3)、SOX10[9]、SIP1[10]、KIAA1279[11]以及NTRK3[12]等10种基因与HD发生有关. 在所有HD患者中EDNRB基因突变作为病因约占5%-10%, 在HD致病病因中仅次于RET占第2位[13].
EDNRB由442个氨基酸构成, 是一种G蛋白偶联受体, N端在细胞外侧, C端形成细胞内的尾巴, 中段形成7个跨膜的α螺旋结构和3个细胞外环和3个细胞内环[14]. EDNRB在人体内除脂肪细胞、结缔组织、软骨、红细胞、血小板外广泛存在, 特别是在结肠的肠肌层神经丛、黏膜层、神经节、黏膜下层的血管中含量较高[15-16]. 在生理情况下定位于细胞膜, 属于G蛋白偶联受体超家族. EDNRB与配体内皮素(endothelin, ET)结合, 通过细胞内Ca2+磷脂依赖性蛋白激酶第二信使系统将信息传入细胞内, 促进内质网和肌浆网内钙储库内Ca2+迅速释放, 胞质内Ca2+浓度迅速升高[17]. 内皮素家族包括三种亚型ET-1, ET-2和ET-3, 内皮素在人体内分布存在差异, 不同组织存在的数量和活性不同[18]. EDNRB与3种配体均具有亲和力, 其中与ET-3亲和力最强. ET多为无活性的多肽前体, 通过两步水解反应生成具有活性的大内皮素(big ET), 大内皮素在特定的内皮素转换酶(endothelin converting enzyme, ECE)作用下生成活性ET作为配体与EDNRB结合激活胞内相关第二信使系统将信息传入胞内[19]. 胚胎发育过程中, EDNRB/ET-3在神经嵴细胞迁移发育分化成神经节细胞时候扮演着重要角色, 对结直肠肠神经系统形成不可缺少[20].
EDNRB基因位于13号染色体q22, 长度大约为24 kb, GenBank ID1910, 含有7个外显子6个内含子, 其编码产物EDNRB, 与配体ET结合传递来自细胞外的信号, 其介导的信息通路对肠神经节细胞的正常分化发育形成有重要作用. 目前发现EDNRB基因参与血管发育并维持其正常功能, 以及促进神经嵴细胞和黑色素细胞生长和分化, 与Waardenburg综合征, 黑色素瘤以及HD等疾病的发病相关[21-23].
正常的EDNRB基因经过转录和翻译2个步骤产生无活性EDNRB前体, 在转录过程中, 转录因子调控EDNRB基因转录活性, 转录因子缺陷以及EDNRB基因本身原因会下调或者终止转录; 翻译过程中, mRNA碱基序列异常可能会导致不能翻译成正常具有受体活性的蛋白质产物, 转录和翻译过程出现异常均会导致EDNRB合成减少甚至完全消失[24], 使得正常的EDNRB/EDN3/ECE1信号传导路径由于缺少受体而产生HD. 从分子水平上影响基因转录的DNA分子突变原因包括: 错配(mismatch), 缺失(deletion), 插入(insertion), 其中错配可能导致编码氨基酸的改变产生错义突变或者mRNA翻译提前遇到终止密码子而结束产生无义突变, 而缺失、插入均可能导致框移(frame shift)突变产生.
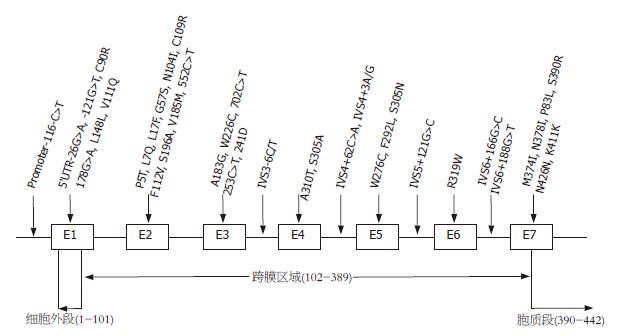
越来越多的文献报道EDNRB表达异常与HD存在相关性. 1994年Puffenberger et al[25]对HD患者EDNRB基因测序检测, 发现第四个外显子G→T错义突变(W276C), 该突变导致EDNRB高度保守的第五段跨膜螺旋276位色氨酸被半胱氨酸取代, 变异EDNRB介导诱导产生量依赖性的短暂性Ca2+流量水平下降. Auricchio et al[26]在17个非近亲结婚后代HD患者检测发现两个新的EDNRB突变位点: 散发性巨结肠患者外显子5处错义突变S305N, 使得mRNA翻译时相应的丝氨酸被天冬酰胺取代, 导致正常的磷脂化结合位点功能缺失; 家族性巨结肠患者外显子7处单核酸缺失突变N378I, 导致转录提前终止产生不完全mRNA, 翻译成的EDNRB结构不完整, 失去正常功能. Kusafuka et al[13,27]于1996年与1997年在HD患者中检测到2个单个碱基替换: 外显子四处275G→A, 827G→A, 878位插入T, 3种突变均产生终止密码子, mRNA翻译提前遇到终止密码子而产生无功能的EDNRB. 1998年Tanaka et al[28]发现3个新突变, 2个替换: 外显子2处311位A与T(N104I)和325位T被C取代(C109R), 外显子7处1170位C与A(S390R), 其中S390R和C109R突变和HSCR相关. Abe et al[29]发现HD患者A183G、W276C、R319W、M374I、P383L等5个无功能错义突变, 人工诱导该部位突变检测胞内Ca2+浓度和胞膜EDNRB表达水平, 发现两者明显下降, 5个错义突变导致的EDNRB与ET-1结合能力存在差异, EDNRB基因突变位点影响EDNRB与内皮素结合能力. 这些检测到的自然自然状态下EDNRB基因自然突变揭示了其与HD的产生紧密相关. 1994年Hosodaet al[30]通过体外杂交实验证实EDNRB基因缺失可以产生巨结肠, EDNRB基因剔除制作的转基因小鼠模型, 其他部位的大体结构正常, 结肠内也是局部短段结肠内无神经节细胞, 而不是全部结肠. Yamada et al[31]在EDNRB基因内含子1处插入一段反转录类元素导致EDNRB表达下降. Druckenbrod et al[32]小鼠胚胎干细胞靶向将loxP位点插入第3个外显子侧翼, 导致转录的mRNA剪接时由于外显子3变异而将外显子2和4剪接在一起, 制作成嵌合体小鼠, 该小鼠表型为HD. 这些非自然状态下诱导的EDNRB基因突变模型重现HD发病过程, 诠释了EDNRB基因突变和HD之间的因果关系. 总结所有HD患者中检测到的EDNRB基因突变位点和碱基变化见图1.
EDNRB基因突变目前没有找到明确的发生原因, 对于非家族遗传性患者, 突变发生的起因仍然没有明确的答案[33]. 不同的地域以及不同的种族之间基因突变率和突变位点各不相同. Inoue et al[34]对日本患者EDNRB基因突变检测, 发现外显子3处TGCAGGTAAATTT→TGCAGGCAAATTT. 1999年Sakai et al[35]发现HD外显子1非编码区域G→A, 次年检测发现外显子1非编码区域26G→A, 外显子4处A301T突变, 在所有检测的患者中EDNRB基因突变率只有10.7%[36]. Svensson et al[37]检测瑞典人EDNRB基因C109R、W226C、G57S基因突变, 基因突变率8.7%. Duan et al[38]通过单链构象多态性分析我国患者中发现EDNRB基因外显子3和外显子6处两个基因突变, 突变率为11.8%. Garcia-Barceló et al[39]全面分析我国HD患者EDNRB突变, 发现新的四个碱基突变: P383L, D241D, N426N, IVS4-14T>C. Wu et al[40]对台湾地区人群做EDNRB基因分析, 外显子4单核苷酸发生处SNP现象. Chen et al[41]对1例台湾地区新生儿EDNRB基因外显子1处C90R突变. Kim et al[42]对韩国人散发性HD患者检查发现8处基因突变: promoter-116C->T, 5'UTR-121G>T, IVS4+62C>A, IVS5+121G>C, 831G>A, IVS6+166G>C, IVS6+188G>T, IVS5+121G>C. 突变率为83.3%, Moore et al[43]对120例南非HD患者检测分析发现EDNRB基因突变率为3.3%. Sangkhathat et al[44]对泰国南部HD患者EDNRB基因检测, 外显子1处V110Q错义突变, L148L产生转录提前终止, 外显子7处K411K提前终止, 基因突变率为9.8%.
HD是一种病因复杂、由多基因与环境因素共同决定的疾病, 其发生率和表型在不同的人群中存在很大的差异. EDNRB是影响胚胎发育期间神经嵴细胞移行、发育、分化的一个重要因素, EDNRB基因碱基的插入、缺失产生框移突变, 导致mRNA翻译时密码子改变而产生异常EDNRB; 碱基替换可能产生终止密码而导致翻译提前终止, 这些突变的EDNRB基因在胚胎发育期失去正常的生理功能直接影响结直肠神经丛的产生. EDNRB基因突变能够导致HD的位点很多, 主要集中在1、2、3、4、7等5个外显子处, 而内含子和启动子突变对其影响不大, 其中某些位点在不同的文献报道中均可以检测到, 提示这些位点可能是HD的易感位点. 基因突变不能完全解释HD病因, 种族地域等环境因素和EDNRB基因突变有重要的联系, 其不仅影响突变的位点, 而且对突变位点的数目以及突变方式至关重要, 提示HD的发生与表观遗传学相关. DNA甲基化[45]、染色质组蛋白化学修饰等可能是环境因素导致疾病发生的原因之一[46]. 众多文献报道, EDNRB基因启动子区域表观遗传学改变与癌症相关[47-49]. 因此, 研究EDNRB基因与环境的关系有助于更深入的了解HD发病机制, 同时对先天性巨结肠检查筛选、预后推测以及预防有极其重要的意义.
铂类配合物是临床上广泛应用的抗肿瘤药物, 其中最常用的有顺铂、卡铂、奥沙利铂. 这些药物均有一定的毒副作用, 抗肿瘤谱窄, 易产生耐药性; 而且, 分子量小, 仅能识别2-3个碱基, 特异性不高, 易损伤正常细胞的DNA. 另外, 他们与靶分子的结合作用弱, 与DNA单加合后, 会引起DNA结构的改变, 从而导致药效的降低. 因此, 研究与经典铂类配合物结构不同的非经典的配合物, 克服现有的铂类配合物的缺点, 增加疗效, 是目前研究的重点和热点.
王正康, 教授, 北京中日友好医院普外科
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
Lin et al总结了先天性巨结肠患者中EDNRB基因突变位点和突变形式, 提示了EDNRB基因的突变潜在热点.
本文对EDNRB基因与先天性巨结肠作了全面系统的综述, 为进一步了解先天性巨结肠的发病机制提供了新的研究
方向.
本文介绍了内皮素受体B(EDNRB)突变与先天性巨结肠关系的最新研究进展, 材料校新, 简明扼要, 有参考价值, 唯内容欠丰满.
编辑: 李军亮 电编:何基才
| 1. | Haricharan RN, Georgeson KE. Hirschsprung disease. Semin Pediatr Surg. 2008;17:266-275. [PubMed] [DOI] |
| 2. | Young HM, Hearn CJ, Newgreen DF. Embryology and development of the enteric nervous system. Gut. 2000;47 Suppl 4:iv12-14; discussion iv26. [PubMed] [DOI] |
| 3. | Goyal RK, Hirano I. The enteric nervous system. N Engl J Med. 1996;334:1106-1115. [PubMed] [DOI] |
| 4. | Amiel J, Sproat-Emison E, Garcia-Barcelo M, Lantieri F, Burzynski G, Borrego S, Pelet A, Arnold S, Miao X, Griseri P. Hirschsprung disease, associated syndromes and genetics: a review. J Med Genet. 2008;45:1-14. [PubMed] [DOI] |
| 5. | Newgreen D, Young HM. Enteric nervous system: development and developmental disturbances--part 1. Pediatr Dev Pathol. 2002;5:224-247. [PubMed] [DOI] |
| 6. | Runeberg-Roos P, Saarma M. Neurotrophic factor receptor RET: structure, cell biology, and inherited diseases. Ann Med. 2007;39:572-580. [PubMed] [DOI] |
| 7. | Fernandez RM, Ruiz-Ferrer M, Lopez-Alonso M, Antiñolo G, Borrego S. Polymorphisms in the genes encoding the 4 RET ligands, GDNF, NTN, ARTN, PSPN, and susceptibility to Hirschsprung disease. J Pediatr Surg. 2008;43:2042-2047. [PubMed] [DOI] |
| 8. | Hofstra RM, Valdenaire O, Arch E, Osinga J, Kroes H, Löffler BM, Hamosh A, Meijers C, Buys CH. A loss-of-function mutation in the endothelin-converting enzyme 1 (ECE-1) associated with Hirschsprung disease, cardiac defects, and autonomic dysfunction. Am J Hum Genet. 1999;64:304-308. [PubMed] [DOI] |
| 9. | Stanchina L, Baral V, Robert F, Pingault V, Lemort N, Pachnis V, Goossens M, Bondurand N. Interactions between Sox10, Edn3 and Ednrb during enteric nervous system and melanocyte development. Dev Biol. 2006;295:232-249. [PubMed] [DOI] |
| 10. | Gao H, Li XF, Zhang ZB, Wang WL, Huang Y. [Coding-sequence point mutation and polymorphism analyses of SIP1 gene in Hirschsprung disease]. Zhonghua Yixue Yichuanxue Zazhi. 2008;25:82-85. [PubMed] [DOI] |
| 11. | Brooks AS, Bertoli-Avella AM, Burzynski GM, Breedveld GJ, Osinga J, Boven LG, Hurst JA, Mancini GM, Lequin MH, de Coo RF. Homozygous nonsense mutations in KIAA1279 are associated with malformations of the central and enteric nervous systems. Am J Hum Genet. 2005;77:120-126. [PubMed] [DOI] |
| 12. | Fernández RM, Sánchez-Mejías A, Mena MD, Ruiz-Ferrer M, López-Alonso M, Antiñolo G, Borrego S. A novel point variant in NTRK3, R645C, suggests a role of this gene in the pathogenesis of Hirschsprung disease. Ann Hum Genet. 2009;73:19-25. [PubMed] [DOI] |
| 13. | Kusafuka T, Wang Y, Puri P. Mutation analysis of the RET, the endothelin-B receptor, and the endothelin-3 genes in sporadic cases of Hirschsprung's disease. J Pediatr Surg. 1997;32:501-504. [PubMed] [DOI] |
| 14. | McCallion AS, Chakravarti A. EDNRB/EDN3 and Hirschsprung disease type II. Pigment Cell Res. 2001;14:161-169. [PubMed] [DOI] |
| 15. | Inagaki H, Bishop AE, Escrig C, Wharton J, Allen-Mersh TG, Polak JM. Localization of endothelinlike immunoreactivity and endothelin binding sites in human colon. Gastroenterology. 1991;101:47-54. [PubMed] [DOI] |
| 16. | Sakamoto A, Yanagisawa M, Sakurai T, Takuwa Y, Yanagisawa H, Masaki T. Cloning and functional expression of human cDNA for the ETB endothelin receptor. Biochem Biophys Res Commun. 1991;178:656-663. [PubMed] [DOI] |
| 17. | Nakatsuji T, Ieiri S, Masumoto K, Akiyoshi J, Taguchi T, Suita S. Intracellular calcium mobilization of the aganglionic intestine in the endothelin B receptor gene-deficient rat. J Pediatr Surg. 2007;42:1663-1670. [PubMed] [DOI] |
| 18. | Barton M, Yanagisawa M. Endothelin: 20 years from discovery to therapy. Can J Physiol Pharmacol. 2008;86:485-498. [PubMed] [DOI] |
| 19. | Kimura S, Kasuya Y, Sawamura T, Shinimi O, Sugita Y, Yanagisawa M, Goto K, Masaki T. Conversion of big endothelin-1 to 21-residue endothelin-1 is essential for expression of full vasoconstrictor activity: structure-activity relationships of big endothelin-1. J Cardiovasc Pharmacol. 1989;13 Suppl 5:S5-S7; discussion S18. [PubMed] [DOI] |
| 20. | Shin MK, Levorse JM, Ingram RS, Tilghman SM. The temporal requirement for endothelin receptor-B signalling during neural crest development. Nature. 1999;402:496-501. [PubMed] [DOI] |
| 21. | Soufir N, Meziani R, Lacapère JJ, Bertrand G, Fumeron F, Bourillon A, Gérard B, Descamps V, Crickx B, Ollivaud L. Association between endothelin receptor B nonsynonymous variants and melanoma risk. J Natl Cancer Inst. 2005;97:1297-1301. [PubMed] [DOI] |
| 22. | Moore SW. The contribution of associated congenital anomalies in understanding Hirschsprung's disease. Pediatr Surg Int. 2006;22:305-315. [PubMed] [DOI] |
| 23. | Fernandez LP, Milne RL, Pita G, Floristan U, Sendagorta E, Feito M, Avilés JA, Martin-Gonzalez M, Lázaro P, Benítez J. Pigmentation-related genes and their implication in malignant melanoma susceptibility. Exp Dermatol. 2009;18:634-642. [PubMed] [DOI] |
| 24. | Oue T, Puri P. Altered endothelin-3 and endothelin-B receptor mRNA expression in Hirschsprung's disease. J Pediatr Surg. 1999;34:1257-1260. [PubMed] [DOI] |
| 25. | Puffenberger EG, Hosoda K, Washington SS, Nakao K, deWit D, Yanagisawa M, Chakravart A. A missense mutation of the endothelin-B receptor gene in multigenic Hirschsprung's disease. Cell. 1994;79:1257-1266. [PubMed] [DOI] |
| 26. | Auricchio A, Casari G, Staiano A, Ballabio A. Endothelin-B receptor mutations in patients with isolated Hirschsprung disease from a non-inbred population. Hum Mol Genet. 1996;5:351-354. [PubMed] [DOI] |
| 27. | Kusafuka T, Wang Y, Puri P. Novel mutations of the endothelin-B receptor gene in isolated patients with Hirschsprung's disease. Hum Mol Genet. 1996;5:347-349. [PubMed] [DOI] |
| 28. | Tanaka H, Moroi K, Iwai J, Takahashi H, Ohnuma N, Hori S, Takimoto M, Nishiyama M, Masaki T, Yanagisawa M. Novel mutations of the endothelin B receptor gene in patients with Hirschsprung's disease and their characterization. J Biol Chem. 1998;273:11378-11383. [PubMed] [DOI] |
| 29. | Abe Y, Sakurai T, Yamada T, Nakamura T, Yanagisawa M, Goto K. Functional analysis of five endothelin-B receptor mutations found in human Hirschsprung disease patients. Biochem Biophys Res Commun. 2000;275:524-531. [PubMed] [DOI] |
| 30. | Hosoda K, Hammer RE, Richardson JA, Baynash AG, Cheung JC, Giaid A, Yanagisawa M. Targeted and natural (piebald- lethal) mutations of endothelin-B receptor gene produce megacolon associated with spotted coat color in mice. Cell. 1994;79:1267-1276. [PubMed] [DOI] |
| 31. | Yamada T, Ohtani S, Sakurai T, Tsuji T, Kunieda T, Yanagisawa M. Reduced expression of the endothelin receptor type B gene in piebald mice caused by insertion of a retroposon-like element in intron 1. J Biol Chem. 2006;281:10799-10807. [PubMed] [DOI] |
| 32. | Druckenbrod NR, Powers PA, Bartley CR, Walker JW, Epstein ML. Targeting of endothelin receptor-B to the neural crest. Genesis. 2008;46:396-400. [PubMed] [DOI] |
| 33. | Lin YC, Lai HS, Hsu WM, Lee PI, Chen HL, Chang MH. Mutation analysis of endothelin-B receptor gene in patients with Hirschsprung disease in Taiwan. J Pediatr Gastroenterol Nutr. 2008;46:36-40. [PubMed] [DOI] |
| 34. | Inoue M, Hosoda K, Imura K, Kamata S, Fukuzawa M, Nakao K, Okada A. Mutational analysis of the endothelin-B receptor gene in Japanese Hirschsprung's disease. J Pediatr Surg. 1998;33:1206-1208. [PubMed] [DOI] |
| 35. | Sakai T, Wakizaka A, Nirasawa Y, Ito Y. Point nucleotidic changes in both the RET proto-oncogene and the endothelin-B receptor gene in a Hirschsprung disease patient associated with Down syndrome. Tohoku J Exp Med. 1999;187:43-47. [PubMed] [DOI] |
| 36. | Sakai T, Nirasawa Y, Itoh Y, Wakizaka A. Japanese patients with sporadic Hirschsprung: mutation analysis of the receptor tyrosine kinase proto-oncogene, endothelin-B receptor, endothelin-3, glial cell line-derived neurotrophic factor and neurturin genes: a comparison with similar studies. Eur J Pediatr. 2000;159:160-167. [PubMed] [DOI] |
| 37. | Svensson PJ, Tapper-Persson M, Anvret M, Molander ML, Eng C, Nordenskjöld A. Mutations in the endothelin-receptor B gene in Hirschsprung disease in Sweden. Clin Genet. 1999;55:215-217. [PubMed] [DOI] |
| 38. | Duan XL, Zhang XS, Li GW. Clinical relationship between EDN-3 gene, EDNRB gene and Hirschsprung's disease. World J Gastroenterol. 2003;9:2839-2842. [PubMed] [DOI] |
| 39. | Garcia-Barceló M, Sham MH, Lee WS, Lui VC, Chen BL, Wong KK, Wong JS, Tam PK. Highly recurrent RET mutations and novel mutations in genes of the receptor tyrosine kinase and endothelin receptor B pathways in Chinese patients with sporadic Hirschsprung disease. Clin Chem. 2004;50:93-100. [PubMed] [DOI] |
| 40. | Wu TT, Tsai TW, Chu CT, Lee ZF, Hung CM, Su CC, Li SY, Hsieh M, Li C. Low RET mutation frequency and polymorphism analysis of the RET and EDNRB genes in patients with Hirschsprung disease in Taiwan. J Hum Genet. 2005;50:168-174. [PubMed] [DOI] |
| 41. | Chen WC, Chang SS, Sy ED, Tsai MC. A De Novo novel mutation of the EDNRB gene in a Taiwanese boy with Hirschsprung disease. J Formos Med Assoc. 2006;105:349-354. [PubMed] [DOI] |
| 42. | Kim JH, Yoon KO, Kim H, Kim JK, Kim JW, Lee SK, Seo JM. New variations of the EDNRB gene and its association with sporadic Hirschsprung's disease in Korea. J Pediatr Surg. 2006;41:1708-1712. [PubMed] [DOI] |
| 43. | Moore SW, Zaahl MG. A review of genetic mutation in familial Hirschsprung's disease in South Africa: towards genetic counseling. J Pediatr Surg. 2008;43:325-329. [PubMed] [DOI] |
| 44. | Sangkhathat S, Kusafuka T, Chengkriwate P, Patrapinyokul S, Sangthong B, Fukuzawa M. Mutations and polymorphisms of Hirschsprung disease candidate genes in Thai patients. J Hum Genet. 2006;51:1126-1132. [PubMed] [DOI] |
| 45. | Serman A, Vlahović M, Serman L, Bulić-Jakus F. DNA methylation as a regulatory mechanism for gene expression in mammals. Coll Antropol. 2006;30:665-671. [PubMed] [DOI] |
| 46. | Waggoner D. Mechanisms of disease: epigenesis. Semin Pediatr Neurol. 2007;14:7-14. [PubMed] [DOI] |
| 47. | Ellinger J, Bastian PJ, Jurgan T, Biermann K, Kahl P, Heukamp LC, Wernert N, Müller SC, von Ruecker A. CpG island hypermethylation at multiple gene sites in diagnosis and prognosis of prostate cancer. Urology. 2008;71:161-167. [PubMed] [DOI] |
| 48. | Zhou L, Feng X, Shan W, Zhou W, Liu W, Wang L, Zhu B, Yi H, Yao K, Ren C. Epigenetic and genetic alterations of the EDNRB gene in nasopharyngeal carcinoma. Oncology. 2007;72:357-363. [PubMed] [DOI] |
| 49. | Yates DR, Rehman I, Abbod MF, Meuth M, Cross SS, Linkens DA, Hamdy FC, Catto JW. Promoter hypermethylation identifies progression risk in bladder cancer. Clin Cancer Res. 2007;13:2046-2053. [PubMed] [DOI] |