修回日期: 2009-08-19
接受日期: 2009-08-24
在线出版日期: 2009-09-08
目的: 探讨抑瘤基因NGX6对结肠癌血管形成的影响.
方法: 将HT-29细胞分为3组: pcDNA3.1(+)/NGX6/HT-29组(稳定转染并表达NGX6基因的HT-29细胞)、pcDNA3.1(+)/HT-29组(转染空白质粒的HT-29细胞)及HT-29对照组. 通过鸡胚绒毛尿囊膜血管形成实验检测结肠癌细胞接种鸡胚血管形成情况. 裸鼠成瘤实验观测种植瘤及其对裸鼠的影响, 然后对种植瘤进行免疫组织化学实验检测其内部血管生成. RT-PCR检测NGX6基因及VEGF基因在各组细胞中的表达.
结果: pcDNA3.1(+)/NGX6/HT-29组鸡胚血管形成平均数量较HT-29与pcDNA3.1(+)/HT-29组明显减少(6.2±0.2 vs 8.6±0.2, 8.4±0.3, P<0.05); HT-29组裸鼠明显消瘦且pcDNA3.1(+)/NGX6/HT-29组与HT-29和pcDNA3.1(+)/HT-29组种植瘤平均质量、种植瘤微血管密度明显降低(1.83±0.25 g vs 4.06±0.20 g, 4.16±0.4 g; 1.83±0.52 vs 7.36±1.12 vs 6.96±1.43, 均P<0.05); VEGF在pcDNA3.1(+)/NGX6/HT-29细胞及种植瘤中较其余两组明显降低, 而pcDNA3.1(+)/HT-29细胞与未转染的HT-29细胞与种植瘤中呈高表达; 且HE染色切片显示HT-29组及PcDNA3.1(+)/HT-29组种植瘤血管内都有癌栓, 而PcDNA3.1(+)/NGX6/HT-29组种植瘤内未见有癌栓形成.
结论: NGX6基因能抑制结肠癌细胞HT-29血管的形成, 抑瘤基因NGX6的抑癌能力部分是通过抑制血管形成来实现的.
引文著录: 连平, 郭勤, 彭娅, 肖志明, 刘芬, 王晓艳, 沈守荣, 李桂源. 抑瘤基因NGX6对结肠癌血管形成的影响. 世界华人消化杂志 2009; 17(25): 2577-2584
Revised: August 19, 2009
Accepted: August 24, 2009
Published online: September 8, 2009
AIM: To investigate the role of nasopharyngeal carcinoma-associated gene 6 (NGX6) in tumor angiogenesis in colon cancer.
METHODS: HT-29 cells were divided into three groups, namely, untransfected cells (normal control group) and cells transfected with empty vector [pcDNA3.1(+)/HT-29 group] or vector harboring NGX6 gene [pcDNA3.1(+)/NGX6/HT-29 group]. These cells were inoculated on the chorioallantoic membrane (CAM) of fertilized chicken eggs to observe the role of NGX6 in angiogenesis in the chick chorioallantoic membrane. In addition, the cells were subcutaneously injected into nude mice. The microvessel density (MVD) in xenograft tumors was determined by immunohistochemistry. The expression of vascular endothelial growth factor (VEGF) mRNA was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: The average number of blood vessels (6.2 ± 0.2 vs 8.6 ± 0.2 and 8.4 ± 0.3, respectively; both P < 0.05), the average weight of xenograft tumors (1.83 ± 0.25 g vs 4.06 ± 0.20 g and 4.16±0.4 g, respectively; both P < 0.05) and MVD (1.83 ± 0.52 vs 7.36 ± 1.12 and 6.96 ± 1.43, respectively; both P < 0.05) in xenograft tumors were significantly lower in the pcDNA3.1(+)/NGX6/HT-29 group than in the normal control group and pcDNA3.1(+)/HT-29 group. The expression level of VEGF mRNA was also lower in the pcDNA3.1(+)/NGX6/HT-29 group than in the normal control group and pcDNA3.1(+)/HT-29 group. Lung metastases were found in nude mice in the normal control group and pcDNA3.1(+)/HT-29 group, but not in the pcDNA3.1(+)/NGX6/HT-29 group.
CONCLUSION: NGX6 gene inhibits tumor angiogenesis and metastasis in colon cancer.
- Citation: Lian P, Guo Q, Peng Y, Xiao ZM, Liu F, Wang XY, Shen SR, Li GY. Nasopharyngeal carcinoma-associated gene 6 inhibits tumor angiogenesis in colon cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2577-2584
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2577
结肠癌是最常见的人类恶性肿瘤之一, 在我国其发病率近年来呈上升趋势. NGX6基因是中南大学肿瘤研究所分子遗传室采用定位候选克隆策略克隆的候选抑瘤基因(GenBank登录号AF188239)[1-2]. 将NGX6基因分别转染鼻咽癌和结肠癌细胞后可使鼻咽癌细胞和结肠癌细胞的恶性表型得到部分逆转[3-4]. 为进一步明确NGX6在结肠癌中的作用, 我们利用鸡胚绒毛尿囊膜血管形成(angiogenesis of chick chorioallantoic membrane, CAM)实验、裸鼠成瘤实验、RT-PCR、免疫组织化学实验分析NGX6基因对结肠癌血管形成以及机制的影响, 来探讨其在结肠癌发展中的作用.
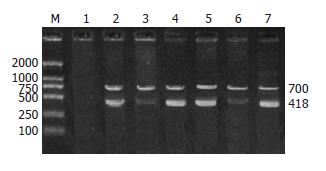
低分化结肠癌细胞系HT-29与转染空白质粒载体pcDNA3.1(+)/HT-29以及稳定转染NGX6基因的pcDNA3.1(+)/NGX6/HT-29, 用含120 mL/L胎牛血清的DMEM培基, 50 mL/L的CO2, 37℃条件下培养; 北京白鸡种鸡胚, 购自种鸡场, 37.8℃±0.5℃培养箱中孵育; ♂, Balbc/c裸鼠, 周龄4 wk, 体质量18-22 g, 购自中国科学院上海药物研究所动物中心, 饲养于湘雅医学院动物学部, 无菌净化屏障系统内饲养; 随机引物标记盒、逆转录试剂盒、Taq酶购自美国Promega公司; TRIzolTM试剂购自美国Gibco公司; 胎牛血清, DMEM培基购自华美生物工程公司; von Willebrand Factor单抗以及免疫组织化学SABC检测试剂盒与DAB显色试剂盒购自武汉博士德生物工程有限公司; PCR引物由上海博亚生物技术有限公司合成: (1)内对照GAPDH的引物: L: 5'-TGACCTGTTCCAAAGAGTCCCTG-3', R: 5'-GCAGCTTCCAGCACATATCGACT-3', 扩增目的片段为700 bp; (2)NGX6基因的引物: L: 5'-CAACAGCCTCAAGATCATCAGCA-3', R: 5'-GAGGAGGGGAGATTCAGTGTGGT-3', 扩增目的片段为498 bp; (3)VEGF引物: L: 5'-TTGCTGCTCTACCTCCAC-3', R: 5'-AATGCTTTCTCCGCTCTG-3', 扩增目的片段为418 bp.
1.2.1 RT-PCR实验: 利用TRIzolTM试剂抽提细胞总RNA, 用DNase-Ⅰ消化RNA中的痕量DNA, 按逆转录试剂盒操作程序进行逆转录. PCR结果的琼脂糖电泳照片用TIPAS98图像分析仪的图像分析系统进行灰度扫描.
1.2.2 CAM实验: 鸡胚孵育第7天, 选取孵育完好的种鸡胚, 取对数生长期的HT-29、pcDNA3.1(+)/HT-29 pcDNA3.1(+)/NGX6/HT-29 3组癌细胞悬液30 μL含4×106个, 分别接种到鸡胚CAM表面, 再用透明胶纸封好, 继续孵育21 d后取出观测拍照. 计数CAM上由瘤体放射发出的血管数.
1.2.3 裸鼠成瘤实验: 取对数生长期的HT-29、pcDNA3.1(+)/HT-29、pcDNA3.1(+)/NGX6/HT-29 3组癌细胞悬液0.1 mL(5×107/mL), 接种于4周龄裸鼠的前肢腋下, 定时观测裸鼠生长情况及移植瘤生长情况, 分两批于30 d及60 d处死裸鼠, 测量裸鼠以及移植瘤质量, 并用甲醛固定石蜡包埋制成病理切片做HE染色.
1.2.4 免疫组织化学实验: 将组织切片在65℃恒温箱中烘烤60 min, 然后趁热将组织切片置于二甲苯中浸泡10 min, 更换二甲苯后再浸泡10 min, 无水乙醇中浸泡5 min, 950 mL/L乙醇中浸泡5 min, 700 mL/L乙醇中浸泡5 min, 500 mL/L乙醇中浸泡5 min, PBS洗3次各5 min; 用配置新鲜的3% H2O2, 室温封闭30 min, PBS洗3次各5 min. 抗原修复: 微波炉里加热0.01 mol/L枸橼酸钠缓冲溶液(pH6.0)至沸腾后将组织芯片放入, 断电, 间隔10 min, 反复3次, PBS洗3次各5 min; 滴加正常山羊血清封闭液, 室温20 min, 甩去多余液体; 滴加Ⅰ抗, 4℃过夜; PBS洗3次每次2 min, 滴加生物素化二抗, 室温下30 min; PBC洗3次每次2 min, 滴加试剂SABC, 室温下20 min; PBS洗4次每次5 min, DAB显色(镜下掌握显色程度); 蒸馏水洗, 苏木素复染4 min、盐酸乙醇分化; 脱水、透明、封片、镜检.
统计学处理 应用SPSS11.0统计分析软件对所得数据进行相关检验, 检验水准P = 0.05.
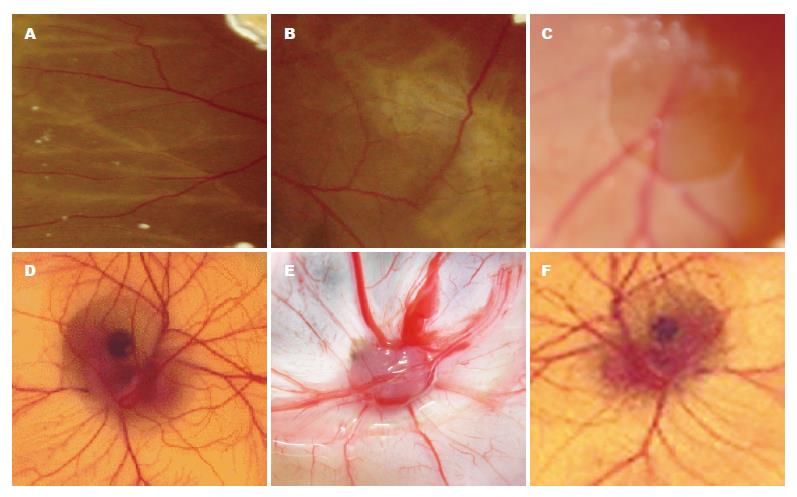
分别将30 µL含4×106的HT-29、pcDNA3.1(+)/NGX6/HT-29、pcDNA3.1(+)/HT-29 3种细胞接种于CAM表面, 置37.8℃±0.5℃培养箱中孵育. 细胞接种24 h后, CAM血管开始向接种部位生长; 第2天, 新生小血管直接趋向接种部位; 第3天, 新生血管形成以接种部位为中心的放射状血管网; 尔后随培养时间的延长, 血管数目及直径均明显增加. 非接种部位与接种部位比较, CAM血管数目少, 大血管与小血管呈脉样均匀分布. 接种后第11天拍照, 见PBS对照组未形成放射状血管网, 而HT-29组、pcDNA3.1(+)/HT-29组及pcDNA3.1(+)/NGX6/HT-29组均形成放射状血管网, 但pcDNA3.1(+)/NGX6/HT-29组较前两组血管数目明显减少, 计数pcDNA3.1(+)/NGX6/HT-29组鸡胚血管形成平均为6.2±0.2条, HT-29组鸡胚血管形成平均为8.6±0.2条, pcDNA3.1(+)/HT-29组鸡胚血管形成平均为8.4±0.3条, pcDNA3.1(+)/NGX6/HT-29组细胞pcDNA3.1(+)/HT-29组细胞及HT-29组细胞CAM血管数比较(P<0.05, 图1).
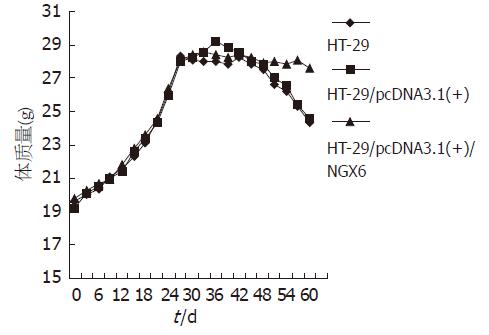
将HT-29组、PcDNA3.1(+)/HT-29组、PcDNA3.1(+)/NGX6/HT-29组3组肿瘤细胞悬液接种于裸鼠腋前皮下后, 2组裸鼠有一个体质量增长的过程, 3组裸鼠间无明显差别, 至第30天时, 3组裸鼠体质量变化无差异(P>0.05). 从第51天HT-29组与PcDNA3.1(+)/HT-29组裸鼠体质量有所下降, 缓慢消瘦, 至第60天时, 可见HT-29组与PcDNA3.1(+)/HT-29组裸鼠与PcDNA3.1(+)/NGX6/HT-29组裸鼠比较消瘦明显(图2). 3组裸鼠体质量变化有显著性差异(P<0.05).
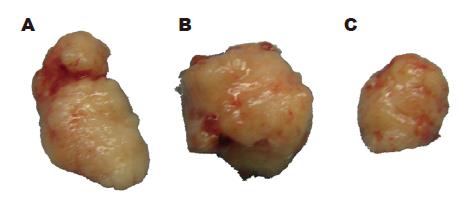
将HT-29组、PcDNA3.1(+)/HT-29组、PcDNA3.1(+)/NGX6/HT-29组3组肿瘤细胞悬液以0.1 mL(含5×106个肿瘤细胞)分别接种于裸鼠腋前皮下. 接种瘤细胞7 d后, 在种植部位可触摸到一小点突起感的种植灶, 其后可见种植瘤迅速生长, 至16-23 d, 3组种植瘤生长均有增长缓慢期, 而后HT-29组及PcDNA3.1(+)/HT-29组种植瘤又开始迅速生长, 而PcDNA3.1(+)/NGX6/HT-29组种植瘤停滞于此增长缓慢期, 至第37天后, PcDNA3.1(+)/NGX6/HT-29组种植瘤亦开始迅速生长, 但仍不及HT-29组及PcDNA3.1(+)/HT-29组种植瘤增长, 至第60天处理裸鼠时, HT-29组种植瘤平均4.06±0.20 g, PcDNA3.1(+)/HT-29组种植瘤平均4.16±0.43 g, PcDNA3.1(+)/NGX6/HT-29组种植瘤平均1.83±0.25 g, 3组种植瘤质量有显著性差异(P<0.05, 图3).
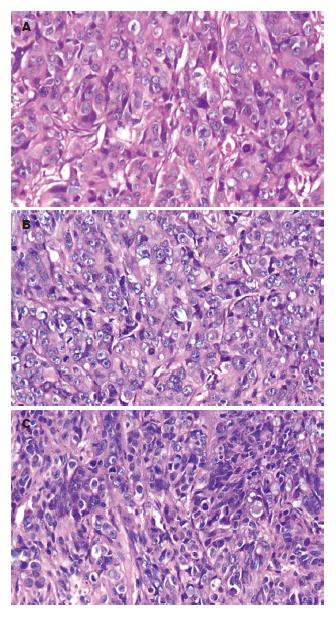
将结肠癌细胞接种于裸鼠腋前皮下后, 分第30天与第60天两批处理裸鼠. 取出种植灶(图4), 经HE染色切片证实均为低分化结肠腺癌.
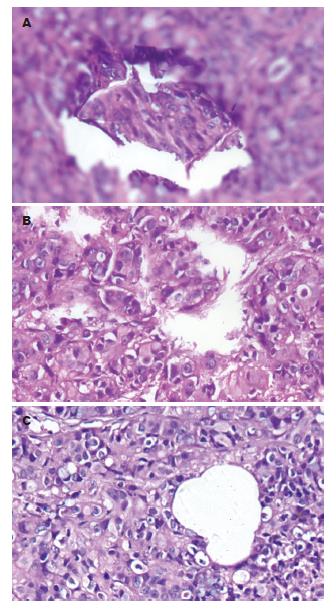
pcDNA3.1(+)/NGX6/HT-29组种植瘤微血管密度较HT-29组及pcDNA3.1(+)/HT-29组明显减少(图5). 种植瘤微血管密度按文献方法[5]用3个200倍视野下的血管数目的平均数表示, HT-29组种植瘤微血管7.36±1.12条, pcDNA3.1(+)/HT-29组6.96±1.43条, pcDNA3.1(+)/NGX6/HT-29组种植瘤微血管密度1.83±0.52, 3组种植瘤微血管密度有显著性差异(P<0.05).
VEGF在pcDNA3.1(+)/NGX6/HT-29细胞及种植瘤中较其余两组细胞与种植六表达明显降低, 而pcDNA3.1(+)/HT-29细胞和未转染的HT-29细胞与种植瘤中呈高表达(图6).
将结肠癌细胞接种于裸鼠腋前皮下后, 第60天处理裸鼠. 取出种植灶, 经HE染色切片显示HT-29组及PcDNA3.1(+)/HT-29组种植瘤血管内都有癌栓, 而PcDNA3.1(+)/NGX6/HT-29组种植瘤内未见有癌栓形成(图7).
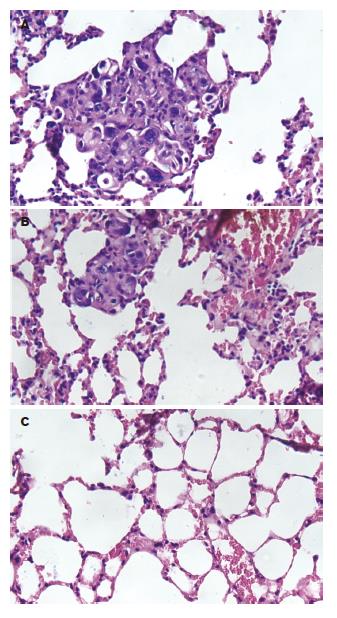
处理裸鼠时, HT-29组及PcDNA3.1(+)/HT-29组裸鼠肺脏表面发现有灰白色结节, 而PcDNA3.1(+)/NGX6/HT-29组裸鼠肺脏表面未发现. 经HE染色切片证实HT-29组及PcDNA3.1(+)/HT-29组裸鼠肺脏表面灰白色结节为低分化结肠腺癌, PcDNA3.1(+)/NGX6/HT-29组裸鼠肺脏HE染色经连续切片未发现有转移灶(图8). 3组裸鼠肝、脾、肾及脑均未见有结肠癌转移灶.
生物信息学分析显示, NGX6基因cDNA预测编码蛋白含有2个跨膜结构域(第234-256位氨基酸, 269-291), 胞外区含有1个EGF样结构域(185-221)和3个糖基化位点(92-95, 100-103, 172-175), 胞内区较短, 含有一个酪氨酸激酶磷酸化位点(257-265), 其EGF样结构域应该是其发挥生物学功能的结构基础[6]. 我们的前期工作已经证实NGX6基因在结肠癌, 尤其是有远处转移的结肠癌中表达明显下降甚至缺失[7], 而在结肠癌转移过程中, 经血行转移是结肠癌转移最为重要的途径. 实验研究表明EGF样结构域与肿瘤血管的生成有着密切的关系[8-9]. Li et al研究发现Urokinase氨基端片段通过其EGF样结构域能抑制肿瘤血管生成从而抑制肿瘤生长, 并且抑制肿瘤转移[10]. Laminin是位于基底膜上的糖蛋白, Laminin的B1亚单位是Laminin与胶原和细胞受体结合的部位, B1包含了几个EGF样结构域, 具体的结合部位正处于EGF样结构域中, 如果失去该段结合部位, Laminin介导的细胞黏附、迁移和受体结合就无法进行[11]. Laminin对细胞的运动、生长及分化起调节作用, 而且与肿瘤的浸润转移有关[12]. Nakano et al的研究表明具有EGF样结构域的NTAK/Neuregulin-2具有抗血管生成的作用[13]. 近年来更有实验研究表明一些含EGF样结构域的蛋白正是通过EGF样结构域影响肿瘤血管生成从而抑制肿瘤并且抑制肿瘤转移的[14]. NGX6基因亦有可能依靠其EGF样结构域在影响肿瘤血管生成方面发挥了作用. 本实验利用已建立的稳定转染NGX6的HT-29细胞系进行研究[4], RT-PCR检测证实NGX6基因稳定表达.
鸡胚绒毛尿囊膜实验表明, 转染NGX6基因的HT-29结肠癌细胞组较未转染HT-29结肠癌细胞组以及转染空白载体结肠癌细胞血管数目减少, 血管密度明显降低, 证明NGX6基因确实能抑制肿瘤血管的生成. 为进一步研究NGX6基因抑制肿瘤血管在体内所产生的效应, 我们建立了HT-29结肠癌细胞裸鼠腋前皮下种植瘤模型. 结果NGX6基因组种植瘤与另两相比较, 生长明显减慢, 种植瘤质量比较具有显著差异; 到第60天处理裸鼠时, HT-29组与PcDNA3.1(+)/HT-29组裸鼠与PcDNA3.1(+)/NGX6/HT-29组裸鼠比较消瘦明显, 有统计学意义. 移植瘤HE染色病理切片显示3组均为低分化腺癌, 无组间差异. HT-29及pcDNA3.1(+)/HT-29组移植瘤中第30天时即可见镜下血管形成但血管内未见癌栓, 而转染了NGX6基因的PcDNA3.1(+)/NGX6/HT-29组种植瘤中很少见有血管形成,免疫组织化学结果显示转染了NGX6基因的PcDNA3.1(+)/NGX6/HT-29组微血管密度明显降低. Lee et al应用2'-hydroxy-4'-methoxychalcone抑制了血管生长从而起到抗肿瘤的作用[15]. Yano et al的研究发现糖皮质激素抑制前列腺癌的生长可能是通过下调VEGF与IL-8的表达抑制血管生成而实现的[16]. Zou et al研究通过下调VEGF的表达能抑制裸鼠结肠癌种植瘤的生长及血管的形成[17]. Khromova et al研究发现突变的p53能促进肿瘤血管形成是通过ROS上调HIF1/VEGF-A途径实现的[18].
正常情况下, 血管的生长和抑制在体内受到严密的调控而处于平衡状态, 机体在荷瘤状态下表现为血管生长的失控性, 依赖于血管形成因子和血管形成抑制因子的调节失衡, NGX6基因抑制血管生成对结肠癌生长的影响也应该建立在血管形成因子和血管形成抑制因子的调节的基础上. 为进一步探讨NGX6基因抑制血管生成的原因, 我们应用RT-PCR检测了HT-29细胞中以及HT-29细胞裸鼠种植瘤中VEGF的表达水平, 结果无论是在HT-29细胞中还是在HT-29细胞裸鼠种植瘤中, 转染了NGX6基因HT-29组较未转染组和转染空白载体组VEGF的表达水平明显降低, 表明pcDNA3.1(+)/HT-29细胞和未转染的HT-29细胞种植瘤中VEGF呈高表达, NGX6基因抑制血管生成的作用可能是因为引起VEGF的低表达来实现的. Boquoi et al研究发现VEGF的过表达能促进结肠肿瘤的生成、肿瘤内血管的形成以及结肠肿瘤生长[19]. Imamura et al的研究结果表明结肠肿瘤的血管生成与VEGF及HIF1密切相关[20]. Terriset al对结肠癌的研究发现, VEGF在浸润性结肠癌组织中表达明显升高, 微血管密度也明显升高[21]. Kimura et al的研究表明通过抑制VEGF介导的血管生成能起到抑制结肠癌肿瘤生长的结果[22-23]. Fernando et al的研究发现内源性血管因子能引起肿瘤中VEGF及(PDGF)-A的上调, 从而使肿瘤摆脱内源性血管因子对血管生成的抑制[24].
到第60天处理的种植瘤切片HE染色显示在HT-29组及PcDNA3.1(+)/HT-29组种植瘤血管内都有癌栓, 且血管壁不完整, 有些血管内癌栓可见为种植瘤的一部分, 肿瘤细胞根本不需要穿过内皮细胞即可进到血管内. 在PcDNA3.1(+)/NGX6/HT-29组种植瘤内血管壁相对比较完整, 未见1只有血管内癌栓形成. 进一步切取裸鼠肝、脾、肺、肾及脑等器官, 在处理的裸鼠的过程中发现, HT-29组及PcDNA3.1(+)/HT-29组裸鼠肺脏表面似乎有灰白色小结节, PcDNA3.1(+)/NGX6/HT-29组裸鼠肺脏表面未发现, HE染色切片证实肺脏表面灰白色结节为低分化结肠腺癌, HT-29组及PcDNA3.1(+)/HT-29组裸鼠每1只都有肺部结肠癌转移灶, 而PcDNA3.1(+)/NGX6/HT-29组裸鼠肺部组织经连续切片未发现1只有肺部结肠癌转移灶. 实验结果表明NGX6基因有改善结肠癌种植瘤内新生血管结构的作用, 使种植瘤新生血管更为完整, 这样在瘤细胞要穿透到血管内的过程中, 肿瘤细胞必须通过比较完整的血管壁, 因此增加了肿瘤细胞自原发性肿瘤瘤体脱离后, 浸透血管壁进到血管内这最重要一步的难度. 而没有转染NGX6基因的HT-29及PcDNA3.1(+)/HT-29细胞种植瘤新生血管结构没有得到改善, 血管壁很不完整, 因而肿瘤细胞很容易便从原发性浸透血管壁进到血管内. Xu et al研究证实PlGF通过抑制血管的生成最终抑制了肺癌的转移[25]. Bouquet et al也报道了通过腺病毒转染AGT后抑制了肿瘤血管生成同时抑制肿瘤的生长和转移[26]. Parker et al研究发现, 一个名为EGFL7(EGF-like domain 7)的分泌因子, 在脊椎动物胚胎的脉管发育过程中参与管状结构的形成, EGFL7似乎参与协调内皮细胞的细胞间相互作用和局部迁移, 以确保主要血管的正确组装, 在维持新生血管结构完整方面起重要的作用[27]. Gouyer et al发现用抗体对抗胰蛋白酶抑制蛋白TATI能抑制结肠肿瘤的生长, 肿瘤的血管生成, 并能抑制肿瘤的转移[28]. Jie et al研究发现通过抗体抑制HGF能通过抑制结肠癌血管生成及诱导肿瘤凋亡抑制肿瘤的生长, 还能抑制结肠癌的转移[29]. Kim et al研究发现通过阻止STAT3及VEGF能抑制结肠癌的血管形成与肿瘤转移[30].
总之, 抑瘤基因NGX6抑制了结肠癌的血管生成, 并通过抑制血管形成以及影响新生血管的结构抑制了肿瘤的生长并抑制了肿瘤的转移. 在抑制血管生成方面其功能的实现应该是通过其EGF样结构域来完成的; 抑瘤基因NGX6下调了HT-29细胞中以及HT-29细胞裸鼠种植瘤中VEGF的表达, 这应该是其抑制血管形成的部分机制, 其他影响因素还需要进一步实验来发现. 我们正通过更多的实验来研究抑瘤基因通过抑制血管生成对结肠癌转移中的作用并阐明其机制.
结直肠癌是消化系统最常见的恶性肿瘤之一, 在西方国家结肠癌是癌相关性死亡的主要原因, 近年来我国结肠癌的发病率亦呈上升趋势.
唐世刚, 教授, 大连大学附属中山医院消化内科.
研究表明结直肠癌发病机制涉及多个抑瘤基因的失活和瘤基因的激活, 尤其是抑瘤基因的失活.
生物信息学分析显示, NGX6基因cDNA预测编码蛋白含有2个跨膜结构域(第234-256位氨基酸, 269-291), 胞外区含有1个EGF样结构域(185-221)和3个糖基化位点(92-95, 100-103, 172-175), 胞内区较短, 含有一个酪氨酸激酶磷酸化位点(257-265), 其EGF样结构域应该是其发挥生物学功能的结构基础.
NGX6基因是克隆出的一个新基因, 本研究证实NGX6基因对于结肠癌是个抑瘤基因.
本研究证明NGX6基因对于结肠癌是个抑瘤基因, 对更进一步证明结肠癌发病机制、对结肠癌的治疗以及预后都有积极的作用.
本文研究了NGX6对结肠癌血管形成的抑制作用, 进一步阐明NGX6的抑制肿瘤的机制. 文章设计合理, 层次分明, 有很好的科学性和实用性.
编辑: 李军亮 电编:吴鹏朕
| 2. | 阳 剑波, 宾 亮华, 李 忠花, 张 小慧, 钱 骏, 张 必成, 周 鸣, 谢 奕, 邓 龙文, 李 桂源. 精细定位和克隆9p21-22区域内鼻咽癌候选抑瘤基因. 癌症. 2000;19:6-9. |
| 4. | 王 晓艳, 沈 守荣, 刘 华英, 张 晓梅, 彭 聪, 黄 河, 刘 芬, 李 晓玲, 李 桂源. 抑瘤基因NGX6对人结肠癌细胞HT-29生长的 影响. 世界华人消化杂志. 2004;12:574-579. [DOI] |
| 5. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 6. | Falls DL. Neuregulins: functions, forms, and signaling strategies. Exp Cell Res. 2003;284:14-30. [PubMed] [DOI] |
| 8. | Wang T, Ward Y, Tian L, Lake R, Guedez L, Stetler-Stevenson WG, Kelly K. CD97, an adhesion receptor on inflammatory cells, stimulates angiogenesis through binding integrin counterreceptors on endothelial cells. Blood. 2005;105:2836-2844. [PubMed] [DOI] |
| 9. | Fiedler U, Krissl T, Koidl S, Weiss C, Koblizek T, Deutsch U, Martiny-Baron G, Marmé D, Augustin HG. Angiopoietin-1 and angiopoietin-2 share the same binding domains in the Tie-2 receptor involving the first Ig-like loop and the epidermal growth factor-like repeats. J Biol Chem. 2003;278:1721-1727. [PubMed] [DOI] |
| 10. | Li H, Soria C, Griscelli F, Opolon P, Soria J, Yeh P, Legrand C, Vannier JP, Belin D, Perricaudet M. Amino-terminal fragment of urokinase inhibits tumor cell invasion in vitro and in vivo: respective contribution of the urokinase plasminogen activator receptor-dependent or -independent pathway. Hum Gene Ther. 2005;16:1157-1167. [PubMed] [DOI] |
| 11. | Schenk S, Hintermann E, Bilban M, Koshikawa N, Hojilla C, Khokha R, Quaranta V. Binding to EGF receptor of a laminin-5 EGF-like fragment liberated during MMP-dependent mammary gland involution. J Cell Biol. 2003;161:197-209. [PubMed] [DOI] |
| 12. | Yoon SY, Lee YJ, Seo JH, Sung HJ, Park KH, Choi IK, Kim SJ, Oh SC, Choi CW, Kim BS. uPAR expression under hypoxic conditions depends on iNOS modulated ERK phosphorylation in the MDA-MB-231 breast carcinoma cell line. Cell Res. 2006;16:75-81. [PubMed] [DOI] |
| 13. | Nakano N, Higashiyama S, Ohmoto H, Ishiguro H, Taniguchi N, Wada Y. The N-terminal region of NTAK/neuregulin-2 isoforms has an inhibitory activity on angiogenesis. J Biol Chem. 2004;279:11465-11470. [PubMed] [DOI] |
| 14. | Chlenski A, Liu S, Baker LJ, Yang Q, Tian Y, Salwen HR, Cohn SL. Neuroblastoma angiogenesis is inhibited with a folded synthetic molecule corresponding to the epidermal growth factor-like module of the follistatin domain of SPARC. Cancer Res. 2004;64:7420-7425. [PubMed] [DOI] |
| 15. | Lee YS, Lim SS, Shin KH, Kim YS, Ohuchi K, Jung SH. Anti-angiogenic and anti-tumor activities of 2'-hydroxy-4'- methoxychalcone. Biol Pharm Bull. 2006;29:1028-1031. [PubMed] [DOI] |
| 16. | Yano A, Fujii Y, Iwai A, Kageyama Y, Kihara K. Glucocorticoids suppress tumor angiogenesis and in vivo growth of prostate cancer cells. Clin Cancer Res. 2006;12:3003-3009. [PubMed] [DOI] |
| 17. | Zou X, Qiao H, Jiang X, Dong X, Jiang H, Sun X. Downregulation of developmentally regulated endothelial cell locus-1 inhibits the growth of colon cancer. J Biomed Sci. 2008; Dec 25. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Khromova NV, Kopnin PB, Stepanova EV, Agapova LS, Kopnin BP. p53 hot-spot mutants increase tumor vascularization via ROS-mediated activation of the HIF1/VEGF-A pathway. Cancer Lett. 2009;276:143-151. [PubMed] [DOI] |
| 19. | Boquoi A, Jover R, Chen T, Pennings M, Enders GH. Transgenic expression of VEGF in intestinal epithelium drives mesenchymal cell interactions and epithelial neoplasia. Gastroenterology. 2009;136:596-606.e4. [PubMed] [DOI] |
| 20. | Imamura T, Kikuchi H, Herraiz MT, Park DY, Mizukami Y, Mino-Kenduson M, Lynch MP, Rueda BR, Benita Y, Xavier RJ. HIF-1alpha and HIF-2alpha have divergent roles in colon cancer. Int J Cancer. 2009;124:763-771. [PubMed] [DOI] |
| 21. | Terris B, Scoazec JY, Rubbia L. Expression of vascular endothelial growth factor in digestive neuroendocrine tumours. Histopathology. 1998;32:133-138. [PubMed] [DOI] |
| 22. | Kimura Y, Sumiyoshi M, Baba K. Antitumor activities of synthetic and natural stilbenes through antiangiogenic action. Cancer Sci. 2008;99:2083-2096. [PubMed] [DOI] |
| 23. | Kimura Y, Sumiyoshi M, Taniguchi M, Baba K. Antitumor and antimetastatic actions of anthrone-C-glucoside, cassialoin isolated from Cassia garrettiana heartwood in colon 26-bearing mice. Cancer Sci. 2008;99:2336-2348. [PubMed] [DOI] |
| 24. | Fernando NT, Koch M, Rothrock C, Gollogly LK, D'Amore PA, Ryeom S, Yoon SS. Tumor escape from endogenous, extracellular matrix-associated angiogenesis inhibitors by up-regulation of multiple proangiogenic factors. Clin Cancer Res. 2008;14:1529-1539. [PubMed] [DOI] |
| 25. | Xu L, Cochran DM, Tong RT, Winkler F, Kashiwagi S, Jain RK, Fukumura D. Placenta growth factor overexpression inhibits tumor growth, angiogenesis, and metastasis by depleting vascular endothelial growth factor homodimers in orthotopic mouse models. Cancer Res. 2006;66:3971-3977. [PubMed] [DOI] |
| 26. | Bouquet C, Lamandé N, Brand M, Gasc JM, Jullienne B, Faure G, Griscelli F, Opolon P, Connault E, Perricaudet M. Suppression of angiogenesis, tumor growth, and metastasis by adenovirus-mediated gene transfer of human angiotensinogen. Mol Ther. 2006;14:175-182. [PubMed] [DOI] |
| 27. | Parker LH, Schmidt M, Jin SW, Gray AM, Beis D, Pham T, Frantz G, Palmieri S, Hillan K, Stainier DY. The endothelial-cell-derived secreted factor Egfl7 regulates vascular tube formation. Nature. 2004;428:754-758. [PubMed] [DOI] |
| 28. | Gouyer V, Fontaine D, Dumont P, de Wever O, Fontayne-Devaud H, Leteurtre E, Truant S, Delacour D, Drobecq H, Kerckaert JP. Autocrine induction of invasion and metastasis by tumor-associated trypsin inhibitor in human colon cancer cells. Oncogene. 2008;27:4024-4033. [PubMed] [DOI] |
| 29. | Jie JZ, Wang JW, Qu JG, Hung T. Suppression of human colon tumor growth by adenoviral vector-mediated NK4 expression in an athymic mouse model. World J Gastroenterol. 2007;13:1938-1946. [PubMed] [DOI] |