修回日期: 2009-08-07
接受日期: 2009-08-10
在线出版日期: 2009-08-28
目的: 联合RNA干扰技术探讨Polo样激酶1(PLK1)在肝癌的发生发展中的作用及对临床治疗的指导作用.
方法: 化学合成针对PLK1的小片段干扰RNA(PLK1-siRNA), 转染至肝癌细胞株HepG2中, 利用实时定量PCR、台盼蓝活性细胞计数和流式细胞术对PLK1的基因表达、细胞增殖、细胞周期和凋亡的检测.
结果: 转染PLK1-siRNA后, 肝癌细胞中PLK1 mRNA表达明显下降(P<0.01), 表达量相当于空白组的49.7%±3.6%; 细胞增殖活性从转染24 h后明显下降; 细胞分裂周期发生变化, S期比例下降, 阻滞在G2/M期的细胞比例上升, 于48、72 h阻滞在G2/M期的细胞比例和细胞凋亡率与空白组相比均有显著增加(均P<0.05).
结论: PLK1在肝癌的发生发展中起着重要作用, 其siRNA能特异性抑制肝癌细胞中PLK1基因的表达, 抑制细胞增殖, 促进细胞凋亡, 针对PLK1基因的RNA干扰有望用于肿瘤的基因治疗.
引文著录: 张庆, 胡承明, 谭小平, 王卫政, 何长华, 刘南植. Polo样激酶1小片段干扰RNA对肝癌细胞株HepG2的影响. 世界华人消化杂志 2009; 17(24): 2503-2507
Revised: August 7, 2009
Accepted: August 10, 2009
Published online: August 28, 2009
AIM: To explore the role of PLK1 in carcinogenesis and development of liver cancer and its clinical significance for cancer treatment with the technique of RNA interference (RNAi).
METHODS: HepG2 cells were transfected with small interfering RNAs (siRNAs) targeting against the human PLK1 by chemosynthesis. The PLK1 mRNA levels of the cells transfected with siRNAs were monitored with real time PCR. Cell proliferation was evaluated by direct cell counting with trypan blue staining. Cell cycle and apoptosis were examined by flow cytometry.
RESULTS: The PLK1 mRNA levels of transfected liver cancer cells were greatly lowered as compared with that of the control groups in 48 h after the siRNAs transfection (49.7% ± 3.6%), (P < 0.01). Cell proliferation was reduced from 24 h after transfection. Cell cycle distribution was changed and showed a strong G2/M arrest in 48 h and 72 h after transfection, and cell apoptosis was increased. There was significant difference as compared with the control group (both P < 0.05).
CONCLUSION: PLK1 plays an important role in the carcinogenesis and development of liver cancer. siRNAs targeting against human PLK1 may specially suppress the expression of PLK1 mRNA in liver cancer cells, inhibit cell proliferation and enhance cell apoptosis. The RNAi targeting PLK1 is expected to be used in gene therapy for human liver cancers.
- Citation: Zhang Q, Hu CM, Tan XP, Wang WZ, He CH, Liu NZ. Effects of small interference RNAs targeting Polo-like kinase 1 in human liver cancer cell line HepG2. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2503-2507
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2503.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2503
Polo样激酶1(polo-like kinase 1, PLK1)是一种高度保守的丝氨酸/苏氨酸激酶[1], 他参与了细胞周期中, 中心体的成熟、纺锤体的形成以及染色体的分离等过程, 对细胞的有丝分裂起重要的调控作用. 在正常情况下, DNA受损时会通过抑制PLK1的活性而阻止细胞进入分裂期(M期)[2-3]. 目前已发现PLK1在多种肿瘤中呈异常高表达, 并与某些临床病理特征相关[4]. RNA干扰(RNA interference, RNAi)是一种由双链RNA始动的序列特异性基因沉默机制, 他是转录后基因沉默现象的一种, 是机体固有的对抗外源侵袭基因即维持自身基因稳定性的一种自我保护机制. RNAi现象广泛存在于各种生物中, 不仅与细胞分化和生物发育密切相关, 还在基因表达调控、基因治疗与基因功能中发挥重要作用[5]. 在本研究中, 我们通过RNAi技术抑制PLK1的表达, 探讨PLK1在肝癌发生发展中的作用及对临床治疗的指导作用.
siRNA由上海吉玛制药公司化学合成, 其PLK1源序列来源于NCBI NM_05030, 其siRNA正义链: 5'-GGGCGGCUUUGCCAAGUGCdTdT-3', 反义链: 5'-GCACUUGGCAAAGCCGCCCdTdT-3', 5'端荧光标记阴性对照siRNA 1条. 肝癌HepG2细胞株来源于华中科技大学同济医学院附属同济医院肝病研究所, 采用含10%胎牛血清(杭州四季青生物公司)的DMEM高糖培养基(Hyclone公司), 在37℃ CO2恒温培养箱中培养.
1.2.1 分组: 空白对照组只有转染液; 阴性对照组为siRNA+转染液; PLK1-siRNA组为PLK1-siRNA+转染液. 将4×108/L的细胞于转染前1 d种植在6 cm的培养皿中培养, 细胞融合约40%-50%进行转染, 将转染液脂质体Lipofectamine 2000(Introvigen公司)和siRNA先分别与不含血清的DMEM培养基混合, 5 min后将他们混合在一起, 室温放置20 min后分别加入细胞中继续培养, 然后根据实验需要收集细胞.
1.2.2 实时定量PCR检测: RNA提取和第1链合成. 将各组经转染后的细胞分别用TRIzol(Gibco公司)提取总RNA, 再使用逆转录试剂盒(Promga公司)合成第1链. PLK1引物, 正义链: 5'-TGAGCCTGAGGCCCGATACTA-3', 反义链: 5'-TTGCCAGTCCAAAATCCCCTA-3'; β-actin引物, 正义链: 5'-GGAGAAGATGACCCAGATC-3', 反义链: 5'-GATCTTCATGAGGTAGTCAG-3'. 利用RT-PCR胶回收产物作为标准品, 倍比稀释后制作标准曲线. RT-PCR反应体系20 μL: SYRB Green Ⅰ MIX(Toyobo公司)10 μL引物1 0.4 μL引物2 0.4 μL cDNA 2 μL DEPC水7.2 μL. 扩增过程: 95℃ 5 s, 58℃ 5 s, 72℃ 20 s循环40次, 使用Roche Lightcycler PCR扩增仪扩增. 每组样本重复测量3次.
1.2.3 细胞增殖活性检测: 将5×107/L细胞种植在六孔板中培养24 h后按上述方法转染, 分别于转染0、12、24、48及72 h收集细胞, 用1.5 mL PBS和0.1%台盼蓝混合液使细胞悬浮, 然后使用血细胞计数板计数, 每个样本重复计数3次, 以72 h后空白对照的平均活性细胞数为参照, 计数出每组各时间的百分比, 然后绘成细胞活性增殖图.
1.2.4 流式细胞术: 细胞种植在培养皿中, 按上述方法转染12、24、48和72 h后, 将细胞用胰酶消化, 用冷PBS洗涤, 再用70%的冰乙醇固定过夜, 固定的细胞被收集、洗涤和悬浮在含有10 mg/L PI(Sigma公司)和100 mg/L RNase A(华美生物公司)的PBS中, 然后于4℃中孵育至少30 min, 利用流式细胞仪(BD公司)分析细胞周期分配和凋亡.
统计学处理 数据应用SPSS11.0软件进行统计学处理, 所有数据采取mean±SD表示, 根据实验资料要求, 选用t检验、方差分析进行数据处理, 以P<0.05为差异具有显著性.
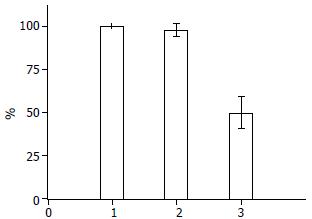
经转染后48 h PLK1-siRNA组mRNA的表达明显被抑制, 表达量与空白组与阴性对照组比较明显降低(t = 23.921, 21.184, P<0.01), 而阴性对照组mRNA的表达基本上与空白组无明显区别(97.8%±1.5% vs 100%±0.0%, P<0.01, 图1).
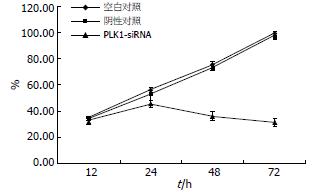
通过台盼蓝活性细胞计数发现空白组和阴性对照组细胞增殖活性无明显差别, 而PLK1-siRNA组细胞增殖活性于12 h前与空白、阴性对照组无明显差异, 到24 h细胞增殖活性相对于空白组开始减弱, 增殖活性呈下降趋势, 从24-72 h其细胞增殖活性相对于空白组分别为45.5%±2.1%、36.1%±1.7%及31.3%±1.5%(P<0.01, 图2).
通过流式细胞术检测, 发现肝癌细胞HepG2转染后, 空白组和阴性对照组细胞周期分配无显著性差别, 均未见明显凋亡; PLK1-siRNA组转染12 h后细胞周期分配、凋亡与空白组相似, 于24 h后开始出现凋亡, 虽然凋亡不明显, 但细胞周期分配开始出现变化, S期比例下降, 阻滞在G2/M期的细胞比例上升, 于48、72 h细胞周期分配和凋亡随时间延长变化越大, 被阻滞在G2/M期的细胞比例分别为空白组约1倍、1.5倍, 凋亡率为12.3%±2.3%及35.9%±2.6%(P<0.05, 表1).
肝癌是最为常见的恶性肿瘤之一, 其死亡率在我国居恶性肿瘤的首位. 近年来, 肝癌的分子遗传学和分子病理学研究取得了突破性进展, 使人们认识到肝癌发生的根本原因可能在细胞内部基因结构及表达的异常改变, 涉及到多种癌基因、抑癌基因、生长因子及其受体、细胞黏附因子及DNA修复基因等的异常和积累.
RNAi是Fire et al[6]于1998年发现的生物中天然存在的转录后基因沉默机制. 其基本机制是外源或内源双链RNA(dsRNA)被称为Dicer的RNA酶或RNA酶Ⅲ切割成21-23个碱基长的siRNA, 引发并参与RNA诱导沉默复合体(RNA-induced silencing complex, RISC)的形成, 引导RISC序列特异性切割mRNA, 从而在mRNA水平上关闭相应序列基因的表达或使其沉默的过程. 在本实验中, 我们通过化学合成针对PLK1 的siRNA, 利用体外转染, 将其转染到肝癌细胞HepG2中, 发现PLK1 siRNA组细胞PLK1 mRNA的表达明显抑制, 表达量相对于空白组49.7%±3.6%. 说明siRNA通过基因沉默机制能使肝癌细胞PLK1基因沉默来抑制其表达.
PLK1是近年发现的一种细胞周期调控基因, 他是一种高度保守的丝氨酸/苏氨酸激酶, 在细胞有丝分裂的不同时期都起到十分重要的作用: 在G2晚期M初期参与细胞分裂周期25C(cell division cycle 25C, CDC25C)的激活、继而促成Cyclin B/Cdc2的激活, 协助中心体的功能成熟以及纺锤体的形成, 从而促进M期的起始和染色体正常分离、分配[7-9]; 通过调节APC(anaphase-promoting complex)来决定细胞能否按期离开M期; 他在细胞自我保护中也起到着重要作用, 当DNA受损时可引起PLK1苏氨酸残基磷酸化而使其活性受抑, 从而使细胞阻滞于G2/M期[10-12]; 在分裂活跃的组织器官或肿瘤细胞中PLK1活性较高, 据有关研究报道, 通过对PLK1抗体的微注射可以抑制细胞周期的进展[13], 利用反义寡核苷酸和RNA干扰技术直接抑制PLK1的表达, 从而抑制增殖细胞有丝分裂活性[14-21]. 此外Smith et al报道PLK1的过多表达能使NIH3T3细胞癌基因聚集, 这些细胞能在裸鼠上形成肿瘤[22]. 这些研究都表明PLK1可能在肿瘤发生发展上起着重要作用. Tokumitsu et al曾对75例胃癌在mRNA水平上对PLK1表达进行了分析, 阳性率为73%[23]. 我们曾在蛋白水平分析发现PLK1在胃癌中高表达[24], 说明PLK1在肿瘤发生发展上可能起着重要的作用.
我们通过实验发现, 经PLK1-siRNA转染的细胞其增殖活性相对于空白组明显下降, 细胞周期分配发生变化, S期比例下降, 细胞阻滞在G2/M期的比例上升, 于48 h和72 h分别为24.1%±1.8%、31.1%±1.9%, 细胞凋亡率也明显增加, 48 h和72 h分别为12.3%±2.3%、35.9%±2.6%, 相对于空白组和阴性对照组均有显著性意义. 由此可见, 通过基因沉默机制使能肝癌细胞PLK1基因沉默来抑制其表达, 从而抑制肝癌细胞的增殖活性, 使细胞阻滞于G2/M期, 促进细胞凋亡, 从而说明PLK1在肝癌发生发展中起着重要作用.
根据PLK1在许多肿瘤中高表达, 与肿瘤细胞增殖和致癌性转化密切相关, 目前已经建立了针对PLK1 mRNA的反义寡核苷酸和干扰RNA, 他们能特异性的对PLK1 mRNA及其蛋白产物表现为剂量依赖性的抑制作用, 由此也抑制了PLK1的丝氨酸/苏氨酸激酶的活性, 能有效抑制培养细胞系或裸鼠肿瘤模型中肿瘤细胞的增殖[14-21]. 说明了PLK1可以作为肿瘤治疗的一个靶点, 在临床治疗中有着重要的指导作用[25]. 在本实验中, 利用RNAi, 肝癌细胞株增殖活性明显下降, 凋亡率明显增加, 也正说明了PLK1不仅在肝癌发生发展中起着重要作用, 而且可作为肝癌治疗的潜在靶位点.
总之, PLK1的生物学特性是: 在增殖程度高的肿瘤细胞中具有高度表达, 而在正常细胞则低表达或不表达, 这说明他可能在肿瘤发生发展中起着重要作用, 并使他可能成为抗肿瘤治疗的潜在靶位点. 针对肿瘤细胞的有丝分裂调节通路异常表达基因的治疗应该比传统药物具有更好的疗效和靶向性, 从而具有更低的毒性. 如果采用"基因沉默"技术, 干预PLK1等肿瘤增殖"关键基因"表达, 开展抑制肿瘤增殖发展的体内、外实验研究, 将有可能为肿瘤的治疗提供新型有效的方法.
肝癌是最为常见的恶性肿瘤之一,其死亡率在我国居恶性肿瘤的首位. Polo样激酶1(PLK1)是一种高度保守的丝氨酸/苏氨酸激酶, 他参与了细胞周期中, 中心体的成熟、纺锤体的形成以及染色体的分离等过程, 对细胞的有丝分裂起重要的调控作用. 目前已发现PLK1在多种肿瘤中呈异常高表达, 并与某些临床病理特征相关.
禄韶英, 副主任医师, 西安交通大学医学院第一附属医院普外科; 党双锁, 教授, 西安交通大学第二医院感染科
RNA干扰(RNAi)现象广泛存在于各种生物中, 不仅与细胞分化和生物发育密切相关, 还在基因表达调控、基因治疗与基因功能中发挥重要作用.
根据PLK1在许多肿瘤中高表达, 与肿瘤细胞增殖和致癌性转化密切相关, 目前已经建立了针对PLK1 mRNA的反义寡核苷酸和干扰RNA, 他们能特异性的对PLK1 mRNA及其蛋白产物表现为剂量依赖性的抑制作用, 由此也抑制了PLK1的丝氨酸/苏氨酸激酶的活性, 能有效抑制培养细胞系或裸鼠肿瘤模型中肿瘤细胞的增殖.
采用"基因沉默"技术, 干预PLK1等肿瘤增殖"关键基因"表达, 开展抑制肿瘤增殖发展的体内、外实验研究, 将有可能为肿瘤的治疗提供新型有效的方法.
本研究设计合理, 结果可信, 对目前肝肿瘤基因治疗有较好的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Donohue PJ, Alberts GF, Guo Y, Winkles JA. Identification by targeted differential display of an immediate early gene encoding a putative serine/threonine kinase. J Biol Chem. 1995;270:10351-10357. [PubMed] [DOI] |
| 2. | Smits VA, Klompmaker R, Arnaud L, Rijksen G, Nigg EA, Medema RH. Polo-like kinase-1 is a target of the DNA damage checkpoint. Nat Cell Biol. 2000;2:672-676. [PubMed] [DOI] |
| 3. | Jackman M, Lindon C, Nigg EA, Pines J. Active cyclin B1-Cdk1 first appears on centrosomes in prophase. Nat Cell Biol. 2003;5:143-148. [PubMed] [DOI] |
| 4. | Eckerdt F, Yuan J, Strebhardt K. Polo-like kinases and oncogenesis. Oncogene. 2005;24:267-276. [PubMed] [DOI] |
| 5. | Liu J, Carmell MA, Rivas FV, Marsden CG, Thomson JM, Song JJ, Hammond SM, Joshua-Tor L, Hannon GJ. Argonaute2 is the catalytic engine of mammalian RNAi. Science. 2004;305:1437-1441. [PubMed] [DOI] |
| 6. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 7. | Hamanaka R, Smith MR, O'Connor PM, Maloid S, Mihalic K, Spivak JL, Longo DL, Ferris DK. Polo-like kinase is a cell cycle-regulated kinase activated during mitosis. J Biol Chem. 1995;270:21086-21091. [PubMed] [DOI] |
| 8. | Golsteyn RM, Schultz SJ, Bartek J, Ziemiecki A, Ried T, Nigg EA. Cell cycle analysis and chromosomal localization of human Plk1, a putative homologue of the mitotic kinases Drosophila polo and Saccharomyces cerevisiae Cdc5. J Cell Sci. 1994;107:1509-1517. [PubMed] |
| 9. | Roshak AK, Capper EA, Imburgia C, Fornwald J, Scott G, Marshall LA. The human polo-like kinase, PLK, regulates cdc2/cyclin B through phosphorylation and activation of the cdc25C phosphatase. Cell Signal. 2000;12:405-411. [PubMed] [DOI] |
| 10. | Toyoshima-Morimoto F, Taniguchi E, Nishida E. Plk1 promotes nuclear translocation of human Cdc25C during prophase. EMBO Rep. 2002;3:341-348. [PubMed] [DOI] |
| 11. | Yuan J, Eckerdt F, Bereiter-Hahn J, Kurunci-Csacsko E, Kaufmann M, Strebhardt K. Cooperative phosphorylation including the activity of polo-like kinase 1 regulates the subcellular localization of cyclin B1. Oncogene. 2002;21:8282-8292. [PubMed] [DOI] |
| 12. | Kotani S, Tugendreich S, Fujii M, Jorgensen PM, Watanabe N, Hoog C, Hieter P, Todokoro K. PKA and MPF-activated polo-like kinase regulate anaphase-promoting complex activity and mitosis progression. Mol Cell. 1998;1:371-380. [PubMed] [DOI] |
| 13. | Lane HA, Nigg EA. Antibody microinjection reveals an essential role for human polo-like kinase 1 (Plk1) in the functional maturation of mitotic centrosomes. J Cell Biol. 1996;135:1701-1713. [PubMed] [DOI] |
| 14. | Zhou Q, Bai M, Su Y. Effect of antisense RNA targeting polo-like kinase 1 on cell cycle and proliferation in A549 cells. Chin Med J (Engl). 2004;117:1642-1649. [PubMed] |
| 15. | Gray PJ Jr, Bearss DJ, Han H, Nagle R, Tsao MS, Dean N, Von Hoff DD. Identification of human polo-like kinase 1 as a potential therapeutic target in pancreatic cancer. Mol Cancer Ther. 2004;3:641-646. [PubMed] |
| 16. | Masuda Y, Nishida A, Hori K, Hirabayashi T, Kajimoto S, Nakajo S, Kondo T, Asaka M, Nakaya K. Beta-hydroxyisovalerylshikonin induces apoptosis in human leukemia cells by inhibiting the activity of a polo-like kinase 1 (PLK1). Oncogene. 2003;22:1012-1023. [PubMed] [DOI] |
| 17. | Elez R, Piiper A, Kronenberger B, Kock M, Brendel M, Hermann E, Pliquett U, Neumann E, Zeuzem S. Tumor regression by combination antisense therapy against Plk1 and Bcl-2. Oncogene. 2003;22:69-80. [PubMed] [DOI] |
| 18. | Spänkuch-Schmitt B, Wolf G, Solbach C, Loibl S, Knecht R, Stegmüller M, von Minckwitz G, Kaufmann M, Strebhardt K. Downregulation of human polo-like kinase activity by antisense oligonucleotides induces growth inhibition in cancer cells. Oncogene. 2002;21:3162-3171. [PubMed] [DOI] |
| 19. | Elez R, Piiper A, Giannini CD, Brendel M, Zeuzem S. Polo-like kinase1, a new target for antisense tumor therapy. Biochem Biophys Res Commun. 2000;269:352-356. [PubMed] [DOI] |
| 20. | Liu X, Erikson RL. Activation of Cdc2/cyclin B and inhibition of centrosome amplification in cells depleted of Plk1 by siRNA. Proc Natl Acad Sci U S A. 2002;99:8672-8676. [PubMed] [DOI] |
| 21. | Spänkuch-Schmitt B, Bereiter-Hahn J, Kaufmann M, Strebhardt K. Effect of RNA silencing of polo-like kinase-1 (PLK1) on apoptosis and spindle formation in human cancer cells. J Natl Cancer Inst. 2002;94:1863-1877. [PubMed] |
| 22. | Smith MR, Wilson ML, Hamanaka R, Chase D, Kung H, Longo DL, Ferris DK. Malignant transformation of mammalian cells initiated by constitutive expression of the polo-like kinase. Biochem Biophys Res Commun. 1997;234:397-405. [PubMed] [DOI] |
| 23. | Tokumitsu Y, Mori M, Tanaka S, Akazawa K, Nakano S, Niho Y. Prognostic significance of polo-like kinase expression in esophageal carcinoma. Int J Oncol. 1999;15:687-692. [PubMed] |