修回日期: 2009-07-22
接受日期: 2009-07-27
在线出版日期: 2009-08-28
目的: 探讨模拟失重对胃癌SGC-7901细胞和胃黏膜上皮HFE-145细胞凋亡的影响.
方法: 采用回转器模拟失重, 2种细胞各分为2组, 回转组和1G对照组, 实验时间共72 h. 用TUNEL法检测细胞凋亡.
结果: 与对照组相比, SGC-7901细胞在72 h回转组凋亡比例明显增多(P<0.01), 12、24、36、48 h回转组与对照组无明显差异. 与对照组相比, HFE-145细胞在12 h回转组凋亡比例明显增多(P<0.05), 之后与对照组无明显差异.
结论: 回转器模拟失重使胃癌SGC-7901细胞72 h时凋亡增加. 胃黏膜上皮HFE-145细胞在12 h时出现上述变化.
引文著录: 朱鸣, 吴本俨, 聂捷琳, 李莹辉. 回转器模拟失重对SGC-7901和HFE-145细胞凋亡的影响. 世界华人消化杂志 2009; 17(24): 2491-2494
Revised: July 22, 2009
Accepted: July 27, 2009
Published online: August 28, 2009
AIM: To investigate the effects of simulated weightlessness on cellular apoptosis of human gastric carcinoma cell line SGC-7901 and human gastric mucosa cell line HFE-145.
METHODS: A rotating clinostat was used to simulate weightlessness. Each cell line was divided into two groups: rotating group and 1G control group. The experiments lasted 72 h in total. Apoptosis was measured by TUNEL method.
RESULTS: Compared with control group, the apoptosis index of SGC-7901 cell line increased in rotating group in 72 h (P < 0.01), but no significant change could be found in 12 h, 24 h, 36 h and 48 h. Compared with control group, the apoptosis index of HFE-145 cell line increased in 12 h (P < 0.05), but no significant change was found afterward compared with control group.
CONCLUSION: The apoptosis index of SGC-7901 cell line increased with simulated weightlessness by a clinostat in 72 h, while HFE-145 cells only changed in 12 h, and adapted to simulated weightlessness afterward.
- Citation: Zhu M, Wu BY, Nie JL, Li YH. Effects of simulated weightlessness on apoptosis of cell line SGC-7901 and HFE-145. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2491-2494
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2491.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2491
太空环境对于人类来说是一个全新的未知领域, 以往的科学研究表明太空飞行可导致机体的一些生理学变化, 包括脑脊液流动性的改变、电解质减少、肌肉萎缩、太空运动病、贫血、免疫反应下降和骨质疏松等[1]. 但是生物体内的细胞对重力的反应还需要进一步研究, 以往未见对失重或模拟失重状态下胃癌细胞和胃黏膜上皮细胞的研究, 本实验将胃癌SGC-7901细胞和胃黏膜上皮HFE-145细胞置于回转器模拟失重的状态下, 研究模拟失重对细胞凋亡的影响.
胃癌细胞株SGC-7901细胞为解放军总医院南楼消化科实验室所保存; 胃黏膜上皮细胞株HFE-145细胞由Wayne State University School of Medicine, Detroit, USA. Hassan ashktorab教授馈赠. DMEM培养基: 华美公司; TUNEL试剂盒: 鼎国公司. BH2 Olympus显微镜(日本生产); MG3型回转器, 生物物理所研制.
接种SGC-7901细胞和HFE-145细胞至15 cm2培养瓶中 (瓶底贴细胞爬片, 1 cm×2 cm/片), 加入DMEM培养基(含100 mL/L灭活小牛血清, 100 kU/L的双抗, 50 g/L碳酸氢钠, 调pH至7.2)5 mL. 24 h待细胞完全贴壁后(约1.5×104/cm), 瓶中灌满培养基, 排气后将瓶口密封, 将其随机平分为2组. 一组放置在回转器上, 并把回转器放置在培养箱(30 r/min, 37℃)中, 另一组放置在培养箱中正常生长作为对照.
分别在模拟失重12、24、36、48和72 h后, SGC-7901细胞组各取6瓶细胞, HFE-145细胞组各取5瓶细胞, 取出细胞爬片, 4%多聚甲醛固定30 min以上. PBS洗后, SGC-7901细胞加0.1% Triton X100 25 min, HFE-145细胞加15 mg/L蛋白酶K 35 min. 加入0.3% H2O2(甲醇溶解), 室温30 min. PBS洗, 晾干. 滴加TUNEL反应液, 置于湿盒, 37℃, 60 min. 缓冲液A洗后加封闭液, 37℃, 30 min. 加显色反应液, 37℃, 45 min. 缓冲液B洗后加显色液, 置于暗盒中, 室温, 20 min. 核固红复染. 以不加TUNEL反应液者为阴性对照.
结果判断: 凋亡细胞核呈蓝紫色, 也常见蓝紫色颗粒溢出胞核至胞质, 阴性细胞的胞核呈粉红色, 细胞质基本不着色. 凋亡细胞的胞核固缩, 核浆比增大, 以Image-pro4.5图像分析系统进行图像分析.
统计学处理 用State7.0统计分析软件进行统计. 分别以t检验比较回转组和对照组凋亡细胞百分比的差异. P<0.05为统计学有显著差异.
回转器模拟失重后细胞凋亡的变化: 12、24、36、48 h后, 回转组SGC-7901细胞的细胞凋亡比例与对照组相比无明显差异, 72 h回转组细胞凋亡比例较对照组明显增多(图1, 表1, P<0.01).
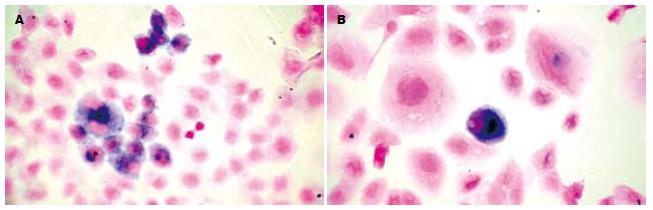
24、36、48、72 h后, 回转组HFE-145细胞的细胞凋亡比例与对照组相比无明显差异, 12 h回转组细胞的凋亡比例较对照组明显增多(图2, 表1, P<0.05).
图[DOI: 10.11569/wcjd.v14.i.2491]2HFE-145细胞12 h(TUNEL法×200). A: 回转组; B: 对照组.
1992年Gavrieli根据凋亡发生的原理, 研究出原位凋亡检测方法(terminal deoxynucleotidyl transferase-mediated deoxyuridine triphosphate biotin nick end labeling method, TUNEL). 该方法最大的优点是保持了组织结构, 能够原位观测细胞凋亡[2], 本实验采用TUNEL法检测细胞的凋亡比例. 而回转器是一种能使生物样本不停地绕水平轴匀速旋转的仪器, 重力的作用可有效地去除, 从而达到模拟微重力条件下生物效应的效果[3]. 在本研究中, 我们应用回转器来模拟失重.
本实验表明, 回转器模拟失重使胃癌SGC-7901细胞在72 h时凋亡增加, 而胃黏膜上皮HFE-145细胞仅在模拟失重后12 h出现上述变化, 之后与对照组无明显差异, 说明对失重状态产生了适应.
那么, 细胞在失重状态下发生生物学行为变化的原因是什么呢? 到目前为止, 其发生机制尚不明确. 最近的研究推论当细胞在失重状态下细胞骨架和细胞膜发生了变化[4-7], 整个细胞的结构发生了相应的重新分布以保持平衡. 这种重分布可以影响细胞连接和细胞外基质, 并且产生信号传导过程中的一系列反应[4,8], 进而引起基因表达的变化, 最终表现为细胞生物学特征的改变[4].
在对一些肿瘤细胞的研究中发现, 失重或模拟失重可导致人甲状腺滤泡癌细胞ML-1进入早期细胞程序死亡, 同时有线粒体的破坏和重分布以及微管的破坏[5,9]. 但是在回转器模拟失重状态下, 人胰腺癌NOR-P1细胞较对照组出现较多的有丝分裂细胞(Ki-67阳性细胞)和较少的凋亡细胞[10].
在对一些正常细胞的研究中发现, 失重或模拟失重可使人前列腺细胞增殖抑制、凋亡增加及分化能力增强, 并通过不同的信号转导系统激活第二信使及其相互作用能力[11]. 失重能使人甲状腺细胞[12]和人内皮细胞的凋亡增加[13-14]. 但是, 人红细胞的凋亡[15]不受失重的影响. C6神经胶质细胞回转器模拟失重30 min后出现典型的凋亡改变, 但是20或32 h后凋亡的细胞减少[16].
SGC-7901细胞与HFE-145细胞对回转器模拟失重的反应不同, 可能是因为SGC-7901细胞是胃癌细胞系, 他们已经恶变, 失去了正常细胞的稳定性, 而胃黏膜上皮HFE-145细胞能够快速更新且有较好的适应能力, 可以很快地建立一种新的平衡.
以往未见对失重或模拟失重状态下胃癌和胃黏膜上皮细胞的研究, 我们的研究结果与其他的研究之所以有不同之处, 可能是因为细胞种类不同或模拟失重的条件及时间不同, 所以, 细胞对失重的反应不尽相同. 但是, 回转器不能完全模拟太空的情况, 且与其他模拟失重的设备不同, 所以, 我们的结论仅限于3 d内回转器模拟失重的情况下.
总之, 回转器模拟失重使胃癌SGC-7901细胞在72 h时出现了凋亡增加, 而胃黏膜上皮HFE-145细胞仅在模拟失重后12 h出现了相似的变化, 说明3 d的回转器模拟失重状态能使胃癌细胞的凋亡增加, 而对胃黏膜上皮细胞影响不明显. 当然, 得出这一结论需要进一步的研究证实.
太空环境对于人类来说是一个全新的未知领域, 以往的科学研究表明太空飞行可导致机体的一些生理学变化, 包括脑脊液流动性的改变、电解质减少、肌肉萎缩、太空运动病、贫血、免疫反应下降和骨质疏松等. 但是生物体内的细胞对重力的反应还需要进一步研究. 本实验把这胃癌SGC-7901细胞和胃黏膜上皮HFE-145细胞置于回转器模拟失重的状态下, 研究模拟失重对细胞凋亡的影响.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院病理实验科
以往未见对失重或模拟失重状态下胃癌细胞和胃黏膜上皮细胞的研究. 本研究结果提示3 d的回转器模拟失重状态能使胃癌细胞的凋亡增加, 而对胃黏膜上皮细胞影响不明显.
本研究选题较好, 设计合理, 结果可信, 具有很好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Hughes-Fulford M. Changes in gene expression and signal transduction in microgravity. J Gravit Physiol. 2001;8:P1-P4. [PubMed] |
| 2. | Zou JP, Shimizu J, Ikegame K, Takiuchi H, Fujiwara H, Hamaoka T. Tumor-immunotherapy with the use of tumor-antigen-pulsed antigen-presenting cells. Cancer Immunol Immunother. 1992;35:1-6. [PubMed] [DOI] |
| 3. | Hou G, Mohamalawari DR, Blancaflor EB. Enhanced gravitropism of roots with a disrupted cap actin cytoskeleton. Plant Physiol. 2003;131:1360-1373. [PubMed] [DOI] |
| 5. | Infanger M, Kossmehl P, Shakibaei M, Bauer J, Kossmehl-Zorn S, Cogoli A, Curcio F, Oksche A, Wehland M, Kreutz R. Simulated weightlessness changes the cytoskeleton and extracellular matrix proteins in papillary thyroid carcinoma cells. Cell Tissue Res. 2006;324:267-277. [PubMed] [DOI] |
| 6. | Kumei Y, Morita S, Katano H, Akiyama H, Hirano M, Oyha K, Shimokawa H. Microgravity signal ensnarls cell adhesion, cytoskeleton, and matrix proteins of rat osteoblasts: osteopontin, CD44, osteonectin, and alpha-tubulin. Ann N Y Acad Sci. 2006;1090:311-317. [PubMed] [DOI] |
| 7. | Infanger M, Kossmehl P, Shakibaei M, Schulze-Tanzil G, Cogoli A, Faramarzi S, Bauer J, Curcio F, Paul M, Grimm D. Longterm conditions of mimicked weightlessness influences the cytoskeleton in thyroid cells. J Gravit Physiol. 2004;11:P169-P172. [PubMed] |
| 8. | Kumei Y, Shimokawa H, Ohya K, Katano H, Akiyama H, Hirano M, Morita S. Small GTPase Ras and Rho expression in rat osteoblasts during spaceflight. Ann N Y Acad Sci. 2007;1095:292-299. [PubMed] [DOI] |
| 9. | Vassy J, Portet S, Beil M, Millot G, Fauvel-Lafève F, Gasset G, Schoevaert D. Weightlessness acts on human breast cancer cell line MCF-7. Adv Space Res. 2003;32:1595-1603. [PubMed] [DOI] |
| 10. | Nakamura K, Kuga H, Morisaki T, Baba E, Sato N, Mizumoto K, Sueishi K, Tanaka M, Katano M. Simulated microgravity culture system for a 3-D carcinoma tissue model. Biotechniques. 2002;33:1068-1070, 1072, 1074-1076. [PubMed] |
| 11. | Clejan S, O'Connor K, Rosensweig N. Tri-dimensional prostate cell cultures in simulated microgravity and induced changes in lipid second messengers and signal transduction. J Cell Mol Med. 2001;5:60-73. [PubMed] [DOI] |
| 12. | Kossmehl P, Shakibaei M, Cogoli A, Infanger M, Curcio F, Schönberger J, Eilles C, Bauer J, Pickenhahn H, Schulze-Tanzil G. Weightlessness induced apoptosis in normal thyroid cells and papillary thyroid carcinoma cells via extrinsic and intrinsic pathways. Endocrinology. 2003;144:4172-4179. [PubMed] [DOI] |
| 13. | Infanger M, Kossmehl P, Shakibaei M, Baatout S, Witzing A, Grosse J, Bauer J, Cogoli A, Faramarzi S, Derradji H. Induction of three-dimensional assembly and increase in apoptosis of human endothelial cells by simulated microgravity: impact of vascular endothelial growth factor. Apoptosis. 2006;11:749-764. [PubMed] [DOI] |
| 14. | Ulbrich C, Westphal K, Baatout S, Wehland M, Bauer J, Flick B, Infanger M, Kreutz R, Vadrucci S, Egli M. Effects of basic fibroblast growth factor on endothelial cells under conditions of simulated microgravity. J Cell Biochem. 2008;104:1324-1341. [PubMed] [DOI] |
| 15. | Sytkowski AJ, Davis KL. Erythroid cell growth and differentiation in vitro in the simulated microgravity environment of the NASA rotating wall vessel bioreactor. In Vitro Cell Dev Biol Anim. 2001;37:79-83. [PubMed] [DOI] |
| 16. | Uva BM, Masini MA, Sturla M, Bruzzone F, Giuliani M, Tagliafierro G, Strollo F. Microgravity-induced apoptosis in cultured glial cells. Eur J Histochem. 2002;46:209-214. [PubMed] |