修回日期: 2009-08-11
接受日期: 2009-08-17
在线出版日期: 2009-08-28
目的: 探讨大肠癌组织中多药耐药基因产物的表达特点及其对大肠癌化疗的指导意义.
方法: 随机选取2007-05/2009-05空军总医院普通外科行根治性手术的大肠癌患者56例组成试验组, 选取在消化内科门诊健康体检行肠镜活检患者10例组成对照组. 应用免疫组织化学法检测两组标本中GST-π、P-gp、Topo-Ⅱ、TS和MRP的表达, 并结合其临床病理资料进行回顾性分析.
结果: GST-π、P-gp、Topo-Ⅱ、TS和MRP在实验组和对照组间的表达差异显著(P<0.01或<0.05), GST-π、P-gp、Topo-Ⅱ、TS和MRP在大肠癌中的阳性表达率依次为73.2%(41/56)、66.1%(37/56)、48.2%(27/56)、41.1%(23/56)和37.5%(21/56). 他们的表达与性别、年龄、肿瘤部位、大小、侵袭深度和转移与否均无关, 而与肿瘤的分化程度和组织学类型密切相关.
结论: GST-π、P-gp、Topo-Ⅱ、TS和MRP在大肠癌表达存在明显的异质性, 其高表达是大肠癌多药耐药产生的基础.
引文著录: 魏学明, 顾国利, 任力, 李德昌, 王石林, 宁守斌, 熊梅. 多药耐药基因产物在大肠癌组织中的表达及临床意义. 世界华人消化杂志 2009; 17(24): 2463-2468
Revised: August 11, 2009
Accepted: August 17, 2009
Published online: August 28, 2009
AIM: To detect the expression of multidrug resistance gene product in colorectal carcinoma (CRC) and analyze their significance in the chemotherapy for CRC.
METHODS: Fifty-six CRC patients who underwent radical surgery from May 2007 to May 2009 at our hospital were randomly selected. Ten healthy subjects who underwent colonoscopy and biopsy were randomly selected as controls. The streptavidin-peroxidase (SP) immunohistochemistry was used to detect the expression of GST-π, P-gp, Topo-II, TS and MRP in CRC tissues and normal mucosal tissues. The clinicopathological data of the patients were analysed retrospectively.
RESULTS: The expression of GST-π, P-gp, Topo-II, TS and MRP proteins showed significant differences between CRC patients and control patients (all P < 0.01 or 0.05). The positive expression rates of GST-π, P-gp, Topo-II, TS and MRP proteins in CRC were 73.2% (41/56), 66.1% (37/56), 48.2% (27/56), 41.1% (23/56) and 37.5% (21/56), respectively. The positive expression rates of these proteins were closely correlated with histological type and degree of differentiation, but not correlated with patient sex, age, tumors site, tumor size, invasive depth and lymph node metastasis.
CONCLUSION: The expression of GST-π, P-gp, Topo-II, TS and MRP proteins in CRC shows obvious heterogeneity. The overexpression of these protein underlies the multidrug resistance in CRC.
- Citation: Wei XM, Gu GL, Ren L, Li DC, Wang SL, Ning SB, Xiong M. Clinical significance of the expression of multidrug resistance gene products in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2463-2468
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2463.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2463
大肠癌是我国最常见的消化系恶性肿瘤之一, 化疗是进展期大肠癌治疗的重要临床措施[1-2]. 术前新辅助化疗可降低大肠癌分期、改善术式选择、提高近期疗效; 术后化疗可抑制大肠癌复发、治疗肿瘤转移. 因此, 化疗的成败将直接关系大肠癌患者的预后[3]. 其疗效取决于肿瘤对化疗药物的敏感程度, 这由肿瘤自身的生物学特性决定[4]. 虽然目前临床上对大肠癌提倡进行个性化联合化疗方案, 但临床疗效仍不十分满意; 肿瘤的多药耐药性(multidrug resistance, MDR)是最主要的原因[5]. 因此, 明确相关耐药基因产物在大肠癌肿瘤组织中的表达特点对了解大肠癌的生物学特性、指导大肠癌患者个性化医疗具有重要的临床意义. 研究发现[6-10]: 胎盘型谷胱甘肽-S-转移酶-π(glutathione-s-transferase π, GST-π)、P-糖蛋白(P-glycoprotein, P-gp)、拓扑异构酶Ⅱ(topoisomerase Ⅱ, Topo-Ⅱ)、胸苷酸合成酶(thymidylate synthase, TS)和多药耐药相关蛋白(multidrug resistance related protein, MRP)与肿瘤化疗的多药耐药密切相关. 我们采用免疫组织化学方法联合检测大肠癌肿瘤组织中GST-π、P-gp、Topo-Ⅱ、TS和MRP的表达特点, 探讨其与临床病理特征的关系, 为临床判定大肠癌对化疗的敏感性提供客观的参考指标. 同时, 也为大肠癌患者制定个性化化疗方案提供理论依据.
随机选取2007-05/2009-05我院普通外科行根治性手术的大肠癌患者56例组成试验组; 消化内科门诊行肠镜检查、无结直肠肿瘤病史、组织学结果正常者10例组成对照组. 所有病理标本均经甲醛固定、石蜡包埋, 并经HE染色组织学确诊. 全部病例术前均未行放化疗. 即用型GST-π鼠抗人mAb(产品编号: ZM-0110, 克隆号: LW29)、即用型P-gp鼠抗人mAb(产品编号: ZM-0179, 克隆号: C494)、即用型Topo-Ⅱ鼠抗人mAb(产品编号: ZM-0245, 克隆号: 3F6)、即用型TS鼠抗人mAb(产品编号: ZM-0259, 克隆号: TS106)、即用型MRP鼠抗人mAb(产品编号: ZM-0345, 克隆号: OCRL-1)、通用型SP检测试剂盒(SP-9000)、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司. 试验由LAB Vision Autostainer360自动染色仪系统(福建迈新公司)程控完成、镜下图像以Olympus Dp70图像采集分析仪进行采集、分析.
切片常规脱蜡至水, PBS浸泡5 min; GST-π无需抗原修复, P-gp、Topo-Ⅱ经10 mmol/L pH6.0的EDTA修复液高压加热抗原修复, TS、MRP经1 mmol/L pH9.0的EDTA修复液高压加热抗原修复. 30 mL/L H2O2孵育10 min, PBS冲洗, 2 min×3次. 滴加正常山羊血清工作液孵育10 min; 倾去, 勿洗. 滴加一抗37℃孵育1.5 h, PBS冲洗2 min×3次. 滴加二抗37℃孵育20 min, PBS冲洗2 min×3次. 滴加辣根酶标记链霉卵白素37℃孵育30 min, PBS冲洗2 min×3次. DAB显色, 冲洗, 复染, 脱水, 透明, 封片. PBS代替一抗作阴性对照, 正常大肠黏膜上皮表达作阳性对照.
GST-π、TS定位于细胞质; P-gp、MRP定位于细胞膜和细胞质; Topo-Ⅱ定位于细胞核. 在200倍的视野下随机选取10个视野, 记数每个视野中肿瘤细胞的染色情况, 取平均值. 结果判定[11]: 以定位部位中出现粗细一致的棕黄色颗粒为阳性染色. 按切片中阳性细胞占全部细胞数的百分数对表达强度进行分级: 阳性细胞数<10%定为阴性, 10%-25%阳性定为阳性(+), 25%-75%明显阳性定为中度阳性(++), >75%阳性则为强阳性(+++). 评分过程由两名高年资病理科医生独立完成.
统计学处理 应用SPSS15.0统计软件包进行统计分析. 计数资料采用2个(或多个)样本率比较的χ2检验, 正态分布的计量资料采用随机设计的两总体均数的t检验, 积分相关性采用Spearman等级相关分析, P<0.05为差异有统计学意义.
试验组共有56例, 男31例, 女25例; 年龄39-83(中位年龄61.42±13.32)岁; 肿瘤大小2.6-11.2(平均5.81±2.16) cm; 部位: 结肠29例, 直肠27例; 分化类型: 高分化腺癌6例、中分化腺癌15例, 低分化腺癌21例、黏液腺癌14例. 肿瘤组织侵及黏膜及黏膜下12例, 侵入肌层19例, 侵入浆膜或浆膜外25例; 无淋巴结转移28例, 1-5枚淋巴结转移19例, 5枚以上淋巴结转移9例. TNM分期: Ⅰ期10例, Ⅱ期17例, Ⅲ期20例, Ⅳ期9例. 对照组共10例, 男7例, 女3例; 年龄42-66(中位年龄56.26±8.47)岁; 结肠6例, 直肠4例. 2组患者在性别、年龄、标本部位方面无统计学差异.
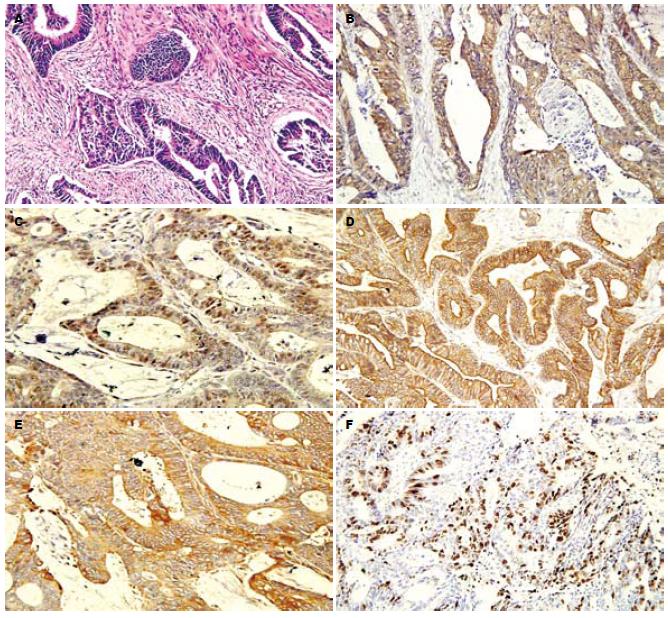
GST-π、TS蛋白呈棕黄色细颗粒表达于胞质(图1); 肿瘤间质不染色. P-gp、MRP主要表达于细胞膜和细胞质, 呈棕褐色颗粒状; 肿瘤间质不染色(图1). Topo-Ⅱ主要表达于细胞核, 呈棕褐色颗粒状, 肿瘤间质不染色(图1). 大肠癌组中GST-π、P-gp、Topo-Ⅱ、TS、MRP的阳性表达率依次为: 73.2%(41/56)、66.1%(37/56)、48.2%(27/56)、41.1%(23/56)、37.5%(21/56). 除GST-π有1例在正常大肠黏膜上有弱阳性表达外, 其余在正常大肠黏膜上均无阳性表达. 2组间差异显著(GST-π: χ2 = 12.05, P<0.01; P-gp: χ2 = 12.47, P<0.01; Topo-Ⅱ: χ2 = 6.29, P<0.05; TS: χ2 = 4.62, P<0.05; MRP: χ2 = 4.03, P<0.05).
由表1可知, GST-π、P-gp、Topo-Ⅱ、TS、MRP的表达与患者性别、年龄、肿瘤部位、大小、侵袭深度及转移与否均无关, 而与肿瘤分化类型密切相关: GST-π、P-gp、Topo-Ⅱ、TS、MRP随肿瘤分化程度的降低表达阳性率逐渐升高. 统计学差异显著(高分化和中分化之间无差异, 低分化和黏液腺癌之间无差异, 但高中分化与低分化、黏液腺癌组间差异显著).
| 因素 | n | GST-π | P-gp | Topo-Ⅱ | TS | MRP | |||||
| (-) | (+)-(+++) | (-) | (+)-(+++) | (-) | (+)-(+++) | (-) | (+)-(+++) | (-) | (+)-(+++) | ||
| 性别 | |||||||||||
| 男 | 31 | 7 | 24 | 11 | 20 | 16 | 15 | 19 | 12 | 20 | 11 |
| 女 | 25 | 8 | 17 | 8 | 17 | 13 | 12 | 14 | 11 | 15 | 10 |
| 年龄(岁) | |||||||||||
| ≤45 | 13 | 5 | 8 | 7 | 6 | 9 | 4 | 9 | 4 | 8 | 5 |
| 46-60 | 29 | 4 | 25 | 11 | 18 | 12 | 17 | 15 | 14 | 17 | 12 |
| >60 | 14 | 6 | 8 | 7 | 7 | 8 | 6 | 9 | 5 | 10 | 4 |
| 肿瘤大小(cm) | |||||||||||
| ≤5 | 21 | 7 | 14 | 10 | 11 | 11 | 10 | 12 | 9 | 15 | 6 |
| >5 | 35 | 8 | 27 | 9 | 26 | 18 | 17 | 21 | 14 | 20 | 15 |
| 肿瘤部位 | |||||||||||
| 结肠 | 29 | 6 | 23 | 15 | 14 | 14 | 15 | 16 | 13 | 16 | 13 |
| 直肠 | 27 | 9 | 18 | 14 | 13 | 15 | 12 | 14 | 10 | 19 | 8 |
| 分化 | |||||||||||
| 高分化 | 6 | 4 | 2 | 4 | 2 | 5 | 1 | 6 | 0 | 6 | 0 |
| 中分化 | 15 | 8 | 7 | 10 | 5 | 14 | 1 | 14 | 1 | 15 | 0 |
| 低分化 | 21 | 2 | 19a | 3 | 18a | 7 | 14a | 3 | 14a | 8 | 13a |
| 黏液腺癌 | 14 | 1 | 13a | 2 | 12a | 3 | 11a | 6 | 8a | 6 | 8a |
| 侵袭深度 | |||||||||||
| 浆膜内 | 31 | 8 | 23 | 10 | 21 | 17 | 14 | 17 | 14 | 19 | 12 |
| 浆膜及以外 | 25 | 7 | 18 | 9 | 16 | 12 | 13 | 16 | 9 | 16 | 9 |
| 淋巴结转移 | |||||||||||
| 无 | 28 | 5 | 23 | 7 | 21 | 15 | 13 | 15 | 13 | 17 | 11 |
| 1-5枚 | 19 | 7 | 12 | 8 | 11 | 9 | 10 | 12 | 7 | 13 | 6 |
| >5枚 | 9 | 3 | 6 | 4 | 5 | 5 | 4 | 6 | 3 | 5 | 4 |
肿瘤的MDR是指肿瘤细胞被一种药物诱发耐药后, 同时对其他多种结构和作用机制完全不同的药物产生交叉耐药的一种现象[12-14]; 这是导致大肠癌化疗失败的主要原因之一. MDR是一个多基因参与、涉及多种基因产物的复杂过程. 目前已发现耐药谱明确的耐药基因有11种[15], 分为: 药泵蛋白、药物代谢酶类、DNA修复酶、蛋白质合成限速酶等. 不同肿瘤所具有的耐药表型各异, 这可能是单种耐药基因或多种耐药基因同时表达的结果. 目前已明确的MDR机制有以下4种[16-17]: (1)典型MDR(由MDR1及其产物P-gp介导); (2)非典型MDR(由Topo-Ⅱ介导); (3)GST-π表达; (4)TS表达.
P-gp与MRP分别由MDR1和MRP基因编码, 同属三磷酸腺苷结合盒(ATP binding cassette, ABC)跨膜转运蛋白超家族[18]. 两者均通过与细胞内化疗药物结合、借助ATP供能将药物"泵"出细胞外, 使细胞内化疗药物浓度下降、毒性减低或消失从而达到耐药作用. 因此, P-gp与MRP具有相似的耐药谱, 都是对疏水性抗癌药(如: 蒽环类、长春碱类、表鬼臼毒素类、放线菌素D、米托蒽醌、紫杉碱等)起作用[19], 其中MRP对紫杉碱类更敏感. 研究证实[20]: P-gp高表达与肿瘤转移潜能、低缓解率、高复发率、化疗疗效差、生存期短等密切相关. 本研究显示: P-gp在大肠癌中阳性表达率(高达66.1%)明显高于MRP, 且与大肠癌的分化程度相关. 这说明P-gp是大肠癌MDR的重要因素之一.
GST-π属于GST家族成员, 可与亲脂性细胞毒药物(如顺铂、阿霉素、丝裂霉素等)结合, 促使其代谢成无毒物质而排出体外, 从而降低药物的细胞毒作用, 增加细胞的耐药性. 另外, 由于MRP的"泵"作用与细胞内的谷胱甘肽浓度有关, 而GST-π与谷胱甘肽的氧化还原状态及宿主细胞的分化、DNA修复、转录因子激活和损失保护密切相关[20-21]. 因此, GST-π也参与MRP介导的耐药作用. 所以, GST-π所介导的MDR范围更广. 本研究显示: GST-π的阳性表达率高达73.2%, 且随肿瘤分化程度降低而明显升高. 这说明GST-π也是大肠癌MDR的重要因素之一, 其高表达也是大肠癌预后不佳的指标.
TS是胸苷酸合成的限速酶, 抑制该酶将阻止大肠癌细胞DNA合成、抑制肿瘤细胞分裂、诱导肿瘤细胞凋亡. TS是5-FU的作用靶点. 5-FU进入人体后先转变成FdUMP, 再与TS和四氢叶酸一起形成三元络合物, 阻止dTMP合成、干扰肿瘤细胞DNA的合成, 从而达到杀死肿瘤细胞的目的[22-23]. 而TS的过表达将使FdUMP不能完全抑制TS的作用, 诱发肿瘤细胞对5-FU产生耐药. 5-FU是目前大肠癌临床化疗的主要药物, 而本研究显示: TS在大肠癌组织中的阳性表达率高达41.1%, 且随肿瘤的分化程度降低而明显增高. 因此, 有必要对大肠癌肿瘤细胞进行TS表达的相关检测以评价肿瘤对于5-FU的敏感性.
Topo-Ⅱ参与真核细胞DNA的转录、翻译、复制及染色体分离等过程, 能促进肿瘤细胞内DNA合成、提高肿瘤的增殖能力[24-25]. 因此, Topo-Ⅱ含量的减少和(或)Topo-Ⅱ活性的降低将导致肿瘤的多药耐药. 目前临床上用于大肠癌化疗的Topo-Ⅱ抑制剂有阿霉素、依托泊苷、铂类以及5-FU等. 他们的抗癌活性不仅在于抑制酶活性本身, 而且还通过增加裂解复合物的稳定性来影响癌细胞的增殖、诱导肿瘤细胞凋亡. 本研究虽然发现大肠癌组织中Topo-Ⅱ的阳性表达率较高, 但未对其进行活性的检测. 因此, 尚不能仅由此结果就断言Topo-Ⅱ的阳性表达者一定对化疗敏感.
现代肿瘤学研究发现[4,14]: 恶性肿瘤在发生时就已经决定了其生长、侵袭、转移等生物学行为特征. 本研究显示: 多药耐药基因产物的表达只与大肠癌的分化类型密切相关. 这说明大肠癌的MDR也是由其本身的生物学特征所决定, 与上述理论一致. 因此, 本研究有助于加深对大肠癌生物学特征的了解. 文献报道的GST-π、P-gp、Topo-Ⅱ、TS、MRP阳性率差别较大[26-30]. 分析原因: (1)各指标的特异性较差; (2)抗体因素: 单克隆抗体与多克隆抗体的敏感性不同, 克隆系和抗体滴度的不同也会影响试验结果. (3)试验操作因素: 试验温度、反应时间等因素干扰. 因此, 仅靠单一项目将无法承担评判大肠癌对于化疗敏感性的指标. 只有对大肠癌组织进行GST-π、P-gp、Topo-Ⅱ、TS、MRP等多基因产物的联合检测, 才能更客观、全面地筛选出针对不同耐药机制的高效低毒药物. 这有助于为大肠癌患者制定个体化化疗方案、前瞻性优化化疗药物、设计合理的药物逆转策略、减少化疗盲目性、提高疗效预见性、改善大肠癌患者的预后.
大肠癌是最常见的消化系恶性肿瘤之一, 化疗是治疗进展期大肠癌的重要措施. 其成败将直接关系着大肠癌患者的预后. 目前临床上虽然对大肠癌患者提倡进行个性化的联合化疗方案, 但具体疗效仍不尽人意; 肿瘤的多药耐药性(MDR)是最主要的原因.
谢敏, 主任医师, 南京大学医学院附属鼓楼医院普外科; 傅华群, 教授, 南昌大学第二附属医院普外科; 沈柏用, 副教授, 上海交通大学医学院附属瑞金医院肝胆胰外科中心
本研究采用免疫组织化学SP法联合检测GST-π、P-gp、Topo-Ⅱ、TS和MRP在大肠癌肿瘤组织中的表达, 探讨多药耐药基因产物的表达与大肠癌的临床病理特征的关系, 为临床上判定大肠癌对化疗的敏感性提供客观的参考指标. 同时, 也为大肠癌患者制定个性化化疗方案提供理论指导.
联合检测GST-π、P-gp、Topo-Ⅱ、TS和MRP在大肠癌肿瘤组织中的表达可作为判断大肠癌预后和对化疗敏感性的有效指标. 这有助于为大肠癌患者制定和提供疗效更好、敏感性更高、不良反应更小的个体化治疗措施.
本研究选题较好, 设计合理, 结果可靠, 具有很好的临床参考价值.
编辑: 李军亮 电编:何基才
| 2. | 汪 晓东, 曹 霖, 曾 天芳, 邱 萌, 李 立. 多学科协作诊治模式下新辅助/辅助化疗联合结直肠癌手术的临床效果. 中国普外基础与临床杂志. 2008;15:615-619. |
| 3. | Woodcock TM. Colorectal cancer chemotherapy. J Ky Med Assoc. 2009;107:93-94. [PubMed] |
| 5. | 王 恒毅, 陈 孝平. 耐药蛋白差异性表达与肿瘤个体化化学治疗关系的研究进展. 中国现代普通外科进展. 2008;11:336-338. |
| 6. | Bandrés E, Zárate R, Ramirez N, Abajo A, Bitarte N, Garíia-Foncillas J. Pharmacogenomics in colorectal cancer: the first step for individualized-therapy. World J Gastroenterol. 2007;13:5888-5901. [PubMed] |
| 7. | Tsavaris N, Lazaris A, Kosmas C, Gouveris P, Kavantzas N, Kopterides P, Papathomas T, Agrogiannis G, Zorzos H, Kyriakou V. Topoisomerase I and IIalpha protein expression in primary colorectal cancer and recurrences following 5-fluorouracil-based adjuvant chemotherapy. Cancer Chemother Pharmacol. 2009;64:391-398. [PubMed] [DOI] |
| 8. | Pohl A, Lenz HJ. Individualization of therapy for colorectal cancer based on clinical and molecular parameters. Gastrointest Cancer Res. 2008;2:S38-S41. [PubMed] |
| 9. | Nishioka C, Sakaeda T, Nakamura T, Moriya Y, Okamura N, Tamura T, Nakahara T, Aoyama N, Kamigaki T, Ohno M. MDR1, MRP1 and MRP2 genotypes and in vitro chemosensitivity in Japanese patients with colorectal adenocarcinomas. Kobe J Med Sci. 2004;50:181-188. [PubMed] |
| 10. | Gaitanarou E, Seretis E, Xinopoulos D, Paraskevas E, Arnoyiannaki N, Voloudakis-Baltatzis I. Immunohistochemical localization of glutathione S-transferase-pi in human colorectal polyps. World J Gastroenterol. 2008;14:4179-4184. [PubMed] [DOI] |
| 12. | Jäeger W. Classical resistance mechanisms. Int J Clin Pharmacol Ther. 2009;47:46-48. [PubMed] |
| 15. | Dean M. ABC transporters, drug resistance, and cancer stem cells. J Mammary Gland Biol Neoplasia. 2009;14:3-9. [PubMed] [DOI] |
| 16. | Otrubova K, McGuire KL, McAlpine SR. Scaffold targeting drug-resistant colon cancers. J Med Chem. 2007;50:1999-2002. [PubMed] [DOI] |
| 18. | Bow DA, Perry JL, Miller DS, Pritchard JB, Brouwer KL. Localization of P-gp (Abcb1) and Mrp2 (Abcc2) in freshly isolated rat hepatocytes. Drug Metab Dispos. 2008;36:198-202. [PubMed] [DOI] |
| 19. | Di Nicolantonio F, Mercer SJ, Knight LA, Gabriel FG, Whitehouse PA, Sharma S, Fernando A, Glaysher S, Di Palma S, Johnson P. Cancer cell adaptation to chemotherapy. BMC Cancer. 2005;5:78. [PubMed] [DOI] |
| 20. | De Iudicibus S, De Pellegrin A, Stocco G, Bartoli F, Bussani R, Decorti G. ABCB1 gene polymorphisms and expression of P-glycoprotein and long-term prognosis in colorectal cancer. Anticancer Res. 2008;28:3921-3928. [PubMed] |
| 21. | Müller J, Sidler D, Nachbur U, Wastling J, Brunner T, Hemphill A. Thiazolides inhibit growth and induce glutathione-S-transferase Pi (GSTP1)-dependent cell death in human colon cancer cells. Int J Cancer. 2008;123:1797-1806. [PubMed] [DOI] |
| 22. | Jensen SA, Vainer B, Kruhøffer M, Sørensen JB. Microsatellite instability in colorectal cancer and association with thymidylate synthase and dihydropyrimidine dehydrogenase expression. BMC Cancer. 2009;9:25. [PubMed] [DOI] |
| 23. | Uchida K, Danenberg PV, Danenberg KD, Grem JL. Thymidylate synthase, dihydropyrimidine dehydrogenase, ERCC1, and thymidine phosphorylase gene expression in primary and metastatic gastrointestinal adenocarcinoma tissue in patients treated on a phase I trial of oxaliplatin and capecitabine. BMC Cancer. 2008;8:386. [PubMed] [DOI] |
| 24. | Bidgoli SA, Azizi E, Zavarhei MD. Association between p53 expression and Bcl-2, P-glycoprotein, topoisomerase II alpha, thymidylate synthase and thymidine phosphorylase as potential therapeutic targets in colorectal cancer patients. Pak J Biol Sci. 2007;10:3350-3355. [PubMed] [DOI] |
| 25. | Coss A, Tosetto M, Fox EJ, Sapetto-Rebow B, Gorman S, Kennedy BN, Lloyd AT, Hyland JM, O'Donoghue DP, Sheahan K. Increased topoisomerase IIalpha expression in colorectal cancer is associated with advanced disease and chemotherapeutic resistance via inhibition of apoptosis. Cancer Lett. 2009;276:228-238. [PubMed] [DOI] |
| 26. | 白 美玲, 常 永霞, 张 凡, 张 九鸿, 刘 军超, 林 媛媛, 成 日青, 赵 秀芳. 71例大肠癌患者耐药基因蛋白与预后关系的初步探讨. 河北北方学院学报(医学版). 2009;26:10-15. |
| 29. | Lee TB, Park JH, Min YD, Kim KJ, Choi CH. Epigenetic mechanisms involved in differential MDR1 mRNA expression between gastric and colon cancer cell lines and rationales for clinical chemotherapy. BMC Gastroenterol. 2008;8:33. [PubMed] [DOI] |