修回日期: 2009-08-04
接受日期: 2009-08-10
在线出版日期: 2009-08-28
目的: 观察柴胡皂甙D(saikosaponin-d, SSd)对二乙基亚硝胺(diethylnitrosamine, DEN)致大鼠肝癌免疫功能的影响, 并探讨其与SSd抗肝肿瘤作用的关系.
方法: 清洁级♂SD大鼠90只, 平均体质量248.18±12.32 g, 随机分为5组: 模型组(n = 20), 对照组(n = 10)及SSd大、中、小剂量治疗组(均n = 20). 除对照组给予等量生理盐水灌胃外, 其余各组大鼠均给予2 mg/L DEN灌胃, 按体质量10 mg/kg给药, 每周5次, 同时各治疗组每天给予不同浓度SSd(2.0、1.5、1.0 mg/kg)腹腔注射, 至16 wk停药, 麻醉后处死大鼠. HE染色观察实验大鼠肝组织病理学结构的改变, 应用流式细胞仪测定大鼠外周血T淋巴细胞亚群(CD3+ CD4+%、CD3+ CD8+%及CD3+ CD4+/ CD3+ CD8+比值).
结果: SSd各治疗组大鼠癌结节数及灶的大小均小于模型组. 镜下单纯造模组癌细胞呈多形性, 异形性明显, Edmondson分级多数属于Ⅲ级; 相反, SSd各干预组癌细胞分化程度高, 异型性较低, 分级多为Ⅰ-Ⅱ级; 肝癌模型组与正常对照组T淋巴细胞亚群比较CD4+、CD4+/CD8+明显下降, CD8+上升, 差异有统计学意义(33.56%±4.16% vs 45.50%±4.03%; 1.06±0.56 vs 1.93±0.28; 30.62%±3.65% vs 22.88%±3.15%; 均P<0.05); 而SSd各组与肝癌模型组T淋巴细胞亚群比较CD4+、CD4+/CD8+明显回升, CD8+下降, 差异有统计学意义, 尤其以SSd大剂量组明显(39.06%±3.98% vs 33.56%±4.16%; 1.55±0.29 vs 1.06±0.56; 18.99%±3.09% vs 30.62%±3.65%; 均P<0.05).
结论: SSd对DEN诱发大鼠肝癌形成有一定的免疫保护作用.
引文著录: 程延安, 王宝峰, 刘振国, 党双锁, 马红兵, 杨扬. 柴胡皂甙D对DEN致大鼠肝癌免疫功能的影响. 世界华人消化杂志 2009; 17(24): 2451-2455
Revised: August 4, 2009
Accepted: August 10, 2009
Published online: August 28, 2009
AIM: To investigate the immunoregulatory effects of saikosaponin-d (SSd) in rats with diethylnitrosamine (DEN)-induced experimental hepatocarcinoma and explore whether such immunoregulatory effects are associated with the antitumor effects of SSd.
METHODS: Ninety Sprague-Dawley male rats, weighting 248.18 ± 12.32 g, were divided into five groups randomly: normal control group (n = 10), model control group (n = 20) and three treatment groups (n = 20 in each group). Except the normal control group, rats in other groups were administrated with 2 mg/L DEN at a dose of 10 mg/kg bodyweight five times one week for sixteen weeks. Meanwhile, rats in the treatment groups were injected intraperitoneally with SSd at different doses (1.0, 1.5 and 2.0 mg/kg, respectively) once daily for sixteen weeks. Rats were anesthetized and killed at the end of last week. Hematoxylin and eosin (HE) staining was used to examine the pathological changes in the liver. T lymphocyte subsets (CD3+ CD4+%, CD3+ CD8+% and CD3+ CD4+/ CD3+ CD8+ ratio) were measured by flow cytometry.
RESULTS: Both tumor volume and tumor number were significantly reduced in the three SSd treatment groups when compared with the model control group. According to criteria of Edmondson and Steiner, the majority of tumors in the model group were histologically classified as grade III while those in the three SSd treatment groups were classified as grades I-II. The tumors in the treatment groups were well differentiated while those in the model control group were poorly differentiated. Compared with the control group, the percentage of CD4+ T lymphocytes and CD4+/CD8+ ratio significantly decreased in the model control group while the percentage of CD8+ T lymphocytes markedly increased (33.56% ± 4.16% vs 45.50% ± 4.03%, 1.06 ± 0.56 vs 1.93 ± 0.28 and 30.62% ± 3.65% vs 22.88% ± 3.15%, respectively; all P < 0.05). In contrast, a significant increase in the percentage of CD4+ T lymphocytes and CD4+/CD8+ ratio and a marked decrease in the percentage of CD8+ T lymphocytes were noted in the three SSd treatment groups (especially in high-dose SSd treatment group) when compared with the model control group (39.06% ± 3.98% vs 33.56% ± 4.16%, 1.55 ± 0.29 vs 1.06 ± 0.56 and 18.99% ± 3.09% vs 30.62% ± 3.65%, respectively; all P < 0.05).
CONCLUSION: SSd has inhibitory effects on DEN-induced hepatocarcinogenesis in rats perhaps through exerting an immunoprotective effect.
- Citation: Cheng YA, Wang BF, Liu ZG, Dang SS, Ma HB, Yang Y. Immunoregulatory effects of saikosaponin-d in rats with experimental hepatocarcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2451-2455
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2451.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2451
肝细胞癌(hepatocellular carcinoma, HCC)术后复发和转移率极高, 目前尚无较好的治疗办法. 肿瘤细胞的抗原性已被证实, 提高宿主的免疫功能疗法在多种肿瘤的治疗中已显示出诱人的前景. 柴胡皂甙D(saikosaponin-d, SSd)是从传统中药柴胡中提取的有效单体成分, 具有显著的抗炎、抗肿瘤作用[1-4]. 本研究通过二乙基亚硝胺(DEN)诱导大鼠肝癌模型, 初步观察SSd对大鼠肝癌形成的影响及免疫功能的调节作用.
DEN, 纯度>0.99 kg/L(Sigma公司), 柴胡皂甙D(SSd, 江西本草天工科技有限责任公司), 二甲基亚砜(DMSO, Sigma公司), 台式高速离心机(上海安亭科学仪器厂), 隔水式电热恒温干燥箱(上海医疗器械厂), FACSCalibur型流式细胞仪, 美国Becton Dickinson公司产品. ♂清洁级SD大鼠90只, 平均体质量248.18±12.32 g, 由西安交通大学医学院动物实验中心提供.
1.2.1 分组: 将大鼠随机分为5组: 正常对照组10只, 肝癌模型组及SSd大、中、小剂量治疗组每组20只.
1.2.2 溶液的配制: 称取SSd 40、30、20 mg, 分别溶于DMSO 3 mL中, 静止10 min, 然后用生理盐水稀释至100 mL, 避光保存; 2 mg/L DEN溶液的配制: 500 mL生理盐水加1 mL DEN, 振荡混匀, 避光保存.
1.2.3 造模: 模型组与治疗组均给予2 mg/L DEN灌胃, 按体质量10 mg/kg给药, 每只1.5-2.0 mL/d, 每周5次, 至16 wk停药, 对照组给予等量生理盐水灌胃; 造模同时, 治疗组大鼠分别给以不同浓度SSd ip(按0.50 mL/100 g)干预, 每天1次, 共16 wk. 每天观察动物的精神状态、饮食状况及背毛等一般情况的变化, 每周称体质量1次, 记录1次进水量和进食量. 灌胃给药严格遵循操作规则及剂量要求, 减少由操作不当引起的动物死亡, 16 wk后麻醉处死动物.
1.2.4 大鼠外周血T淋巴细胞亚群测定: 取肝素抗凝全血100 μL置12 mm×75 mm专用试管中; 加10 μL特异性荧光双标抗体(Mouse anti Rat CD3FITC/CD4RPE, Mouse anti Rat CD3FITC/CD8RPE)与全血充分混匀; 25℃左右, 避光染色15-30 min; 加2 μL红细胞裂解液作用10 min; 1000 r/min, 离心5 min, 弃上清液; 加入500 μL PBS洗液重悬成单细胞悬液, 上流式细胞仪分析.
1.2.5 FICT和RPE的荧光强度检测: 全部数据用流式细胞仪和软件CELL QUEST进行荧光参数获取和分析. 在前散射和测散射的二维Dot-plot图中, 划出淋巴细胞区, 然后对淋巴细胞作FICT和RPE的荧光强度检测, 荧光Ⅰ(FL1)为FITC, 滤光片为480±10 nm带通, 荧光Ⅱ(FL2)为RPE, 滤光片为480±10 nm带通. 数据分析时, 在确定每次检测阳性细胞百分率之前, 根据lsotype的非特异性荧光强度设定界限, 以确定双阳性、双阴性和单阳性区.
统计学处理 采用SPSS13.0统计软件包进行统计分析, 显著性水平α≤0.05.
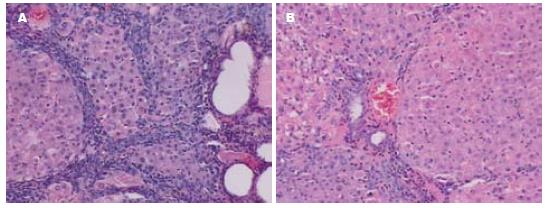
正常对照组大鼠肝脏表面光滑, 色淡红, 边缘锐利, 质地软. 随着诱癌过程的进行, 实验经历肝炎、肝硬化阶段进而形成肝癌. 实验结束时, 单纯造模组大鼠肝脏表面粗糙, 可见多个大小不一的灰白色癌结节, 最大者1.5 cm×1.0 cm×0.8 cm, 切面呈结节状, 可见出血和坏死, 癌周肝脏常伴有结节或肝硬化改变; 相反, SSd各治疗组癌结节数及灶的大小均小于对照组. 镜下观: 对照组大鼠肝小叶结构完整, 肝细胞索排列整齐, 细胞核清晰. 单纯造模组正常肝小叶结构被破坏, 大体观白色结节处为肝癌细胞, 瘤细胞呈多形性, 异形性明显, 胞核增大, 胞质少, 嗜碱性. 根据Edmondson分级法[5]多数属于Ⅲ级; 相反, SSd各干预组镜下癌细胞分化程度高, 异型性低, 分级多为Ⅰ-Ⅱ级(图1), 提示SSd能够抑制肝癌的形成与发展.
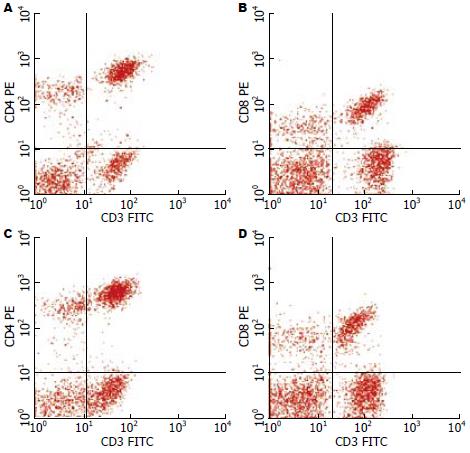
肝癌模型组与正常对照组T淋巴细胞亚群比较CD3+、CD4+、 CD4+/CD8+明显下降, CD8+上升, 差异有统计学意义(P<0.05); 而SSd各组与肝癌模型组T淋巴细胞亚群比较CD3+、CD4+、CD4+/CD8+明显回升, CD8+下降, 差异有统计学意义(P<0.05, 表1, 图2).
DEN具有很强的化学毒性, 所含的亚硝胺基因具有中毒剂和诱癌剂的双重效应[6], 并且其诱发的肿瘤多为HCC, 和人HCC比较相似. 我们每周5次给予SD大鼠2 mg/L DEN, 按体质量10 mg/kg给药, 诱癌16 wk后, 病理结果证实大鼠肝癌形成, 所诱发出的肝癌多数是结节型肝癌, 而人肝癌也是以结节型最为常见[7-8]. 因此, 通过间断小剂量DEN灌胃诱发肝肿瘤是一种经典的建立大鼠肝癌的模型.
造模同时, 我们给予SSd干预治疗, 发现SSd各治疗组大鼠饮食、精神、活动均比单纯造模组改善, 死亡率降低; 肉眼下SSd各治疗组癌结节数及灶的大小均小于对照组[3]. 镜下可见单纯造模组正常肝小叶结构破坏, 瘤细胞呈多形性, 异形性明显, 胞核增大, 胞质少, 嗜碱性. 根据Edmondson分级法[5]多数属于Ⅲ级; 相反, SSd各干预组镜下癌细胞分化程度高, 异型性较低, 分级多为Ⅰ-Ⅱ级, 提示SSd具有抵抗DEN对大鼠的毒性作用, 抑制肝癌的形成与发展.
肿瘤免疫的概念于1906年建立, 肿瘤细胞的抗原性已被证实, 宿主免疫功能状态在肿瘤的发生、发展过程中不断地相互影响, 双方各种因素的消长对病情发展变化和预后起重要的作用. 而细胞免疫是机体抗肿瘤免疫效应的主要机制, T淋巴细胞在细胞免疫中起主导作用, 外周血T淋巴细胞亚群是反映肿瘤患者免疫状态的最佳指标[9-12]. 他是机体免疫系统中最重要的一大细胞群, 通过各亚群间相互作用维持着机体正常的免疫应答, 肿瘤患者T淋巴细胞亚群数量异常与功能紊乱时常造成机体的免疫抑制, 当不同T淋巴细胞亚群数量、功能发生异常时将直接影响肿瘤的发生、发展及预后[13-15]. 研究证实, CD3+分布于成熟的T淋巴细胞表面, 根据细胞表面标志物的不同, 大部分成熟T细胞可划分为CD4+和CD8+细胞, CD3+ CD4+ T淋巴细胞能通过其免疫辅助作用增强和扩大机体的免疫应答, 相反, CD3+ CD8+ T淋巴细胞通过其细胞毒性作用抑制机体的免疫应答过程. 两种作用相反的T淋巴细胞借助相互拮抗, 调节机体的免疫应答. 通过CD3+ CD4+和CD3+ CD8+ T淋巴细胞亚群的检测可了解不同情况下机体的免疫功能状态, 对肿瘤的发生发展及免疫治疗具有重要的意义.
本实验采用DEN诱发大鼠肝癌模型, 探讨SSd对大鼠肝癌免疫功能的影响. 结果显示, 肝癌模型组与正常对照组T淋巴细胞亚群比较CD4+、 CD4+/CD8+明显下降, CD8+ T淋巴细胞上升, 差异有显著统计学意义(P<0.05), 造成T淋巴细胞功能障碍的原因目前尚不完全清楚, 推测与以下因素有关: (1)大鼠肝癌自身免疫缺陷, 使免疫系统自身调节机能发生障碍, 造成CD8+ T淋巴细胞升高; (2)肝癌细胞代谢产物(免疫抑制因子、AFP、细胞因子等)使活化的CD4+ T淋巴细胞祖细胞数量或增殖能力下降或诱导产生更多的CD8+ T淋巴细胞; (3)T淋巴细胞在肿瘤局部聚集可降低外周血T细胞(CD3+)水平或肿瘤代谢产物抑制了T细胞的活化. 这一实验结果提示肝癌大鼠免疫调节和监视功能减弱, 肿瘤细胞易于逃避免疫系统的清除, 最终诱发了肿瘤的无止境生长及复发、转移.
SSd是从传统中药柴胡中提取的有效单体成分, 具有显著的抗肿瘤及免疫调节作用, 被认为是一种生物反应调节剂. 越来越多的证据表明SSd通过激活巨噬细胞和淋巴细胞功能, 增强机体非特异性和特异性免疫反应, 从而起到免疫调节作用. SSd既可诱导Ts细胞活性, 又可激活Th细胞活性, 增强K、LAK、NK细胞的活性, 从而用于肿瘤的免疫治疗之中[16-18]. 本实验结果也显示, SSd各剂量组与肝癌模型组T淋巴细胞亚群比较CD4+、CD4+/CD8+明显回升, CD8+下降, 差异有统计学意义(P<0.05), 与文献报道一致. 进一步证实了SSd对大鼠肝癌的免疫功能有一定的改善作用, 具有一定的抑制大鼠肝癌形成的作用, 但其内在作用机制尚未完全阐明. 因此, SSd对大鼠肝癌免疫功能的内在调节机制有待进一步的研究.
肝癌术后复发和转移率极高, 目前尚无较好的治疗方法. 肿瘤细胞的抗原性已被证实, 提高宿主的免疫功能疗法在多种肿瘤的治疗中已显示出诱人的前景. 目前, 中药单体在抗肿瘤的治疗中具有一定的优势, 进一步探讨其在肿瘤宿主免疫功能中的作用具有重要的意义.
邰升, 副教授, 哈尔滨医科大学附属二院肝胆外科
柴胡皂甙D是从传统中药柴胡中提取的有效单体成分, 具有显著的抗炎、抗肿瘤作用. 本研究初步观察柴胡皂甙D对肝癌大鼠免疫功能的调节作用及对肝癌形成的影响.
Yang et al的研究发现, 肝癌周围可见CD4+ CD25+ T淋巴细胞数目增加, 其可抑制肿瘤中CD8+ T淋巴细胞活性, 与肿瘤的浸润、转移密切相关.
本研究提示柴胡皂甙D能够提高大鼠肝癌CD4+、CD4+/CD8+ T淋巴细胞亚群比例, 降低CD8+的数目, 具有显著的免疫保护及抗肿瘤作用, 为其临床应用提供理论依据.
提高宿主免疫功能是研究中药抗肝肿瘤治疗的一个重要内容, 本研究表明柴胡皂甙D能够提高宿主免疫功能达到抑制肝肿瘤生长, 诱导分化, 有望作为一种不良反应小的新的天然抗肝肿瘤药物投入临床应用, 具有良好应用前景.
柴胡皂甙D(SSd): 是从传统中药柴胡中提取的有效单体成分, 具有糖皮质激素(GC)样甾环结构, 能够抑制花生四烯酸等代谢产物的生成, 具有显著的抗炎、抗肿瘤作用.
本文立题新颖, 实验方法路线准确, 结果结论真实可靠, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Dang SS, Wang BF, Cheng YA, Song P, Liu ZG, Li ZF. Inhibitory effects of saikosaponin-d on CCl4-induced hepatic fibrogenesis in rats. World J Gastroenterol. 2007;13:557-563. [PubMed] |
| 3. | 王 宝峰, 程 延安, 王 西京, 刘 振国, 马 红兵, 白 明华, 党 双锁, 贾 晓黎. 柴胡皂甙D对实验性大鼠肝癌血管形成的抑制作用. 世界华人消化杂志. 2008;16:1273-1280. [DOI] |
| 4. | Fan J, Li X, Li P, Li N, Wang T, Shen H, Siow Y, Choy P, Gong Y. Saikosaponin-d attenuates the development of liver fibrosis by preventing hepatocyte injury. Biochem Cell Biol. 2007;85:189-195. [PubMed] [DOI] |
| 5. | Edmondson HA, Steiner PE. Primary carcinoma of the liver: a study of 100 cases among 48,900 necropsies. Cancer. 1954;7:462-503. [PubMed] [DOI] |
| 6. | Okubo H, Moriyama M, Tanaka N, Arakawa Y. Detection of serum and intrahepatic hepatocyte growth factor during DEN-induced carcinogenesis in the rat. Hepatol Res. 2002;24:385-394. [PubMed] [DOI] |
| 7. | Helmberger T, Hoffmann RT, Jakobs T, Leibecke T, Lubienski A, Reiser M. [Liver tumor ablation]. Radiologe. 2005;45:55-62. [PubMed] [DOI] |
| 8. | Okubo H, Takei Y, Serizawa N, Enomoto N, Ikejima K, Sato N. Orthotopic hepatocellular carcinoma model with a controlled and reproducible tumorigenicity. J Gastroenterol Hepatol. 2007;22:423-428. [PubMed] [DOI] |
| 9. | Hsu YL, Kuo PL, Lin CC. The proliferative inhibition and apoptotic mechanism of Saikosaponin D in human non-small cell lung cancer A549 cells. Life Sci. 2004;75:1231-1242. [PubMed] [DOI] |
| 10. | Fu J, Xu D, Liu Z, Shi M, Zhao P, Fu B, Zhang Z, Yang H, Zhang H, Zhou C. Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients. Gastroenterology. 2007;132:2328-2339. [PubMed] [DOI] |
| 11. | Marotta F, Vangieri B, Cecere A, Gattoni A. The pathogenesis of hepatocellular carcinoma is multifactorial event. Novel immunological treatment in prospect. Clin Ter. 2004;155:187-199. [PubMed] |
| 12. | Krüger C, Greten TF, Korangy F. Immune based therapies in cancer. Histol Histopathol. 2007;22:687-696. [PubMed] |
| 13. | Lotze MT, Finn OJ. Recent advances in cellular immunology: implications for immunity to cancer. Immunol Today. 1990;11:190-193. [PubMed] [DOI] |
| 14. | Lynch DH. The promise of 4-1BB (CD137)-mediated immunomodulation and the immunotherapy of cancer. Immunol Rev. 2008;222:277-286. [PubMed] [DOI] |
| 15. | Zhou J, Ding T, Pan W, Zhu LY, Li L, Zheng L. Increased intratumoral regulatory T cells are related to intratumoral macrophages and poor prognosis in hepatocellular carcinoma patients. Int J Cancer. 2009;125:1640-1648. [PubMed] [DOI] |
| 16. | Kato M, Pu MY, Isobe K, Iwamoto T, Nagase F, Lwin T, Zhang YH, Hattori T, Yanagita N, Nakashima I. Characterization of the immunoregulatory action of saikosaponin-d. Cell Immunol. 1994;159:15-25. [PubMed] [DOI] |
| 17. | He Y, Hu ZF, Li P, Xiao C, Chen YW, Li KM, Guo JZ, Pan L, Xiong JP. [Experimental study of saikosaponin-D (SSd) on lipid peroxidation of hepatic fibrosis on rat]. Zhongguo Zhongyao Zazhi. 2008;33:915-919. [PubMed] |
| 18. | Wong VK, Zhou H, Cheung SS, Li T, Liu L. Mechanistic study of saikosaponin-d (Ssd) on suppression of murine T lymphocyte activation. J Cell Biochem. 2009;107:303-315. [PubMed] [DOI] |