修回日期: 2009-07-28
接受日期: 2009-08-03
在线出版日期: 2009-08-18
目的: 探讨凋亡调控蛋白Bcl-2、Bax表达在大鼠非酒精性脂肪性肝病(NAFLD)中的作用.
方法: 采用高脂饮食建立大鼠NAFLD模型, 以正常饮食设立对照组. HE染色观察肝脏脂肪变、炎症活动和纤维化程度, 采用Western blot检测Bcl-2、Bax在肝脏组织中的表达.
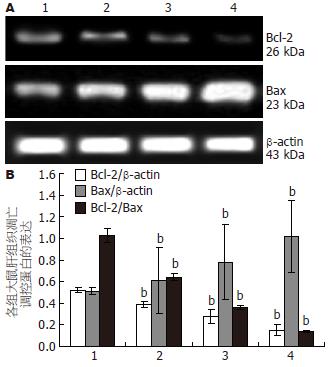
结果: 实验组大鼠4 wk可见轻度脂肪变, 8 wk呈单纯性脂肪肝改变, 至12 wk肝小叶内肝细胞弥漫性脂肪变, 伴大量炎性细胞浸润, 个别出现肝纤维化. Western blot结果显示, 实验组大鼠4、8、12 wk肝组织Bax蛋白表达显著高于对照组(0.61±0.03, 0.78±0.03, 1.02±0.03 vs 0.51±0.03, 均P<0.01), Bcl-2蛋白随着造模时间的延长, 表达逐渐下降(0.39±0.01, 0.28±0.01, 0.15±0.01 vs 0.52±0.01, 均P<0.01), Bcl-2、Bax两者比率逐渐降低, 尤以12 wk降低明显.
结论: 在NAFLD发生过程中, 细胞凋亡调节蛋白Bax表达上调, Bcl-2表达减少, 二者表达的相对比例发生异常. 这可能是NAFLD中肝细胞发生凋亡的重要原因之一.
引文著录: 赵和平, 解燕茹. Bcl-2、Bax蛋白表达在非酒精性脂肪性肝病中的作用. 世界华人消化杂志 2009; 17(23): 2409-2412
Revised: July 28, 2009
Accepted: August 3, 2009
Published online: August 18, 2009
AIM: To investigate the role of apoptosis-regulated proteins Bcl-2 and Bax in the progression of nonalcoholic fatty liver disease (NAFLD) in rats.
METHODS: An experimental rat model of NAFLD was established by feeding rats a fat-rich diet (NAFLD group). Control animals were fed a standard diet (control group). Hepatic steatosis, inflammation and fibrosis were graded by routine HE staining of liver sections. The expression levels of Bcl-2 and Bax proteins in the liver were determined by Western blot.
RESULTS: The NAFLD model rats exhibited mild steatosis at week 4, simple fatty liver at week 8, and severe steatohepatitis with fibrosis at week 12. Western blot analysis showed that hepatic expression of Bax protein in the NAFLD group was more pronounced from week 4, and continued to rise at weeks 8 and 12 when compared with the control group (0.61 ± 0.03, 0.78 ± 0.03 and 1.02 ± 0.03 vs 0.51 ± 0.03, respectively; all P < 0.01), while the expression of Bcl-2 decreased with the progression of fatty liver (0.39 ± 0.01, 0.28 ± 0.01 and 0.15 ± 0.01 vs 0.52 ± 0.01, respectively; all P < 0.01). Bcl-2/Bax ratio in the NAFLD group decreased in a time-dependent manner, particularly prominent at week 12.
CONCLUSION: NAFLD may cause increased hepatic expression of Bax but decreased expression of Bcl-2, and the decrease in Bcl-2/Bax ratio may accelerate hepatocyte apoptosis.
- Citation: Zhao HP, Xie YR. Expression of Bcl-2 and Bax in hepatocytes in nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2409-2412
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2409.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2409
目前在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的发病机制中, Day et al[1]提出的"二次打击"学说得到普遍公认. 然而近年来随着对凋亡的研究, 不断有证据表明在NAFLD中, 肝细胞凋亡可能是单纯非酒精性脂肪肝发展为非酒精性脂肪性肝炎"二次打击"理论的关键步骤, 也是该过程的重要标志[2], 与炎症程度和纤维化进展相关. 细胞凋亡受多种凋亡基因调控, 其中Bcl-2家族成员在细胞凋亡的基因调控过程中起着至关重要的作用[3], 尤其这一家族的两个代表性成员Bcl-2和Bax, 分别是凋亡抑制和促进因子, 两者的比率Bcl-2/Bax是调控细胞死亡的"可变电阻器"[4]. 本研究以高脂饮食构建非酒精性脂肪肝大鼠模型, 以探讨Bcl-2、Bax蛋白表达与NAFLD进展的关系.
健康♂清洁级Wistar大鼠40只, 体质量180-220 g, 购自河北医科大学. 鼠抗人Bcl-2、 Bax、β-actin mAb以及辣根过氧化物酶标记的兔抗鼠多克隆抗体购于Santa Cruz公司.
1.2.1 造模与采集标本: 正常喂养1 wk后, 按体质量层次随机分为正常对照组(10只)、实验组(30只). 正常组以普通饲料喂养, 实验组以85%普通饲料+13%猪油+2%胆固醇[5]喂养, 胆固醇购自成都科龙化工试剂厂. 实验动物自由进食和饮水, 于实验第4、8、12周末分别处死10只模型组大鼠, 正常组在实验第12周末处死, 留取血清和肝组织标本. 部分肝组织经40 g/L甲醛固定, 备做病理切片, 其余肝组织-70℃冰箱冻存, 以备蛋白提取.
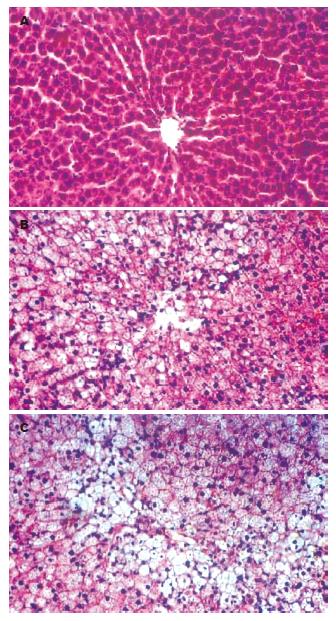
1.2.2 血清标本的检测和肝组织病理观察: 将采集的全血用低温离心机迅速分离血清, 以全自动生化分析仪(Olympus Au1000)测定血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆固醇(TC)、甘油三酯(TG). 光镜下观察肝组织学变化, 参照《非酒精性脂肪性肝病诊疗指南》[6]及2001年《病毒性肝炎防治方案》[7], 肝脂肪变分为4度(F0-4), 炎症活动度分为3级(G0-3), 肝纤维化分为4期(S0-4).
1.2.3 检测Bcl-2、Bax蛋白表达和激活水平: 从深低温冰箱中取出冻存的肝组织经RIPA液裂解后, 15 000 g离心10 min, 弃沉淀, 收集上清液用Bradford法测定总蛋白含量. 加样蛋白含量100 μg经10% SDS-PAGE电泳分离, 4℃条件下经3-4 h将蛋白电转移至硝酸纤维素膜, 置膜于含50 g/L脱脂奶粉中(TBST缓冲液稀释)封闭1 h, 分别加入特异性鼠抗人Bcl-2 、Bax mAb(1:500稀释)、鼠抗人β-actin mAb以及辣根过氧化物酶标记的兔抗鼠多克隆抗体(1:5000稀释)进行免疫反应, 以增强化学发光显色系统显色, 超敏胶片曝光, 以β-actin为内参照.
统计学处理 采用SPSS13.0软件进行分析, 计量资料用mean±SD表示, 采用方差分析和LSD-t检验, P<0.05为差异有统计学意义.
正常组大鼠血清ALT、AST、TC、TG均无异常, 肝组织学表现为肝小叶结构完整, 肝细胞呈多边形围绕中央静脉呈放射状分布, 大小一致. 与正常对照组相比, 模型组大鼠第4周起血清转氨酶(ALT、AST)血脂(TC、TG)开始增加(P<0.05), 肝组织显示散在肝细胞轻度脂肪变, 个别细胞内可见大泡性脂肪滴, 但肝小叶形态完整, 汇管区界限清楚, 无明显炎性细胞浸润, 无纤维化(F0, G0-1, S0); 随着造模时间的延长, 至实验第8、12周大鼠血清中转氨酶、血脂含量较正常对照组明显升高(P<0.05或0.01, 表1). 实验组8 wk大鼠肝组织病理均呈现单纯性脂肪肝, 肝脂肪变以大泡性为主, 肝腺泡3区病变最重, 肝小叶结构紊乱(F2, G2, S1); 至12 wk大鼠肝脏均见肝小叶内肝细胞弥漫性脂肪变, 大泡性与小泡性均存在, 大部分肝细胞肿胀, 胞质疏松呈气球样改变, 同时小叶内见局灶性肝细胞坏死, 有明显淋巴细胞浸润, 伴纤维化(F3-4, G3, S2)(图1).
正常对照组大鼠肝组织均表达一定量的Bcl-2(0.52±0.01)、Bax(0.51±0.03)蛋白, 且二者比值(1.03±0.06)保持平衡, 随着造模时间的延长, 实验组大鼠Bcl-2蛋白表达量较正常组逐渐减少(分别为0.39±0.01, 0.28±0.01, 0.15±0.01, P<0.01), Bax蛋白表达逐渐增多(分别为0.61±0.03, 0.78±0.03, 1.02±0.03, P<0.01), Bcl-2/Bax逐渐下降分别为(0.64±0.03, 0.36±0.02, 0.14±0.01), 尤以12 wk降低明显(P<0.01, 图2).
NAFLD已成为临床普遍关注的热点, 其所导致的肝组织损伤机制仍未明确. 近年来不断有研究发现: 肝细胞凋亡是连接肝损伤与炎症、纤维化的纽带, 与NAFLD的发生进展密切相关. 本实验采用高脂饮食成功诱导NAFLD大鼠模型, 表现为血清ALT、AST、TC、TG升高, 肝组织学上有肝细胞脂肪变、坏死、炎症细胞浸润或伴有肝纤维化, 且随着造模时间的延长肝损伤呈进行性加重.
细胞凋亡是指为维持内环境稳定, 由基因控制的机体正常细胞在受到生理和病理性刺激后出现的一种自发的死亡过程, 其中存在Fas/Fas-L介导的死亡受体通路[8-9]和Bcl-2家族调节的线粒体通路[10]. 近年来研究表明, Bcl-2家族成员的构成比例是上述两种凋亡通路的核心机制之一, 尤其这一家族的2个代表性成员Bax和Bcl-2, 是目前公认的哺乳动物细胞凋亡过程中的正、负调控剂. 正常情况Bax位于胞质, 在凋亡信号诱导下, 胞质内的Bax接到死亡信息其构象发生改变, 由胞质移位并插入到线粒体膜中, 并在此形成微孔结构的低聚物Bax-Bax同源二聚体, 开启线粒体通透性转换孔引起线粒体跨膜电位下降和细胞色素C的释放, 细胞色素C与凋亡蛋白活化因子-1(apoptosis protein-activating factor-1, Apaf-1)、dATP及caspase-9前体结合形成凋亡小体而发生凋亡[11-13]. 凋亡的肝细胞可招致炎症细胞聚集, 库普弗细胞吞噬凋亡小体而活化, 释放大量细胞因子, 如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α、白介素-1(interleukin-1, IL-1)和转化生长因子-β(transforming growth factor-β, TGF-β)等, 进一步激活肝星状细胞促进肝纤维化发生. 而Bcl-2存在于线粒体外膜, 其表达可竞争性地与Bax蛋白结合, 形成比Bax-Bax同源二聚体更稳定的Bax-Bcl-2异源二聚体, 从而"中和"Bax-Bax诱导凋亡的作用, 终止NAFLD中肝细胞凋亡的发生. Oltvai et al[14]认为, 决定细胞命运的关键因素是抑制与促进二者间的比率, Bcl-2、Bax分别是凋亡抑制和促进因子, 其比值与细胞凋亡的发生直接相关, 当Bax蛋白占优势时细胞凋亡, 反之, Bcl-2蛋白占优势时则细胞存活[15]. 因此有学者将Bcl-2和Bax的比值称作"凋亡开关"[16].
本实验通过Western Blot方法动态检测肝组织中Bax与Bcl-2蛋白表达, 发现Bax、Bcl-2作为线粒体凋亡途径的重要调节蛋白, 在正常对照组大鼠肝组织中两者均表达, 且二者比值保持平衡, 而实验组NAFLD大鼠肝组织中Bax的表达较正常组增加, 并随着脂肪性变程度加重表达逐渐增多, Bcl-2的表达则随着造模时间的延长逐渐减少, Bcl-2/Bax二者比值逐渐下降, 由此可推测Bcl-2、Bax比例失调可能是NAFLD中肝细胞损伤发生凋亡的重要原因之一[3], 提示上调Bcl-2蛋白的表达, 下调Bax蛋白, 增加Bcl-2/Bax二者的比值可能对阻止NAFLD的发生与进展具有重要意义.
目前在非酒精性脂肪性肝病(NAFLD)的发病机制中, Day et al提出的"二次打击"学说得到普遍公认. 然而随着对凋亡的研究, 不断有证据表明在NAFLD中, 肝细胞凋亡起着重要作用, 亦可能是NAFLD发生及进展的关键因素.
黄恒青, 主任医师, 福建省第二人民医院消化内科.
肝细胞凋亡及相关调节因素在NAFLD发病及其进展中的作用是目前NAFLD研究的热点之一.
目前Bcl-2家族在肿瘤领域研究较多, 其中2个代表性成员Bcl-2、Bax作为肿瘤临床预后标志物已得到肯定, 然而其在肿瘤以外领域, 尤其在NAFLD中研究不多.
本文通过研究细胞凋亡调控蛋白Bcl-2、Bax表达与NAFLD进展的关系, 以期对其发病机制有新的认识, 为进一步探讨抗凋亡治疗对延缓NAFLD发生及进展的作用奠定理论基础.
本研究方法合理, 结论科学, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 2. | Wieckowska A, Zein NN, Yerian LM, Lopez AR, McCullough AJ, Feldstein AE. In vivo assessment of liver cell apoptosis as a novel biomarker of disease severity in nonalcoholic fatty liver disease. Hepatology. 2006;44:27-33. [PubMed] [DOI] |
| 3. | Tsukahara S, Yamamoto S, Tin-Tin-Win-Shwe , Ahmed S, Kunugita N, Arashidani K, Fujimaki H. Inhalation of low-level formaldehyde increases the Bcl-2/Bax expression ratio in the hippocampus of immunologically sensitized mice. Neuroimmunomodulation. 2006;13:63-68. [PubMed] [DOI] |
| 4. | Korsmeyer SJ, Shutter JR, Veis DJ, Merry DE, Oltvai ZN. Bcl-2/Bax: a rheostat that regulates an anti-oxidant pathway and cell death. Semin Cancer Biol. 1993;4:327-332. [PubMed] [DOI] |
| 5. | 戴 林, 邓 彬, 白 成, 于 洪波, 李 爱萍. 吡格列酮对大鼠非酒精性脂肪性肝炎干预的实验研究. 胃肠病学和肝病学杂志. 2004;13:482-484. |
| 8. | Harper N, Hughes M, MacFarlane M, Cohen GM. Fas-associated death domain protein and caspase-8 are not recruited to the tumor necrosis factor receptor 1 signaling complex during tumor necrosis factor-induced apoptosis. J Biol Chem. 2003;278:25534-25541. [PubMed] [DOI] |
| 9. | Jaeschke H, Gores GJ, Cederbaum AI, Hinson JA, Pessayre D, Lemasters JJ. Mechanisms of hepatotoxicity. Toxicol Sci. 2002;65:166-176. [PubMed] [DOI] |
| 10. | Baskin-Bey ES, Gores GJ. Death by association: BH3 domain-only proteins and liver injury. Am J Physiol Gastrointest Liver Physiol. 2005;289:G987-90. [PubMed] [DOI] |
| 11. | Debatin KM. Chronic lymphocytic leukemia: keeping cell death at bay. Cell. 2007;129:853-855. [PubMed] [DOI] |
| 12. | Wong CK, Chen Z, So KL, Li D, Li P. Polycomb group protein RING1B is a direct substrate of Caspases-3 and -9. Biochim Biophys Acta. 2007;1773:844-852. [PubMed] |
| 13. | Bao Q, Lu W, Rabinowitz JD, Shi Y. Calcium blocks formation of apoptosome by preventing nucleotide exchange in Apaf-1. Mol Cell. 2007;25:181-192. [PubMed] [DOI] |
| 14. | Oltvai ZN, Milliman CL, Korsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell. 1993;74:609-619. [PubMed] [DOI] |
| 15. | Rogério F, Jordão H Jr, Vieira AS, Maria CC, Santos de Rezende AC, Pereira GA, Langone F. Bax and Bcl-2 expression and TUNEL labeling in lumbar enlargement of neonatal rats after sciatic axotomy and melatonin treatment. Brain Res. 2006;1112:80-90. [PubMed] [DOI] |
| 16. | Higuchi M, Aggarwal BB, Yeh ET. Activation of CPP32-like protease in tumor necrosis factor-induced apoptosis is dependent on mitochondrial function. J Clin Invest. 1997;99:1751-1758. [PubMed] [DOI] |