修回日期: 2009-06-22
接受日期: 2009-06-29
在线出版日期: 2009-08-18
目的: 研究游离脂肪酸(FFA)慢性升高对肝脏胰岛素抵抗的影响, 探讨氧化应激在其中的作用.
方法: 给Wistar大鼠分别静脉输注脂肪乳加肝素(IH组)和单纯输注生理盐水(SAL组)48 h, 在输注的最后2 h, 清醒状态下行高胰岛素-正血糖钳夹试验, 观察延时输注脂肪乳导致的高FFA对葡萄糖利用率(葡萄糖输注率, GIR)的影响, 并取肝组织测定羰基蛋白、肝细胞膜和细胞质PKC-δ的含量.
结果: 在高胰岛素-正血糖钳夹状态, IH输注组与SAL组比较, 血清FFA增加4.3倍(P<0.001), 羰基蛋白增加3.2倍, GIR下降58.6%(均P<0.001); 48 h的IH输注使肝细胞膜的PKC-δ/胞质PKC-δ比值增加4.0倍(P<0.001).
结论: FFA慢性升高导致了肝脏GIR下降, 葡萄糖的利用障碍, 肝脏的PKC-δ向细胞膜转位增加, 说明在慢性高FFA导致的肝脏胰岛素抵抗中, 氧化应激反应起了重要的作用.
引文著录: 卢雁, 韩萍, 赵晟, 张咏言, 何冰, 张微. 游离脂肪酸对肝脏氧化应激及胰岛素抵抗的影响. 世界华人消化杂志 2009; 17(23): 2405-2408
Revised: June 22, 2009
Accepted: June 29, 2009
Published online: August 18, 2009
AIM: To investigate the effects of long-term elevation of free fatty acids (FFA) on hepatic insulin resistance and hepatic oxidative stress.
METHODS: A total of 32 Wistar rats were divided into two groups and given an intravenous infusion of intralipid plus heparin (IH) and saline (SAL), respectively. Two hours before the end of the infusion, a hyperinsulinemic-euglycemic clamp was performed to examine the ability of FFA to induce hepatic insulin resistance. After the clamp, liver tissue samples were taken to determine the protein carbonyl content by DNPH (2,4-dinitrophenylhydrazine) colorimetry and the content of protein kinase C-δ by Western blot.
RESULTS: Compared to SAL infusion, IH infusion resulted in an increase in plasma FFA level by 4.3 folds (P < 0.001), hepatic protein carbonyl content by 3.2 folds, and the membrane/cytosol ratio of PKC-δ by 4.0 folds (P < 0.001).
CONCLUSION: Long-term elevation of FFA induces elevation of hepatic protein carbonyl content, PKC-δ translocation and insulin resistance, suggesting that PKC-δ plays an important role in FFA-induced hepatic insulin resistance.
- Citation: Lu Y, Han P, Zhao S, Zhang YY, He B, Zhang W. Effects of free fatty acid elevation on hepatic insulin resistance and hepatic oxidative stress. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2405-2408
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2405.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2405
肝脏胰岛素抵抗(insulin resistance, IR)在2型糖尿病的发生、发展过程中占重要地位. 大量研究显示, 游离脂肪酸(free fatty acid, FFA)与IR互为因果, 互相促进. Karlsson et al研究发现高脂饮食后, 使葡萄糖转运子-4(glucose transporter-4, GluT-4)向质膜转运受阻, 影响外周葡萄糖利用, 导致胰岛素抵抗[1-2]; 另外FFA还可影响脂肪细胞分泌的细胞因子如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等的表达, 抑制外周组织摄取葡萄糖, 使肝糖产生增加导致IR[3-4]. 韩萍 et al[5-6]为大鼠输注脂肪乳7 h, 发现短时间输注脂肪乳造成FFA升高, 已经导致了IR. 然而, 对于延时输注多不饱和脂肪酸, FFA慢性升高对胰岛素作用和葡萄糖调节影响的研究还很少, 因此本研究旨在研究48 h FFA持续升高对活体胰岛素作用的影响及脂毒性导致IR的发病机制.
健康Wistar大鼠, ♂, 体质量250-300 g, 在中国医科大学附属盛京医院动物室喂养. 接受12 h光照/黑暗周期, 随意进基础饲料及饮水. 德国Neker公司BIOSEN 5030快速生化血糖检测仪测定血糖; 胰岛素放免试剂盒购自解放军总院科技开发中心; FFA试剂盒购自南京建成生物工程研究所; 南京凯基生物科技发展有限公司提供肝细胞膜蛋白和胞质蛋白提取试剂盒; PKC-δ特异性pAb购自Santa Cruz Biotechnology, INC.
1.2.1 造模: 大鼠适应实验室环境3-5 d后, 用100 g/L水合氯醛腹腔麻醉, 聚乙烯导管2根, 每根一端接有一段3 cm长的硅胶管(内径0.05 cm)分别置入右颈内静脉至右心房水平用于输液和左颈动脉至主动脉弓水平用于采血, 导管均经皮下从颈背部引出, 然后将导管内充入600 g/L聚乙烯吡咯烷酮(PVP)和肝素(1000 kU/L), 保持导管通畅. 大鼠术后恢复3-4 d进行实验.
1.2.2 分组及给药: 大鼠隔夜禁食12 h, 以随机数字表法分为2组, 每组16只. A组(IH组)脂肪乳(200 g/L)+肝素(20 kU/L)5.5 μL/min), 肝素为脂蛋白脂酶的刺激物, 他能使脂肪酸从脂肪乳中释放出来; B组(SAL组)生理盐水5 μL/min. 每组再随机分为基础状态亚组和高胰岛素-正血糖钳夹亚组, 各8只. 均输注相应液体48 h, 其中后12 h禁食. 在钳夹亚组, 经颈静脉导管给大鼠输注IH或SAL 48 h, 但在输液的最后2 h行钳夹试验, 以5 mU/(kg•min)速度输注胰岛素同时输注11.1 mmol/L葡萄糖, 每5 min测血糖1次, 以调整输液速度将血糖浓度维持在5 mmol/L左右; 基础状态亚组仅输注IH或SAL 48 h, 不行钳夹试验.
1.2.3 采血: 所有实验组在输注液体的最后30 min, 每10 min采血1次备测葡萄糖、胰岛素、FFA. 整个实验每只大鼠基础状态组采血量约3.7 mL, 钳夹试验组约4.5 mL. 分离血清备检, 然后将红细胞用肝素盐水按1:1稀释后回输, 保证红细胞压积维持在正常范围.
1.2.4 指标检测: 葡萄糖氧化酶法测定血糖; 放射免疫法测定胰岛素; 比色法测定血清FFA; DNPH比色法测定肝脏羰基蛋白含量[7-8]; Western blot方法检测肝细胞膜和细胞质的蛋白激酶C-δ(protein kinase C-δ, PKC-δ)表达, PKC-δ特异性pAb, 浓度为1:1000, 胶片显影, 用激光扫描仪测定免疫印记法获得的条带密度.
统计学处理 所有数值用mean±SD表示, 对于基础亚组和钳夹亚组的重复数据采用t检验比较两组差别, 多组资料间比较采用单向方差分析, 应用SPSS12.0软件进行的数据统计, P<0.05表示有统计学意义.
基础状态IH组的FFA、胰岛素较SAL组增加了1.83倍和1.40倍, 葡萄糖水平升高了0.85 mmol/L; 钳夹状态下IH组较SAL组的血清FFA增高4.3倍(P<0.001), 2组血糖均稳定在5.1 mmol/L左右(表1).
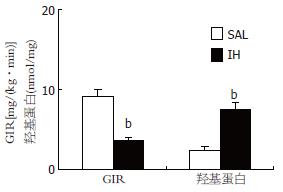
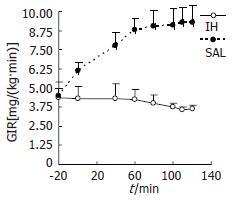
IH亚组的GIR为3.65±0.41 mg/(kg•min), SAL亚组的GIR为9.3±1.09 mg/(kg•min), 明显高于IH组(P<0.001, 图1), 2组高胰岛素-正血糖钳夹试验各时间点的GIR见图2.
测定每毫克肝脏蛋白中羰基含量, IH组为7.56±0.82 nmol, SAL组为2.36±0.54 nmol(P<0.001), 升高了3.2倍(图1).
SAL组和IH组大鼠肝脏细胞膜与细胞质PKC-δ值分别为55.12±2.37, 49.37±1.96; 99.48±4.52, 21.64±0.83; 盐水组与脂肪乳组肝脏胞膜PKC-δ/胞质PKC-δ比值分别为1.12, 4.60(P<0.001, 图3).
3 讨论
肥胖患者, 尤其是腹型肥胖, 存在着脂肪分解活跃, 脂肪细胞的FFA释放入血增多, 导致高FFA血症[9], 甘油三脂转运障碍, 过多的FFA可通过多种途径导致IR的发生. 肝脏是调节血糖的重要器官, 脂肪在肝细胞沉积, 肝脏对脂肪酸的β-氧化能力下降, 极低密度脂蛋白合成分泌减少, 以及高FFA使胞质内长链脂肪酸辅酶A(lithocholic acid-coenzyme A, LCA -CoA)水平升高, 升高的LCA-CoA使丙二酰CoA对肉毒碱脂酰转移酶-1(carnitine palmitoyltransferase-1, CPT-1)的抑制作用减弱, 肝内FFA的氧化作用增强, 糖异生酶活性升高, 引起肝糖异生和肝糖输出增加[10]. 高脂饮食制作的IR动物模型, 由于在长期高脂喂养过程中大鼠代偿性增加胃肠激素如抑胃肽[11]等因素, 难以保证实验动物的血脂浓度, 影响高脂所致的胰岛素抵抗模型的稳定性. 本实验模型是直接静脉输注脂肪乳, 导致内源性FFA升高, 同时保证稳定的FFA浓度, 比较直接的观察FFA对胰岛素作用的影响. 既往的研究证明FFA对葡萄糖的抑制作用呈现时间[12]和浓度[13]依赖性, 7 h输注脂肪乳造成急性脂毒性, 而48 h输注脂肪乳则更好的模拟了长期内源性、慢性脂毒性对IR的影响.
本实验研究结果表明, 48 h输注脂肪乳显著地增加了FFA水平, 同时循环胰岛素水平也升高, 说明FFA增加了内源胰岛素的分泌, 钳夹状态的血清FFA水平低于其基础状态水平, 可能是由于高浓度胰岛素输注抑制了FFA从脂肪组织中释放, 并增加了FFA脂化的缘故. 两组钳夹亚组的血清葡萄糖维持在相对恒定水平, 说明高胰岛素-正血糖试验成功, IH组的GIR低于SAL组, 说明48 h输注脂肪乳造成了IR. 而且其降低程度要高于我们以往7 h输注脂肪乳的动物模型[5], 说明长时间的高FFA血症可导致更严重的胰岛素抵抗.
本实验结果发现肝脏羰基蛋白含量在IH输注组显著高于SAL输注组, 而羰基蛋白的增高是氧化应激增强的标志[14], 因此证明高FFA导致了肝脏组织的氧化应激增强. 许多研究显示FFA可以激活尼克酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate, NADPH), 从而产生大量活性氧簇(reactive oxygen species, ROS)导致IR[15], 而PKC同工酶的激活又反过来促发了FFA诱导的IR. PKC-δ的激活表现为从胞质到胞膜的转位[16], 激活的PKC-δ可以使胰岛素受体和胰岛素受体底物-1(insulin receptor substrate 1, IRS-1)进行Ser/Thr磷酸化, 使胰岛素受体和IRS-1的酪氨酸磷酸化降低, 导致葡萄糖摄取或糖原合成下降, 使胰岛素作用障碍, 而致胰岛素抵抗[17]. 本实验结果显示48 h的脂肪乳输注诱发了PKC-δ从肝脏细胞质到细胞膜的转位, 说明慢性脂毒性诱发了氧化应激, 肝脏IR与PKC-δ转位有关.
总之, 本实验证实: 48 h输注脂肪乳造成的慢性FFA升高, 可引起IR, PKC-δ的激活与肝脏胰岛素抵抗相关. 推测采取降低PKC-δ水平的治疗手段, 可用于防治FFA造成的氧化损伤及IR[12].
糖尿病已经成为世界上继肿瘤、心脑血管病之后第3位严重危害人类健康的慢性疾病. 我国已成为糖尿病发病的"重灾区", 目前国内有糖尿病患者近5000万, 是全球糖尿病第2大国. 深入了解糖尿病发病机制, 对其进行防治, 意义重大.
洪天配, 教授, 北京大学第三医院内分泌科.
胰岛素抵抗和胰岛β细胞功能缺陷为2型糖尿病发病的基本病理生理机制. 近年来炎症反应及氧化应激在导致胰岛素抵抗和胰岛β细胞功能缺陷方面的作用成为研究热点.
Delarue et al发现血浆游离脂肪酸的升高, 使脂质异位沉积, 造成肌肉、肝脏、脂肪的胰岛素抵抗, 现在普遍认为脂质代谢紊乱和血浆游离脂肪酸水平的长期提高是2型糖尿病发展中最早出现的事件和中心环节.
此研究直接静脉输注脂肪乳48 h, 导致内源性FFA慢性升高, 同时保证稳定的游离脂肪酸浓度, 比较直接的观察FFA对胰岛素作用的影响; 另外发现慢性脂毒性诱发了氧化应激, 肝脏的胰岛素抵抗与PKC-δ转位有关.
本研究提示48 h输注脂肪乳诱发了氧化应激, 造成的肝脏胰岛素抵抗与PKC-δ转位有关, 因此推测采取降低PKC-δ水平的治疗手段, 可用于防治FFA造成的氧化损伤及胰岛素抵抗.
胰岛素抵抗: 体内周围组织对胰岛素的敏感性降低, 组织对胰岛素不敏感, 肝脏、肌肉、脂肪对胰岛素促进葡萄糖摄取的作用发生了抵抗.
本研究选题较好, 设计合理, 结果可信, 具有较好的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Karlsson HK, Chibalin AV, Koistinen HA, Yang J, Koumanov F, Wallberg-Henriksson H, Zierath JR, Holman GD. Kinetics of GLUT4 trafficking in rat and human skeletal muscle. Diabetes. 2009;58:847-854. [PubMed] [DOI] |
| 2. | Agati JM, Yeagley D, Quinn PG. Assessment of the roles of mitogen-activated protein kinase, phosphatidylinositol 3-kinase, protein kinase B, and protein kinase C in insulin inhibition of cAMP-induced phosphoenolpyruvate carboxykinase gene transcription. J Biol Chem. 1998;273:18751-18759. [PubMed] [DOI] |
| 3. | Rashid S, Watanabe T, Sakaue T, Lewis GF. Mechanisms of HDL lowering in insulin resistant, hypertriglyceridemic states: the combined effect of HDL triglyceride enrichment and elevated hepatic lipase activity. Clin Biochem. 2003;36:421-429. [PubMed] [DOI] |
| 6. | Park E, Wong V, Guan X, Oprescu AI, Giacca A. Salicylate prevents hepatic insulin resistance caused by short-term elevation of free fatty acids in vivo. J Endocrinol. 2007;195:323-331. [PubMed] [DOI] |
| 7. | Levine RL, Garland D, Oliver CN, Amici A, Climent I, Lenz AG, Ahn BW, Shaltiel S, Stadtman ER. Determination of carbonyl content in oxidatively modified proteins. Methods Enzymol. 1990;186:464-478. [PubMed] [DOI] |
| 9. | Yoshii H, Lam TK, Gupta N, Goh T, Haber CA, Uchino H, Kim TT, Chong VZ, Shah K, Fantus IG. Effects of portal free fatty acid elevation on insulin clearance and hepatic glucose flux. Am J Physiol Endocrinol Metab. 2006;290:E1089-E1097. [PubMed] [DOI] |
| 10. | Lam TK, Yoshii H, Haber CA, Bogdanovic E, Lam L, Fantus IG, Giacca A. Free fatty acid-induced hepatic insulin resistance: a potential role for protein kinase C-delta. Am J Physiol Endocrinol Metab. 2002;283:E682-E691. [PubMed] |
| 11. | Getty-Kaushik L, Song DH, Boylan MO, Corkey BE, Wolfe MM. Glucose-dependent insulinotropic polypeptide modulates adipocyte lipolysis and reesterification. Obesity (Silver Spring). 2006;14:1124-1131. [PubMed] [DOI] |
| 12. | Maffeis C, Manfredi R, Trombetta M, Sordelli S, Storti M, Benuzzi T, Bonadonna RC. Insulin sensitivity is correlated with subcutaneous but not visceral body fat in overweight and obese prepubertal children. J Clin Endocrinol Metab. 2008;93:2122-2128. [PubMed] [DOI] |
| 13. | Qin S, Li L, Yang GY, Li RZ, Li K, Qi XY, Li SB, Chen WW, Liu H, Tang Y. [Effects of visfatin gene overexpression on insulin sensitivity in the insulin-resistant rats induced by high-fat diet]. Zhonghua Yixue Zazhi. 2008;88:365-368. [PubMed] |
| 14. | Wang Q, Zhao X, He S, Liu Y, An M, Ji J. Differential Proteomics Analysis of Specific Carbonylated Proteins in the Temporal Cortex of Aged Rats: The Deterioration of Antioxidant System. Neurochem Res. 2009; Jun 28 [Epub ahead of print]. [PubMed] |
| 15. | Lamb RE, Goldstein BJ. Modulating an oxidative-inflammatory cascade: potential new treatment strategy for improving glucose metabolism, insulin resistance, and vascular function. Int J Clin Pract. 2008;62:1087-1095. [PubMed] [DOI] |
| 16. | Tapia JA, García-Marin LJ, Jensen RT. Cholecystokinin-stimulated protein kinase C-delta kinase activation, tyrosine phosphorylation, and translocation are mediated by Src tyrosine kinases in pancreatic acinar cells. J Biol Chem. 2003;278:35220-35230. [PubMed] [DOI] |