修回日期: 2009-06-22
接受日期: 2009-06-29
在线出版日期: 2009-08-18
目的: 探讨乙型肝炎病毒(hepatitis B virus, HBV)S基因的反义锁核酸(LNA)对乙型肝炎转基因小鼠HBV复制和表达的影响.
方法: 将30只HBV转基因小鼠随机分为5组, 每组6只. 第1组为5% GLU液对照组, 第2组为空脂质体对照组, 第3组为单LNA组, 第4组为S-ASODN脂质体组, 第5组LNA脂质体组. 反义LNA经尾静脉注入小鼠体内, 采用ELISA法检测血清HBsAg; PCR定量检测血清HBV DNA含量; 免疫组织化学法检测肝细胞HBsAg的表达; 自动生化分析仪检测ALB、ALT、BUN、CR、ApoA1、ApoB等指标; 小鼠肝脏、肾脏做常规病理切片HE染色, 观察反义LNA对小鼠脏器的影响.
结果: 注射反义LNA 1 d、3 d、7 d、14 d后, LNA-脂质体组对血清HBsAg的表达抑制率分别为41.7%、52.8%、57.8%及30.5%. 对HBV DNA的抑制率分别为18.5%、36.1%、52.9%和32.7%, 与对照组比较均有显著性差异(P<0.05);全自动生化分析仪检测血清中ALB、ALT、BUN、CR、ApoA1、ApoB等指标, 各组结果与对照组比较均无显著性差异(P>0.05); 小鼠肝细胞HBsAg的表达显著低于对照组. HE染色显示小鼠肝肾功能及组织学未见异常.
结论: HBV S基因反义LNA对乙型肝炎病毒转基因鼠HBV复制和表达有显著抑制作用.
引文著录: 邓益斌, 农乐根, 王燕菲. HBV S基因的反义锁核酸对乙型肝炎转基因小鼠HBV复制和表达的影响. 世界华人消化杂志 2009; 17(23): 2338-2345
Revised: June 22, 2009
Accepted: June 29, 2009
Published online: August 18, 2009
AIM: To investigate the inhibitory effects of hepatitis B virus (HBV) S gene-specific antisense locked nucleic acid (LNA) on HBV replication and expression.
METHODS: Thirty HBV transgenic mice were randomly divided into five groups (n = 6): glucose (5% GLU solution) control group, empty liposome control group, LNA group, S-ASODN-liposome group and LNA-liposome group. Antisense LNA was injected into mice via the tail vein. Serum HBsAg was quantified by ELISA. Serum HBV DNA was quantified by PCR. The expression of HBsAg in the liver was detected by immunohistochemistry. Serum ALB, ALT, BUN, CR, ApoA1 and ApoB were measured using an automatic biochemical analyzer. The effects of antisense LNA on mouse organs were investigated by HE staining of mouse liver and kidney sections.
RESULTS: On days 1, 3, 7 and 14 after LNA injection, serum HBsAg levels in the LNA-liposome group were reduced by 41.7%, 52.8%, 57.8% and 30.5%, respectively, while serum HBV DNA expression levels were decreased by 18.5%, 36.1%, 52.9% and 32.7%, respectively. These values were significantly higher than those in the control groups (all P < 0.05). No significant differences were noted in serum ALB, ALT, BUN, CR, ApoA1 and ApoB between the experiment group and the control groups (all P > 0.05). The expression level of HBsAg in the liver in the LNA-liposome group was significantly lower than those in the control groups. No significant histological abnormalities were found in the liver in all groups.
CONCLUSION: HBV S gene-specific antisense LNA can significantly inhibit the replication and expression of HBV.
- Citation: Deng YB, Nong LG, Wang YF. HBV S gene-specific antisense locked nucleic acid significantly inhibits HBV replication and expression in HBV transgenic mice. Shijie Huaren Xiaohua Zazhi 2009; 17(23): 2338-2345
- URL: https://www.wjgnet.com/1009-3079/full/v17/i23/2338.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i23.2338
慢性乙型肝炎是乙型肝炎病毒(hepatitis B virus, HBV)感染引起的一种死亡率较高的慢性传染性疾病, 易发展为肝硬化、肝癌, 已成为全球性健康问题, 全球约有3.5亿慢性乙型肝炎患者, 而我国的慢性乙肝患者约占37.14%(约1.3亿)[1-5]. 目前临床治疗药物主要是干扰素[6-9]和拉米夫啶[10-12], 干扰素远期疗效不理想, 而拉米夫啶长期使用易引起基因变异, 导致耐药. 因此, 探索对HBV感染者有效的抗病毒药物(方法)在我国意义尤显重大. 反义寡聚脱氧核苷酸(antisense oligodeoxynucleotide, ASODN)是应用较为广泛的一种基因治疗新技术(即反义DNA技术), 其抗HBV感染的机制是通过反义DNA与细胞内特定的mRNA互补结合形成杂交双链分子, 从而在分子水平上阻断HBV基因的表达[13-15]. 反义锁核酸(locked nucleic acid, LNA)是建立在反义DNA基础上的更新的一种基因疗法, 具有更强的核酸分子杂交能力和抗核酸酶降解能力[16-24], 国外已开始用于抗人类免疫缺陷病毒(human immune deficiency virus, HIV)[25]和丙型肝炎病毒(hepatitis C virus, HCV)[26]等RNA病毒的基因治疗研究, 而用于抗HBV感染方面的治疗研究尚未见有报道. 我们前阶段进行的体外研究表明, 反义LNA抗HBV基因复制和表达的能力比硫代修饰的ASODN强[27]. 因此, 我们设计合成互补于HBV mRNA S基因翻译起始区的反义LNA, 利用阳离子脂质体的组织靶向性, 经尾静脉将反义LNA导入肝细胞内, 进一步观察反义LNA在HBV转基因鼠体内的抗病毒效果.
HBV转基因小鼠30只(平均体质量25 g), 雌雄各半, 血清乙肝表面抗原(hepatitis B surface antigen, HBsAg)(+), HBV DNA(+), 购自中国人民解放军广州军区空军医院; LipofectamineTM2000购自Invitrogen公司; 乙型肝炎表面抗原(HBsAg)检测试剂盒为深圳丽珠生物技术有限公司产品; HBV DNA定量检测试剂盒为广州中山达安基因股份有限公司产品; 鼠抗-HBs第一抗体为武汉博士德公司产品; PV-6002二步法免疫组织化学检测试剂盒为北京中杉金桥生物技术有限公司产品; ALB、ALT、BUN、肌酐(CR)、载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB)检测试剂盒为上海荣盛生物技术有限公司产品; 酶标仪(德国); Real Time PCR仪(美国); 日立7150型全自动生化分析仪(日本).
1.2.1 质量控制: (1)样品质控: 尾静脉注射和眶静脉采血后, 做好消毒, 避免感染; 采血及血清分离过程中, 避免溶血, 影响血液指标的检测结果. (2)试剂质控: 所使用的试剂盒均有国准字号, 并在有效期内使用; 各试剂的空白吸光度值在不同温度下(4、25、37℃)下的变异系数CV%均小于5%; 各试剂所配制而成的工作液, 1 wk内的空白吸光度值的日间、日内变异系数CV%均小于5%; 认为所用的试剂盒的稳定性较好, 符合质量控制要求. (3)仪器质控: 酶标仪、生化自动分析仪、PCR仪均定期维护, 各项性能指标均符合实验要求; 每个项目检测前, 均用定值质控血清做高、中、低值质控, 且均在控.
1.2.2 反义LNA的合成与修饰: 合成互补于HBV(ayw亚型)mRNA S基因翻译起始区157-167 nt的S片段(5'-TaCcTctTgTa-3', 其中大写字母代表LNA, 小写字母代表DNA). 由美国Genelink公司合成修饰并纯化.
1.2.3 脂质体包裹LNA的制备: 脂质体与5% GLU液按2:3比例混匀后, 迅速加入等体积的LNA(200 mg/L)溶液, 充分混匀, 室温下静置1 h后应用, 即为脂质体-LNA混合物.
1.2.4 转基因鼠的处理: 将30只HBV转基因小鼠随机分为5组, 每组6只. 第1组为5% GLU液对照组, 第2组为空脂质体对照组, 第3组为单LNA组, 第4组为S-ASODN脂质体组, 第5组为LNA脂质体组. 分别在1, 3, 5 d经尾静脉给每只小鼠注射相应的脂质体-LNA(或S-ASODN)混合物300 μL, 空白对照注射等量5% GLU液(或空脂质体). 于注射前, 注射后第1, 3, 7, 14天经眶静脉采血, 5000 r/min离心5 min, 吸上层血清于编好号的无菌EP管中, 贮存于-20℃备检, 并于注射后第14天处死小鼠, 取肝、肾脏40 g/L甲醛固定.
1.2.5 血清HBsAg的检测: 利用酶联免疫吸附技术(ELISA)检测, 具体方法见试剂盒说明书, HBsAg浓度以A值表示.
1.2.6 HBV DNA的检测: 采用荧光定量聚合酶链反应(PCR)法检测. 在PCR反应管中加入反应液和样本DNA共25 μL, 各反应管放入荧光定量PCR仪, 扩增条件: 37℃保温2 min, 94℃预变性3 min, 94℃ 5 s, 60℃ 40 s, 共40个循环. 由计算机软件自动分析所收集的荧光信号并计算出定量结果, 采用计算对数平均值的方法计算HBV DNA平均拷贝数.
1.2.7 肝、肾功能检测: ALB为溴甲酚绿法; ALT为IFCC速率法; BUN为脲酶连续监测法; CR为苦味酸法. 以上指标均由自动生化分析仪检测.
1.2.8 血清载脂蛋白A、B检测: ApoA1、ApoB均为免疫比浊法, 由自动生化分析仪检测.
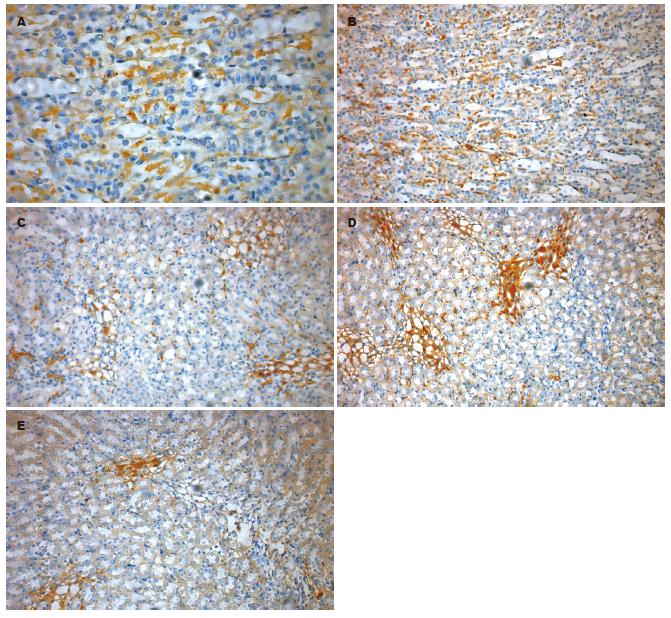
1.2.9 肝组织HBsAg检测: 肝组织常规石蜡包埋、切片, 采用二步法免疫组织化学法检测, 并进行DAB染色, 苏木素复染, 鼠抗-HBs以1:100稀释, 具体方法见说明书. 电子显微镜观察肝组织中HBsAg的着色情况, 以判断LNA的抑制作用.
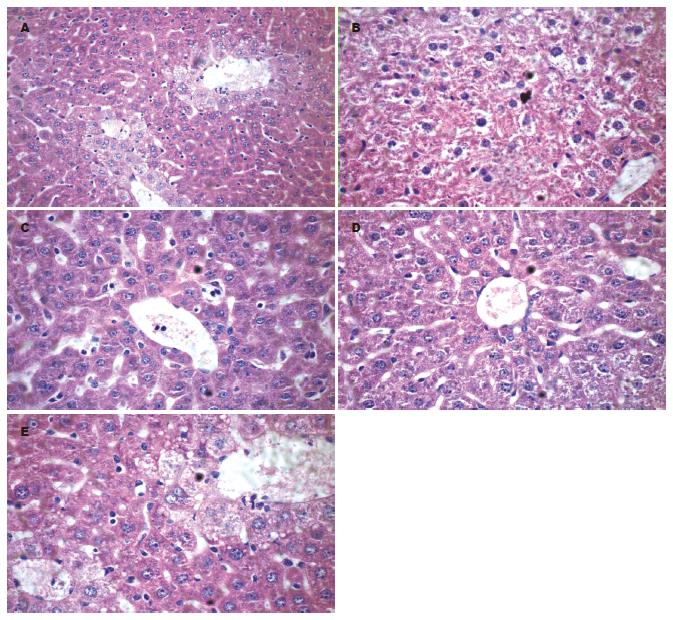
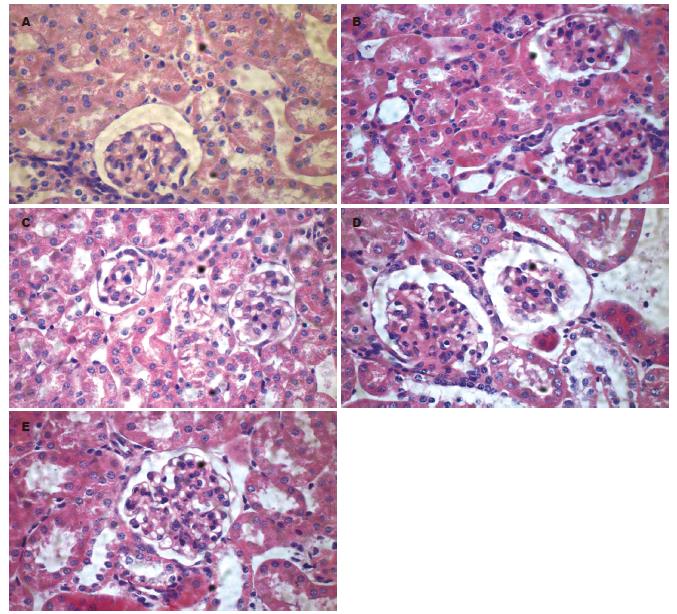
1.2.10 肝、肾脏组织病理检测: 小鼠的肝脏、肾脏经石蜡包埋、切片后, 经苏木素、伊红染色, 电子显微镜下观察小鼠各脏器细胞、组织结构有无改变, 以判断脂质体对小鼠脏器细胞的损伤作用.
统计学处理 所有结果用mean±SD表示, 应用SPSS12.0统计软件处理数据, 采用单因素方差分析方法比较各组间差异, P<0.05为差异具有显著性意义. 抑制率(%) = (用药前N-用药后N)/用药前N×100%.
注射后第1、3、7、14天, S-ASODN脂质体组对HBsAg的抑制率分别为20.3%、31.5%、37.1%和24.1%; LNA-脂质体组的抑制率分别为41.7%、52.8%、57.8%和30.5%. 这2组与对照组比较均有显著性差异(P<0.05). 表明LNA在动物体内对HBsAg的抑制作用随用药时间而增强, 且有一个峰值. 同时也表明LNA比S-ASODN的抑制作用要强(表1).
通过定量PCR检测血清HBV DNA, 发现LNA对HBV DNA有较明显的抑制作用. LNA脂质体组的DNA抑制率分别为18.5%、36.1%、52.9%和32.7%; S-ASODN脂质体组分别为8.5%、12.6%、26.5%、20.8%; 与对照组比较均有显著性差异(P<0.05, 表2).
| A组(n = 6) | B组(n = 13) | C组(n = 13) | |
| 门静脉血管内径(mm) | |||
| 0.5 h | -0.900±1.594 | 0.623±0.803 | 0.077±0.894 |
| 1 h | 0.100±0.415 | 0.369±1.259 | 0.069±0.988 |
| 2 h | 0.067±0.476 | 0.139±1.161 | -0.339±0.737 |
| 门静脉截面积(mm2) | |||
| 0.5 h | 0.170±1.626 | 2.953±4.995 | 0.781±2.573 |
| 1 h | 0.449±1.841 | 2.946±6.006 | 0.520±2.739 |
| 2 h | 0.653±1.577 | 1.424±4.395 | -1.183±1.069 |
| 门静脉平均血流速率(m/s) | |||
| 0.5 h | -0.013±0.025 | -0.003±0.026 | -0.090±0.037 |
| 1 h | -0.015±0.031 | -0.014±0.030 | -0.112±0.032 |
| 2 h | -0.000±0.020 | -0.006±0.031 | -0.112±0.047 |
| 门静脉血流量(mL/min) | |||
| 0.5 h | -4.823±2.363 | -4.000±22.931 | -18.692±29.310 |
| 1 h | -4.833±3.764 | -7.769±30.362 | -33.308±54.879 |
| 2 h | -5.167±1.941 | -13.308±29.293 | -47.385±26.544 |
电子显微镜观察免疫组织化学检测结果, 发现肝组织切片中的HBsAg阳性细胞数明显减少, 表明LNA可以有效抑制肝细胞中HBsAg的表达(图1).
全自动生化分析仪检测血清中ALB、ALT、BUN、CR、ApoA1、ApoB等指标, 各组结果与对照组比较均无显著性差异(P>0.05), 表明LNA及LNA-脂质体混合物对小鼠的肝、肾功能均无损伤作用(表3).
反义核酸技术是一种按碱基互补配对原则特异性阻断目的基因表达的新型基因疗法. 自20世纪90年代初, Goodarz et al首次报道利用反义核酸技术抗HBV的实验研究以来, 反义技术抗病毒研究已取得了很大的进展. 但由于以往的反义寡核苷酸易被降解、杂交结合能力不强以及对机体存在不良反应等因素, 抗HBV感染的基因治疗一直未取得满意的效果. 1994年, Rodriguez et al首次发现LNA, 他是一种特殊的带环状结构的核苷酸衍生物, 因其核糖的2'-O与4'-C通过缩水作用而形成氧亚甲基桥, 形似锁状故得名. LNA作为一种新型反义核苷酸, 具有传统寡核苷酸无可比拟的优点: 与DNA/RNA分子杂交能力强; 抗核酸酶降解能力强; 脂溶性好; 毒性低等[16-24]. 国外开始用于抗HIV[25]和HCV[26]等RNA病毒的基因治疗研究, 而用于抗HBV感染方面的治疗研究尚未见有报道.
HBV基因组为3.2 kb左右的双链DNA, 至少有4个开放读码框(ORF)[28-30]: S、C、P、X, 其中, S是一个重要的开放读码框, 包括Pre-S1、Pre-S2和S 3个基因区. S基因区的编码产物是HBsAg的主要成分, 不仅参与完整Dane颗粒的装配, 而且还与HBV颗粒的成熟与释放有密切关系. 本研究针对S基因翻译起始区设计合成了反义锁核酸序列, 由阳离子脂质体介导, 经尾静脉给药, 通过检测血液及肝组织细胞中HBV的抗原标志物和HBV DNA水平来判断他的抑制效果. 但是否有疗效的前提是反义LNA能否被导入肝细胞内, 与HBV的S基因翻译起始区互补结合, 达到封闭病毒基因表达的目的. 有文献报道[31-32]以半乳糖多聚赖氨酸(Gal-PLL)作为核酸药物的肝靶向载体, 能够将核酸药物导入肝细胞内, 但转染效率不高. 本实验利用脂质体作为反义LNA的转染载体, 通过其带正电荷的阳离子脂质与带负电荷的LNA序列静电作用形成缀合物, 并利用脂质体的亲脂性进入肝细胞, LNA序列慢慢释放出来, 与细胞内的HBV S基因翻译起始区互补结合, 发挥抗病毒的作用. 结果表明, 由阳离子脂质体介导的反义LNA, 经尾静脉注射后, 能有效进入肝细胞内, 发挥抗HBV复制和表达的作用. 其抗病毒作用呈"非典型"时间效应, 表现为先升高后下降的"峰值"现象, 且高抑制率维持时间达14 d以上, 比国内学者报道[33]的反义寡核苷酸抑制作用维持时间要长, 这将为反义LNA用于临床抗HBV治疗提供参考. 肝组织免疫组织化学染色结果也显示, 细胞膜上的HBsAg表达明显减少. 由于HBV DNA聚合酶缺乏校对作用, 在复制过程中易产生变异株而导致对药物治疗敏感降低或耐药现象, 因此, 尚需要研究多基因位点的抗HBV药物或疗法[34].
此外, 通过检测血清中的ALB、ALT、BUN、CR、ApoA1、ApoB等血液学指标, 同时做肝肾脏病理组织切片HE染色, 观察脏器的组织细胞形态学改变, 评估LNA脂质体混合物的不良反应. 结果表明, 反义LNA对肝肾脏组织无明显的毒性损伤作用.
总之, LNA作为一种极具反义药物潜力的新型核酸衍生物, 有望成为乙型肝炎治疗的安全高效的分子药物. 目前, 由于国内尚未开展LNA的合成与鉴定, 加上其合成成本相对较高等因素限制了临床试验的研究, 但随着对LNA研究的不断深入及合成成本的下降, 其必将为基因研究各领域带来广阔的应用前景.
反义核酸技术, 包括反义RNA、反义DNA和核酶技术. 其通过导入的外源DNA或RNA短序列, 特异性地进行结合、封闭或调节其功能及产物表达, 从而达到治疗目的. 但由于未经修饰的外源核苷酸短序列, 在细胞内容易被核酸酶降解, 所以反义核酸技术的研究与应用一直未能取得很大进展. 近年来, 锁核酸(LNA)的出现给反义核酸技术带来了新的希望与机遇.
王炳元, 教授, 中国医科大学附属第一医院消化内科.
反基因技术, 即三螺旋构象寡核苷酸技术(TFO)是目前研究的热点. 亟待解决的问题是找到一种满意的肝靶向性核酸药物载体, 以及缺乏特异性抗HBV药物.
有文献报道以半乳糖多聚赖氨酸(Gal-PLL)作为核酸药物的肝靶向载体, 能够将核酸药物导入肝细胞内, 但转染效率不高.
锁核酸(LNA)是一种新兴环状核苷酸衍生物, 具有分子杂交能力强、抗核酸酶降解能力高等特性, 本研究首次将其应用于抗HBV感染的治疗研究.
本实验首次利用反义LNA在转基因鼠体内抑制HBV基因表达, 为今后反义核酸药物研发提供理论与实验参考.
本研究选题较好, 设计合理, 结果可信, 对于乙型肝炎的抗病毒治疗具有重要的价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Alter MJ. Epidemiology of hepatitis B in Europe and worldwide. J Hepatol. 2003;39 Suppl 1:S64-S69. [PubMed] [DOI] |
| 2. | Fleming J. Current treatments for hepatitis. J Infus Nurs. 2002;25:379-382. [PubMed] [DOI] |
| 3. | elSaadany S, Tepper M, Mao Y, Semenciw R, Giulivi A. An epidemiologic study of hepatocellular carcinoma in Canada. Can J Public Health. 2002;93:443-446. [PubMed] |
| 4. | Hassan MM, Hwang LY, Hatten CJ, Swaim M, Li D, Abbruzzese JL, Beasley P, Patt YZ. Risk factors for hepatocellular carcinoma: synergism of alcohol with viral hepatitis and diabetes mellitus. Hepatology. 2002;36:1206-1213. [PubMed] [DOI] |
| 5. | Kannangai R, Molmenti E, Arrazola L, Klein A, Choti M, Thomas DL, Torbenson M. Occult hepatitis B viral DNA in liver carcinomas from a region with a low prevalence of chronic hepatitis B infection. J Viral Hepat. 2004;11:297-301. [PubMed] [DOI] |
| 6. | Hino O, Kajino K, Umeda T, Arakawa Y. Understanding the hypercarcinogenic state in chronic hepatitis: a clue to the prevention of human hepatocellular carcinoma. J Gastroenterol. 2002;37:883-887. [PubMed] [DOI] |
| 7. | Buti M, Esteban R. Drugs in development for hepatitis B. Drugs. 2005;65:1451-1460. [PubMed] [DOI] |
| 8. | Wai CT, Chu CJ, Hussain M, Lok AS. HBV genotype B is associated with better response to interferon therapy in HBeAg(+) chronic hepatitis than genotype C. Hepatology. 2002;36:1425-1430. [PubMed] |
| 9. | Manns MP. Current state of interferon therapy in the treatment of chronic hepatitis B. Semin Liver Dis. 2002;22 Suppl 1:7-13. [PubMed] [DOI] |
| 10. | Liaw YF. Therapy of chronic hepatitis B: current challenges and opportunities. J Viral Hepat. 2002;9:393-399. [PubMed] [DOI] |
| 11. | Wolters LM, Hansen BE, Niesters HG, de Man RA. Viral dynamics in chronic hepatitis B patients treated with lamivudine, lamivudine-famciclovir or lamivudine-ganciclovir. Eur J Gastroenterol Hepatol. 2002;14:1007-1011. [PubMed] [DOI] |
| 12. | Song JW, Zhang G, Lin JG, Tang WX, Lin JS. [Clinical study of lamivudine and interferon combinate administration to inhibit hepatitis B virus replication] Zhonghua Ganzangbing Zazhi 2004; 12: 593-596 [PMID: 15504288] DOI 13 Patil SD, Rhodes DG, Burgess DJ. DNA-based therapeutics and DNA delivery systems: a comprehensive review. AAPS J. 2005;7:E61-E77. [PubMed] [DOI] |
| 13. | Gruegelsiepe H, Brandt O, Hartmann RK. Antisense inhibition of RNase P: mechanistic aspects and application to live bacteria. J Biol Chem. 2006;281:30613-30620. [PubMed] [DOI] |
| 14. | Wo JE, Wu XL, Zhou LF, Yao HP, Chen LW, Dennin RH. Effective inhibition of expression of hepatitis B virus genes by DNAzymes. World J Gastroenterol. 2005;11:3504-3507. [PubMed] |
| 15. | Wengel J, Petersen M, Frieden M, Koch T. Chemistry of locked nucleic acids(LNA): Design, synthesis, and bio-physical properties. Lett Pept Sci. 2003;10:237-253. [DOI] |
| 16. | Inohara H, Obika S, Imanishi T. 2',4'-BNA derivatives bearing an unnatural nucleobase: synthesis and application to triplex-forming oligonucleotides. Nucleic Acids Symp Ser (Oxf). 2004;63-64. [PubMed] [DOI] |
| 17. | Braasch DA, Liu Y, Corey DR. Antisense inhibition of gene expression in cells by oligonucleotides incorporating locked nucleic acids: effect of mRNA target sequence and chimera design. Nucleic Acids Res. 2002;30:5160-5167. [PubMed] [DOI] |
| 18. | Rapozzi V, Cogoi S, Xodo LE. Antisense locked nucleic acids efficiently suppress BCR/ABL and induce cell growth decline and apoptosis in leukemic cells. Mol Cancer Ther. 2006;5:1683-1692. [PubMed] [DOI] |
| 19. | Swayze EE, Siwkowski AM, Wancewicz EV, Migawa MT, Wyrzykiewicz TK, Hung G, Monia BP, Bennett CF. Antisense oligonucleotides containing locked nucleic acid improve potency but cause significant hepatotoxicity in animals. Nucleic Acids Res. 2007;35:687-700. [PubMed] [DOI] |
| 20. | Elmén J, Thonberg H, Ljungberg K, Frieden M, Westergaard M, Xu Y, Wahren B, Liang Z, Ørum H, Koch T. Locked nucleic acid (LNA) mediated improvements in siRNA stability and functionality. Nucleic Acids Res. 2005;33:439-447. [PubMed] [DOI] |
| 21. | Castoldi M, Schmidt S, Benes V, Noerholm M, Kulozik AE, Hentze MW, Muckenthaler MU. A sensitive array for microRNA expression profiling (miChip) based on locked nucleic acids (LNA). RNA. 2006;12:913-920. [PubMed] [DOI] |
| 22. | Vester B, Hansen LH, Lundberg LB, Babu BR, Sørensen MD, Wengel J, Douthwaite S. Locked nucleoside analogues expand the potential of DNAzymes to cleave structured RNA targets. BMC Mol Biol. 2006;7:19. [PubMed] [DOI] |
| 23. | Braasch DA, Corey DR. Locked nucleic acid (LNA): fine-tuning the recognition of DNA and RNA. Chem Biol. 2001;8:1-7. [PubMed] [DOI] |
| 24. | Arzumanov A, Walsh AP, Rajwanshi VK, Kumar R, Wengel J, Gait MJ. Inhibition of HIV-1 Tat-dependent trans activation by steric block chimeric 2'-O-methyl/LNA oligoribonucleotides. Biochemistry. 2001;40:14645-14654. [PubMed] [DOI] |
| 25. | Nulf CJ, Corey D. Intracellular inhibition of hepatitis C virus (HCV) internal ribosomal entry site (IRES)-dependent translation by peptide nucleic acids (PNAs) and locked nucleic acids (LNAs). Nucleic Acids Res. 2004;32:3792-3798. [PubMed] [DOI] |
| 27. | Seeger C, Mason WS. Hepatitis B virus biology. Microbiol Mol Biol Rev. 2000;64:51-68. [PubMed] [DOI] |
| 28. | Funk A, Mhamdi M, Will H, Sirma H. Avian hepatitis B viruses: molecular and cellular biology, phylogenesis, and host tropism. World J Gastroenterol. 2007;13:91-103. [PubMed] |
| 29. | Madden CR, Finegold MJ, Slagle BL. Hepatitis B virus X protein acts as a tumor promoter in development of diethylnitrosamine-induced preneoplastic lesions. J Virol. 2001;75:3851-3858. [PubMed] [DOI] |
| 32. | 曹 英林, 刘 素侠, 张 利宁, 马 春红, 丁 培芳, 孙 汶生, 丁 红转. 针对HBV X基因区三个关键位点的反义寡核苷酸体内抑瘤研究. 山东大学学报(医学版). 2002;40:338-340. |