修回日期: 2009-07-14
接受日期: 2009-07-20
在线出版日期: 2009-08-08
目的: 观察环氧合酶-2(cyclooxygenase -2, COX-2)及肺耐药蛋白(lung resistance protein, LRP)在胃癌组织中的表达, 探讨COX-2介导胃癌耐药与LRP的关系.
方法: 采用免疫组织化学法, 检测63例胃癌标本与30例非胃癌胃组织中COX-2和LRP的表达, 并分析其表达与胃癌的组织学类型、分化程度、淋巴结转移及与患者的年龄、性别的关系.
结果: COX-2和LRP在胃癌组织中阳性表达率高于非胃癌胃组织(87.3% vs 53.3%, 66.7% vs 43.3%, 均P<0.05). 胃癌组织中COX-2和LRP的表达与患者的年龄、性别及组织的分化程度、浸润深度等无明显关系; COX-2在淋巴结转移患者的阳性表达率明显高于无转移者(100% vs 69.2%, P<0.05), 而LRP的表达与淋巴结转移无明显关系. 在胃癌组织中COX-2与LRP的表达呈正相关(r = 0.033, P<0.05).
结论: LRP可能是引起胃癌原发性耐药的耐药蛋白之一; COX-2可能通过影响LRP的表达介导胃癌耐药性的发生.
引文著录: 王俊先, 张开光, 王巧民, 吴正祥, 陈柯, 王晓秋, 丁敏, 方雪松. COX-2与LRP在胃癌组织中的表达及其意义. 世界华人消化杂志 2009; 17(22): 2312-2316
Revised: July 14, 2009
Accepted: July 20, 2009
Published online: August 8, 2009
AIM: To investigate the expression of cyclooxygenase-2 (COX-2) and lung resistance protein (LRP) in gastric carcinoma and explore the relationship between COX-2-mediated drug resistance and LRP expression in gastric carcinoma.
METHODS: The expression of COX-2 and LRP was detected by immunohistochemistry in 63 gastric cancer specimens and 30 non-gastric cancer stomach tissues. The correlations of COX-2 and LRP expression with tumor differentiation, histological type, lymph node metastasis, and patient age and sex were explored. The correlation between the expression of COX-2 and LRP was also analyzed.
RESULTS: The positive expression rates of COX-2 and LRP in gastric cancer were significantly higher than those in non-gastric cancer stomach tissues (87.3% vs 53.3% and 66.7% vs 43.3%, respectively, both P < 0.05). Neither COX-2 nor LRP expression was related with patient age and sex, and tumor differentiation, depth of invasion and histological type. The positive expression rate of COX-2 in gastric cancer with lymph node metastasis was significant higher than that without lymph node metastasis (100% vs 62.9%, P < 0.05), whereas the expression of LRP was not related with lymph node metastasis. There was a significant positive correlation between COX-2 and LRP expression in gastric cancer (r = 0.033, P < 0.05).
CONCLUSION: LRP probably is one of proteins that cause primary drug resistance in gastric cancer. COX-2 mediates drug resistance in gastric cancer perhaps through regulating the expression of LRP.
- Citation: Wang JX, Zhang KG, Wang QM, Wu ZX, Chen K, Wang XQ, Ding M, Fang XS. Significance of expression of cyclooxygenase-2 and lung resistance protein in gastric cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2312-2316
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2312.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2312
化疗是治疗胃癌尤其是中晚期胃癌的重要手段之一, 但临床发现许多胃癌患者对化疗药物存在着不同程度的耐药, 即肿瘤的多药耐药(multidrug resistance, MDR)现象, 导致治疗失败. 有研究表明, 环氧合酶-2(cyclooxygenase-2, COX-2)抑制剂可以增加部分肿瘤组织对化疗药物的敏感性[1], 逆转肿瘤耐药, 因此认为COX-2可能以某种机制参与肿瘤耐药的发生. 本实验观察COX-2与肺耐药蛋白(lung resistance protein, LRP)在胃癌组织中的表达, 探讨COX-2与LRP的表达是否存在相关性.
安徽省立医院行外科手术切除的胃癌患者63例, 所有患者均经病理证实为胃癌, 且术前均未接受任何方式的抗肿瘤治疗. 其中男47例, 女16例, 患者年龄26-79(平均年龄59)岁. ≥55岁44例, <55岁19例; 高中分化腺癌25例, 低分化腺癌38例; 有淋巴结转移者37例, 无淋巴结转移者26例; 浸润黏膜及黏膜下者14例, 侵及肌层者9例, 侵及全层及外膜外者40例. 30例非胃癌胃组织标本来自外科手术切除并经病理证实为非胃癌胃组织(病理检查提示均有不同程度的炎症反应或不典型增生). 即用型COX-2单克隆一抗, 即用型LRP单克隆一抗, 即用型二抗试剂盒PV-6000, DAB显色剂等试剂均购自北京中杉金桥生物有限公司.
1.2.1 步骤: 用免疫组织化学二步法检测COX-2及LRP在胃癌组织和非胃癌胃组织中的表达. 所有标本均用100 g/L的中性甲醛固定, 石蜡包埋, 4 μm连续切片, 每份标本切3张, 1张行HE染色, 另2张行免疫组织化学染色, 试验步骤严格按照试剂说明书操作步骤进行. 阴性对照以PBS代替一抗, 以已知阳性表达的胃组织标本作为阳性对照.
1.2.2 结果判断: COX-2及LRP均为胞质表达, 以胞质表达颗粒的着色深浅及着色的阳性细胞数进行评分: 无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 无细胞着色为0分, <10%为1分, 10-25%为1分, 25-50%为2分, 50-75%, 为3分, >75%为4分. 将二者的积分之积作为免疫组织化学的表达评分. ≤3分者为阴性, 4-6分为+, 7-9为++, 9-12为+++, 4分以上为阳性表达.
统计学处理 用SPSS13.0软件, 采用卡方检验和相关性分析方法. 检验水准为α = 0.05.
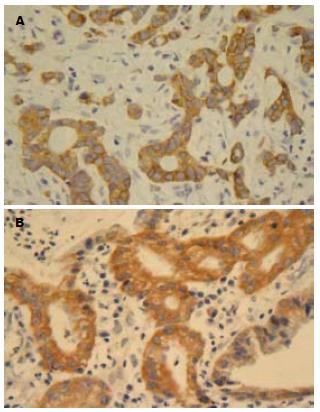
COX-2和LRP在胃癌组织中阳性表达率高于非胃癌胃组织(87.3% vs 53.3%, 66.7% vs 43.3%, 均P<0.05, 表1, 图1).
| n | COX-2 | χ2 值 | P值 | LRP | χ2值 | P值 | |||
| 阳性 | 阴性 | 阳性 | 阴性 | ||||||
| 胃癌 | 63 | 55 | 8 | 12.98 | 0.000 | 42 | 21 | 4.579 | 0.032 |
| 非胃癌 | 30 | 16 | 14 | 13 | 17 | ||||
COX-2在有淋巴结转移的胃癌中的阳性表达率为100%, 而在无淋巴结转移的胃癌组织中的阳性表达为69.2%, 差异有统计学意义(P<0.01); LRP在有淋巴结转移的胃癌组织中的阳性表达率为70.3%, 在无淋巴结转移者的阳性表达为61.5%, 差异无统计学意义(P>0.05, 表2).
| 病理因素 | n | COX-2 | LRP | ||||||
| + | ++ | +++ | 阳性率(%) | + | ++ | +++ | 阳性率(%) | ||
| 年龄 | |||||||||
| ≥55 | 44 | 14 | 16 | 8 | 86.4 | 15 | 11 | 4 | 68.18 |
| <55 | 19 | 9 | 4 | 4 | 89.5 | 4 | 6 | 2 | 63.14 |
| 性别 | |||||||||
| 男 | 47 | 19 | 13 | 9 | 87.2 | 15 | 13 | 3 | 66.0 |
| 女 | 16 | 4 | 7 | 3 | 81.3 | 4 | 4 | 3 | 68.8 |
| 分化程度 | |||||||||
| 高中分化 | 25 | 9 | 12 | 3 | 96.0 | 9 | 9 | 2 | 80.0 |
| 低分化 | 38 | 14 | 8 | 9 | 81.5 | 10 | 8 | 4 | 55.2 |
| 浸润深度 | |||||||||
| 黏膜及黏膜下层 | 14 | 7 | 4 | 2 | 92.9 | 2 | 4 | 2 | 57.1 |
| 肌层 | 9 | 3 | 4 | 1 | 88.9 | 4 | 2 | 0 | 66.7 |
| 外膜及外膜外 | 40 | 13 | 12 | 9 | 85.0 | 13 | 11 | 4 | 70.0 |
| 淋巴转移 | |||||||||
| 有 | 37 | 12 | 17 | 8 | 100.0a | 12 | 10 | 4 | 70.3 |
| 无 | 26 | 11 | 3 | 4 | 69.2 | 7 | 7 | 2 | 61.5 |
COX-2在高中分化的胃癌组织中的阳性表达率为96%, 在低分化的胃癌组织中的阳性表达率为81.5%, 差异无统计学意义; LRP在高中分化的胃癌组织中的阳性表达率为80%, 在低分化胃癌组织中的阳性表达为55.2%, 经统计学分析亦无明显差异(表2).
COX-2在早期胃癌、浸及肌层、浸及全层及外膜外不同阶段的阳性表达率分别为92.9%、88.9%、85%, 差异无统计学意义; LRP在以上3个阶段的阳性表达率分别为57.1%、66.7%、70%, 二者在胃癌组织中的表达与浸润深度无相关性(表2).
COX-2及LRP在不同性别及年龄组的阳性表达没有明显的统计学差异(表2).
在55例COX-2阳性表达的胃癌组织中, LRP的阳性表达率为40例, 在8例COX-2阴性表达的胃癌组织中, 有6例同时LRP阴性表达, 二者在胃癌组织中的表达具有显著相关性(r = 0.377, P<0.05).
化疗是综合治疗恶性肿瘤的重要手段之一, 但肿瘤的MDR现象是导致化疗失败的重要原因, 限制了化疗药的临床应用. MDR是指肿瘤细胞可耐受结构、功能及杀伤机制不同的多种药物的致死量, 一旦肿瘤细胞对某种药物产生耐受, 即可以同时对多种作用机制不同的药物产生耐受. 肿瘤细胞在治疗的初始阶段就对多种化疗药物无反应, 称之为原发性耐药或内在耐药(intrinsic drug resistance); 如果在化疗初期疗效很好, 经过几个疗程后, 肿瘤细胞对所用药物产生了耐药性, 则称之为获得性耐药(acquired drug resistance).
肿瘤耐药机制较为复杂, 随着分子生物学和遗传学的发展, 肿瘤的耐药机制研究已由单纯的病理生理学转向分子病理学范畴, 耐药基因的表达增加已经被肯定与肿瘤的耐药性有明显的关系, 如P-糖蛋白(P-glycoprotein, P-gP)、多药耐药相关蛋白(multidrug resistance-associated protein, MRP)、LRP、谷胱甘肽转移酶-π(glutathione-S-transferase pai, GST-π)、拓扑异构酶Ⅱ(topoisomerase Ⅱ, TopoⅡ)等.
这些基因产生MDR的分子机制主要有以下几个方面[2]: (1)以ATP结合盒蛋白超家族(ATP-binding cassette protein super family)为代表具有泵功能的跨膜蛋白基因的扩增或过表达, 使进入肿瘤细胞内的药物被泵出, 从而减少细胞内的有效药物浓度. 如P-gP、LRP以及乳腺癌耐药相关蛋白(breast cancer related protein BCRP)等; (2)具有细胞解毒功能和DNA修复能力增强的一些细胞内酶表达增加, 使具有细胞毒作用的化疗药物疗效减低, 如GST-π及MGMT(O6-methylguanine-DNA methyltransferase); (3)肿瘤细胞内某些化疗药物作用的靶点分子表达减少, 因而对化疗药的敏感性降低, 如Topo-Ⅱ等. 另外, 促使肿瘤产生耐药还与其他一些因素相互作用, 如: 癌基因的激活表达, 可以抑制化疗药物所致的细胞凋亡, 如Bcl家族、Fas等癌基因的过表达; 蛋白激酶C(protein kinase, PKC)活性增加可以使抗肿瘤药物代谢加快; 抗氧化酶作用增强、神经酰胺的糖基化水平增加、线粒体跨膜电位改变、微管蛋白等微环境的变化等都可以对肿瘤耐药产生不同程度的影响. 其中以P-gp跨膜泵蛋白介导的耐药为经典耐药机制[3].
LRP基因定位于16号染色体, cDNA全长2688 bp, 相对分子质量110 kDa, 其与褐鼠的穹隆体蛋白的编码基因高度同源, 因而被认为LRP即是人的穹隆体蛋白(major vault protein, MVP)[4]. 其亚细胞定位大部分位于胞质中的囊泡上, 少部分位于核膜与核浆中. 穹窿体是真核细胞一种重要的细胞器, 穹窿体总分子质量约为1.29×104 kDa, 外观呈桶状, 大小为35 nm×60 nm. 由4种蛋白质(包括穹窿体蛋白)和RNA共同构成的复合物, 具有2种功能, 他一方面作为核孔复合物(nuclear pore complex, NPC)参与细胞核与细胞质间物质交换的调控, 另一方面与细胞质中的囊泡运输有关.
LRP在正常机体的体腔上皮组织(特别位于长期与生物异源物质、毒物接触的内皮细胞及组织)和分泌器官都可以有正常表达, 与其分泌与排泄功能有关. LRP近年来被发现是重要的耐药基因, 比经典耐药基因P-gp更早在恶性肿瘤中表达, 即给予低浓度化疗药处理后就可以见到LRP的表达增加, 而P-gp则需要高浓度化疗药时才表达增加[5]. 其参与恶性肿瘤的多药耐药机制大致为: 作为核孔复合物的组成部分能封闭核孔, 阻止抗癌药物等外源性生物活性物质进入细胞核内; 另外还能将进入细胞内的抗癌药运送至胞质囊泡, 最终通过胞吐方式排出细胞外, 造成细胞内药物浓度下降而发生耐药现象. 其耐药谱较经典耐药蛋白P-gp要广泛的多. 主要介导阿霉素、铂类、柔红霉素、米托蒽醌、烷化剂等的耐药[6]. 本试验研究发现在胃癌组织LRP阳性表达率为66.7%, 明显高于非胃癌胃组织, 且LRP的表达与胃癌的组织学类型、分化程度、浸润深度以及有无淋巴结转移无明显关系, 这与Fan et al[7]的报道一致, 说明LRP参与胃癌耐药可能与临床分期等无明显关系, 但Shi et al[8]却发现LRP的表达与胃癌的临床分期及有无淋巴结转移有一定的相关性. 具体的差异有待于进一步研究. 因本试验标本来源的患者术前均未接受任何化疗药物治疗, 因此可以认为LRP的高表达与胃癌的原发性耐药有关.
COX, 即前列腺素过氧化物合成酶(prostaglandinhyperoxidesynthase, PGHS)是花生四烯酸(arachidonic acid, AA)合成前列腺素代谢的关键酶, 具有COX和过氧化物酶双重活性, 其中COX活性可以催化AA转化为前列腺素G2(prostaglandin G2, PGG2), 过氧化物酶活性则催化AA转化为前列腺素H2(prostaglandin H2, PGH2), PGH2在各种组织中经特异性酶转化为其他的PGs, 发挥生理作用. 现已经明确的COX的同工酶至少有2种即COX-1和COX-2. COX-1又称结构性环氧酶(constitutive COX), 由599-600个氨基酸残基组成, 在各组织中均有稳定表达, 人体细胞内定位分布于内质网, 其催化产物主要参与保护黏膜细胞、参与凝血机制、及调节内脏血流分布等功能. COX-2属于诱导性酶, 定位于细胞核膜, 由604个氨基酸组成, 在大多数组织没有表达(脑、肾、妊娠后期胎盘、及输精管等有表达, 参与排卵, 排精, 及分娩等功能), 多种因素(如: 致炎因子, 损伤, 致瘤因子, 生长因子等)可诱导其在胞质和胞核表达, 参与炎症反应、促进损伤组织修复、及机体的免疫功能[9]. COX-2被发现在绝大多数的恶性肿瘤细胞包括胃癌细胞均有表达, 被认为与恶性肿瘤的发生与发展及预后均有着重要的关系[10-11]. 其参与胃癌发生发展机制[7]主要是促进Bcl-2的表达、抑制死亡受体的表达及其活性、促进血管的形成和淋巴结转移、免疫逃避、改变端粒酶的活性、对黏附因子的作用、抑制细胞凋亡和促进细胞增殖、参与毒物代谢. 本试验研究发现, 在胃癌组织中COX-2的阳性表达率为87.3%, 明显高于非胃癌胃组织53.3%的阳性表达率, 其表达与胃癌的分化程度、浸润深度、性别、年龄等均无明显关系, 但在有无淋巴结转移的胃癌组织COX-2的阳性表达高于无淋巴结转移的胃癌组织, 表明COX-2是在胃癌的发生发展中起着一定的作用. 除了在胃癌的发生发展过程中起一定的作用外, COX-2还以某些方式参与肿瘤耐药的发生, 用试验诱导肿瘤表达COX-2增加, 可以增加结肠癌对顺铂(CDDP)的耐受性[12]; 在肺癌组织中可以见到COX-2与具有泵功能作用的ABC结合蛋白家庭成员MRP1、MDR1/P-gp、BCRP的表达具有明显相关性[13], 但COX-2与LRP在胃癌组织中的相关性表达的研究报道甚少. COX-2抑制剂已被证明可以预防癌症的发生, 阻止和延缓癌症的发展, 促进癌细胞凋亡等功能. 也有试验证明: 用COX-2抑制剂佐以化疗药物可以明显改善肿瘤模型动物的预后, 提高肿瘤对化疗药物的敏感性[14], 其具体机制尚未明确, 已有研究证实COX-2抑制剂可以明显降低肺癌组织中的MRP和经典耐药蛋白P-gp的表达[15].
本试验研究发现, COX-2与LRP在胃癌组织中存在着明显的正相关, 表明COX-2有可能通过调控LRP在胃癌组织中的表达介导胃癌耐药的发生. 应用COX-2选择性抑制剂能否降低胃癌组织LRP的阳性表达, 将是我们下一步的研究方向.
总之, 要提高胃癌的化疗效果, 化疗药物的选择至关重要. LRP高表达的胃癌患者对顺铂、烷化剂等药物耐药, 因此, 检测胃癌组织中LRP的表达可以为临床合理选择化疗药物提供依据, 使患者避免无谓的化疗药物的不良反应和不必要的经济损失; 进一步研究COX-2参与胃癌耐药机制的发生, 为以COX-2为靶点逆转胃癌耐药的发生和作用选择性COX-2抑制剂联合化疗药治疗胃癌提供理论依据.
环氧合酶-2 (COX-2)是一种诱导性酶, 与肿瘤的发生发展有密切的关系. 选择性COX-2抑制剂有抗癌作用, 同时可以有效逆转肿瘤耐药现象的发生.
黄颖秋, 教授, 本溪钢铁(集团)有限责任公司总医院消化内科
实验证实COX-2增加肿瘤组织对化疗药物的耐受性, COX-2抑制剂则可以增加肿瘤细胞对化疗药物的敏感性. 围绕COX-2介导肿瘤耐药的机制及以COX-2为靶点逆转肿瘤耐药成为目前研究的热点.
Krysan et al研究发现, 用COX-2抑制剂佐以化疗药物可以明显改善肿瘤模型动物的预后, 提高肿瘤对化疗药物的敏感性.
本文首次对COX-2和LRP在胃癌组织中的表达进行相关性研究, 从分子生物学角度对COX-2介导胃癌耐药的可能机制进行初步探讨.
本文初步探讨了COX-2和LRP在胃癌组织中的相关性表达, 为进一步研究COX-2介导胃癌耐药机制和以COX-2为靶点逆转胃癌耐药提供理论依据.
ATP结合盒蛋白超家族: 即ATP结合盒转运体(ATP-binding cassette transporte), 是位于细胞膜上依靠ATP水解供能进行跨膜逆浓度物质转动的一类膜蛋白. 对药物的吸收、分布和排泄过程中起着非常重要的作用. 人类ATP结合盒蛋白超家族亦7个亚家族49个成员组成.
本研究选题新颖,设计合理, 结论客观, 对该领域的进一步研究提供了依据.
编辑: 李军亮 电编:吴鹏朕
| 1. | Keller JJ, Giardiello FM. Chemoprevention strategies using NSAIDs and COX-2 inhibitors. Cancer Biol Ther. 2003;2:S140-S149. [PubMed] |
| 2. | Pérez-Tomás R. Multidrug resistance: retrospect and prospects in anti-cancer drug treatment. Curr Med Chem. 2006;13:1859-1876. [PubMed] [DOI] |
| 3. | Sun J, He ZG, Cheng G, Wang SJ, Hao XH, Zou MJ. Multidrug resistance P-glycoprotein: crucial significance in drug disposition and interaction. Med Sci Monit. 2004;10:RA5-RA14. [PubMed] |
| 4. | Scheffer GL, Wijngaard PL, Flens MJ, Izquierdo MA, Slovak ML, Pinedo HM, Meijer CJ, Clevers HC, Scheper RJ. The drug resistance-related protein LRP is the human major vault protein. Nat Med. 1995;1:578-582. [PubMed] [DOI] |
| 5. | Scheper RJ, Broxterman HJ, Scheffer GL, Kaaijk P, Dalton WS, van Heijningen TH, van Kalken CK, Slovak ML, de Vries EG, van der Valk P. Overexpression of a M(r) 110,000 vesicular protein in non-P-glycoprotein-mediated multidrug resistance. Cancer Res. 1993;53:1475-1479. [PubMed] |
| 6. | Ikeda K, Oka M, Narasaki F, Fukuda M, Nakamura T, Nagashima S, Terashi K, Sato S, Kawabata S, Mizuta Y. Lung resistance-related protein gene expression and drug sensitivity in human gastric and lung cancer cells. Anticancer Res. 1998;18:3077-3080. [PubMed] |
| 7. | Fan K, Fan D, Cheng LF, Li C. Expression of multidrug resistance-related markers in gastric cancer. Anticancer Res. 2000;20:4809-4814. [PubMed] |
| 8. | Shi H, Lu D, Shu Y, Shi W, Lu S, Wang K. Expression of multidrug-resistance-related proteins P-glycoprotein, glutathione-S-transferases, topoisomerase-II and lung resistance protein in primary gastric cardiac adenocarcinoma. Cancer Invest. 2008;26:344-351. [PubMed] [DOI] |
| 10. | Mao XY, Wang XG, Lv XJ, Xu L, Han CB. COX-2 expression in gastric cancer and its relationship with angiogenesis using tissue microarray. World J Gastroenterol. 2007;13:3466-3471. [PubMed] |
| 11. | Samaka RM, Abdou AG, Abd El-Wahed MM, Kandil MA, El-Kady NM. Cyclooxygenase-2 expression in chronic gastritis and gastric carcinoma, correlation with prognostic parameters. J Egypt Natl Canc Inst. 2006;18:363-374. [PubMed] |
| 12. | Saikawa Y, Sugiura T, Toriumi F, Kubota T, Suganuma K, Isshiki S, Otani Y, Kumai K, Kitajima M. Cyclooxygenase-2 gene induction causes CDDP resistance in colon cancer cell line, HCT-15. Anticancer Res. 2004;24:2723-2728. [PubMed] |
| 13. | Surowiak P, Pawełczyk K, Maciejczyk A, Pudełko M, Kołodziej J, Zabel M, Murawa D, Drag M, Gansukh T, Dietel M. Positive correlation between cyclooxygenase 2 and the expression of ABC transporters in non-small cell lung cancer. Anticancer Res. 2008;28:2967-2974. [PubMed] |
| 14. | Krysan K, Reckamp KL, Sharma S, Dubinett SM. The potential and rationale for COX-2 inhibitors in lung cancer. Anticancer Agents Med Chem. 2006;6:209-220. [PubMed] [DOI] |
| 15. | Kang HK, Lee E, Pyo H, Lim SJ. Cyclooxygenase-independent down-regulation of multidrug resistance-associated protein-1 expression by celecoxib in human lung cancer cells. Mol Cancer Ther. 2005;4:1358-1363. [PubMed] [DOI] |