修回日期: 2009-06-15
接受日期: 2009-06-23
在线出版日期: 2009-08-08
目的: 探讨FAAH在正常结肠壁内表达及意义.
方法: 收集2006-2008年由于结肠造瘘和结肠息肉等在我院行结肠手术的患者16例正常结肠组织, 其中男10例, 女6例. 取其结肠标本, 其中升结肠5例, 降结肠3例, 乙状结肠8例, 分别采用免疫组织化学、Western blot及RT-PCR检测FAAH在正常结肠组织中的表达, 并通过免疫荧光法对比FAAH与CB1在正常结肠壁中的表达.
结果: 在升结肠、降结肠及乙状结肠肠壁肌间神经元胞质内均可见阳性染色, 同时在结肠黏膜层内的肠腺体以及吸收细胞的胞质中也可见明显阳性染色, 且染色强度在各组基本相同, 统计学差异不显著(P>0.05). Western blot的结果与免疫组织化学一致, 灰度分析结果显示统计学差异不显著(P>0.05). RT-PCR显示, 各组样本中均可检测到不同数量的FAAH拷贝数, 每微克RNA中FAAH cDNA的拷贝数相比, 差异无统计学意义(P>0.05); 免疫荧光法提示在肠壁肌间神经元胞质中红、绿色荧光均可见, 两者位置相近, 分布呈互补趋势.
结论: 正常结肠壁中存在FAAH的表达, 且各段肠管之间无差异, 在肌间神经丛内FAAH的分布与CB1受体呈对应趋势, 通过对大麻酚信号通路研究可能为功能性胃肠病的治疗提供新的手段.
引文著录: 乔雷, 陈春生, 张树成. 正常结肠壁内FAAH的表达及意义. 世界华人消化杂志 2009; 17(22): 2266-2271
Revised: June 15, 2009
Accepted: June 23, 2009
Published online: August 8, 2009
AIM: To explore the significance of expression of fatty acid amide hydrolase (FAAH) in normal colon wall.
METHODS: Sixteen normal colon specimens were collected from the ascending colon (five cases), descending colon (three cases) and sigmoid colon (eight cases) in patients treated at our hospital due to colon polyps or undergoing colostomy . The expression of FAAH mRNA and protein in these specimens was detected by RT-PCR, immunohistochemistry and Western blot, respectively. The expression patterns of FAAH and cannabinoid receptor 1 (CB1) were compared by immunofluorescent staining.
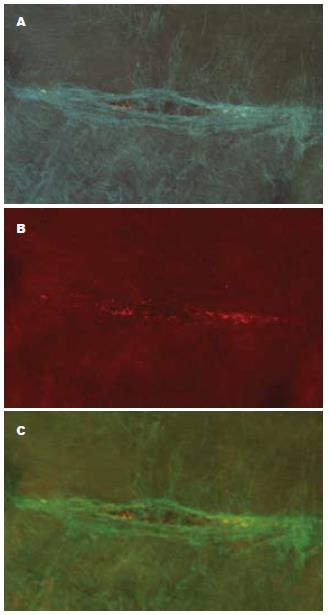
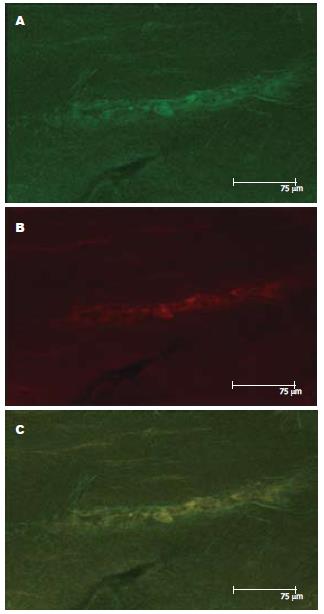
RESULTS: Positive staining for FAAH was observed in the cytoplasm of myenteric neurons in the intestinal wall in different colonic segments. Obvious positive staining was also noted in mucosal glands and the cytoplasm of absorptive cells. Semi-quantitative analysis showed that there were no significant differences in the staining intensity among different colonic segments (all P > 0.05). Similar result was obtained by Western blot (all P > 0.05). Real-time PCR results showed that there were also no significant differences in FAAH mRNA expression levels among different colonic segments (all P > 0.05). Immunofluorescence staining showed that both FAAH and CB1 could be detected in the cytoplasm of myenteric neurons in the intestinal walls, and they were distributed in a complementary pattern.
CONCLUSION: FAAH is expressed in normal colon wall. There are no significant differences in the expression levels of FAAH among different colonic segments. FAAH and CB1 are distributed in a complementary pattern.
- Citation: Qiao L, Chen CS, Zhang SC. Significance of expression of fatty acid amide hydrolase in normal colon wall. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2266-2271
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2266.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2266
大麻酚信号通路是近几年来发现的一个新的信号通路, 其参与了人体内许多重要生理活动的调节, 包括睡眠[1-3], 胃肠道的传输[4-7], 免疫和分泌等[8-10], 该系统由内源性麻酚类物质及其受体CB1(G蛋白偶联受体), 以及一些可以调节内源性麻酚类物质合成与代谢的酶类组成. 脂肪酰胺水解酶(fatty acid amide hydrolase, FAAH)是近年来发现的一种位于线粒体和微粒体膜上的生物酶, 可以对内源性麻酚类物质起催化水解作用, 调节内源性麻酚类物质的代谢[11-14]. 对于CB1受体在人类结肠内的分布及其生理作用, 目前已有较多的研究和阐述[4-7], 但对于FAAH的研究目前未见报道. 本文对正常结肠壁内FAAH的表达和分布进行研究, 进一步探讨大麻酚信号通路在调节结肠生理活动中的作用.
对自2006-2008年中, 由于外伤, 各种原因所致结肠造瘘和结肠息肉等原因在我院行结肠手术的16例患者, 其中男10例, 女6例, 最小年龄4岁, 最大20岁, 平均年龄7.5岁. 取其结肠标本, 按部位分为升、降和乙状结肠3组, 其中升结肠5例, 降结肠3例, 乙状结肠8例, 标本离体后迅速投入液氮中, 24 h后转入-80℃深低温冰箱中保存, 备用. 兔抗人FAAH抗体及其非免疫血清, 山羊抗人CB1抗体及其非免疫血清购自美国ADI公司, 山羊抗兔二抗试剂盒购自福州迈新生物技术公司, 罗丹明标记的驴抗兔荧光抗体, FITC标记的驴抗山羊荧光抗体及驴非免疫血清购自Santa Cruz公司. 总蛋白抽提试剂盒购自赛驰公司. RT-PCR试剂盒、Marker、Taq酶、dNTP、琼脂糖购自大连宝生物生物公司, 引物由Primer5.0自行设计, 上游引物为5'-CCAAGGCTGTCAGCTTTCCT-3'; 下游引物为: 5'-TTTTCCAGCCGAACGAGACT-3'由北京奥科生物有限公司合成.
1.2.1 FAAH表达分析: (1)免疫组织化学法: 取冰冻组织标本, 包埋, 切片, 4℃丙酮固定20-30 min, 常规染色, 一抗浓度为1:200, 二抗为即用型抗体, 生物素化后DAB显色, 常规复染, 脱水, 透明, 固定, 封片, 显微镜下观察. 在细胞胞质中出现棕黄色颗粒为阳性表达. 采用HPIAS-1000多媒体彩色病理图像分析系统对FAAH的表达进行定量分析, 每张切片随机选取5个完整而不重叠的高倍镜视野(×400), 测定每个视野下阳性反应的平均吸光度、阳性反应面积和所有细胞总面积, 计算阳性面积率(阳性反应面积/所有细胞总面积), 以每例5个视野的平均吸光度、阳性面积率的平均值作为该例的测量值. (2)Western blot: 应用总蛋白抽提试剂盒提取蛋白, 变性, 上样后电泳, 上样量为20 μL, 转膜, 封闭, 一抗孵育(浓度为1: 200), 二抗孵育(浓度为1:100)后碱性磷酸酶显色, 纤维膜在滤纸中干燥保存, 用GIS-2020凝胶图像分析系统扫描分析结果, 结果根据灰度值大小进行判定. (3)Real-Time PCR: 应用酚氯仿法提取总RNA, 应用逆转录试剂盒合成cDNA, 产物交由广州达安基因诊断中心行绿色染料法定量PCR检测mRNA的表达. 荧光定量仪ABI 7000为全自动荧光定量PCR仪(美国Perkin Elmer公司). 反应结束后, 由电脑自动分析并计算结果, 结果按样本每μg总RNA中的拷贝数进行定量分析.
1.2.2 FAAH与CB1受体的对比分布: 取上述免疫组织化学剩余标本, 常规荧光双重染色: 将2种一抗按1:1比例混合, 4℃孵育过夜, 抗体稀释度1:100, 后分别加入驴抗兔荧光二抗, 抗体稀释度1:50, 和驴抗山羊荧光二抗, 抗体稀释度1:50. 封片后分别在普通荧光显微镜和激光共聚焦显微镜下观察.
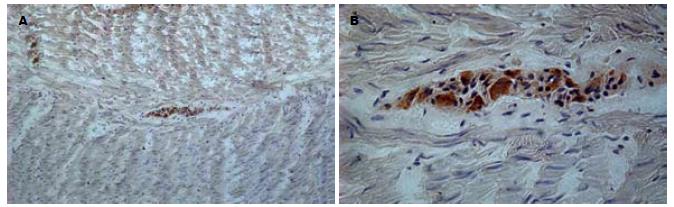
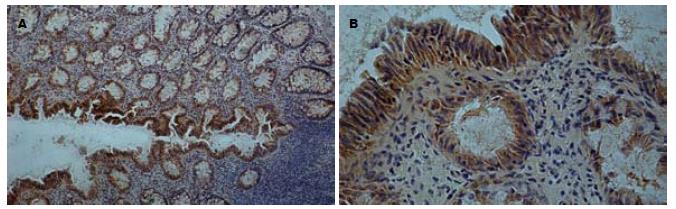
正常结肠无论升结肠、降结肠还是乙状结肠肠壁肌间神经元胞质内均可见阳性染色(图1), 同时在结肠黏膜层内的肠腺体以及吸收细胞的胞质中也可见到明显阳性染色(图2). 半定量分析结果显示, 染色强度在各组基本相同, 统计学差异不显著(32.67±8.7 vs 30.34±9.4 vs 30.79±3.4, P>0.05).
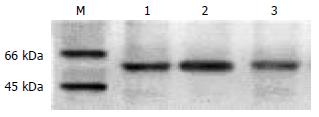
升结肠、降结肠及乙状结肠FAAH蛋白印迹图(图3), 其中泳道1为降结肠, 泳道2为升结肠, 泳道3为乙状结肠; 各组相比, FAAH蛋白印迹基本接近, 灰度值分析结果显示统计学差异不显著(10.47±3.7 vs 9.95±6.4 vs 9.79±3.4, P>0.05).
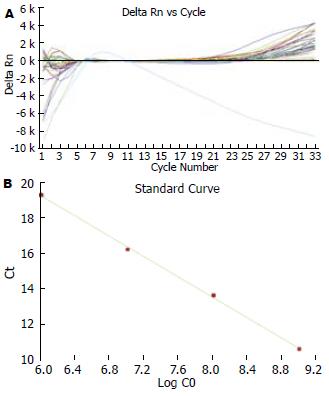
各组病例Real Time PCR的样本扩增曲线及标准回归曲线(图4), 无论升结肠、降结肠还是乙状结肠, 各组样本中均可检测到不同数量的FAAH拷贝数, 定量分析结果显示, 每微克的总RNA中FAAH cDNA的拷贝数相比, 差异无统计学意义(169 597±8476 vs 170 564±9843 vs 158 864±3246, P>0.05).
应用普通荧光显微镜和激光共聚焦显微镜, 对免疫荧光双重染色结果进行观察, 结果显示, 在肠壁肌间神经元胞质中即可见红色荧光, 也可见绿色荧光, 两者位置相近, 分布上呈互补趋势(图5-6).
在我国应用植物大麻治疗功能性腹痛, 腹泻已有近千年的历史, 效果确切可信, 原因是植物大麻内含有Δ9-四氢大麻酚活性成分[2,14], 已有研究显示, 在正常生理条件下, 人类体内存在与Δ9-四氢大麻酚类似的内源性麻酚类物质, 可以产生同样的药理作用[1,3-4,8,14]. 这种由内源性麻酚类物质及其受体CB1(G蛋白偶联受体)以及一些可以调节内源性麻酚类物质合成与代谢的酶类组成的信号通路, 称为大麻酚信号通路. 该信号系统参与了许多重要生理活动的调节, 包括结肠推进[4-7], 免疫调节和胃肠分泌等[8-10].
FAAH是近年来发现的一种膜蛋白酶, 具有酰胺酶和酯酶活性, 位于细胞内的线粒体和微粒体膜上. 研究表明, FAAH在脑, 肝脏等多个器官参与了内源性信号脂肪酰胺类物质的代谢, 可以催化内源性大麻酚的水解和灭活, 因此FAAH也是大麻酚信号通路的重要组成部分之一[15-18]. 对中枢神经系统内麻酚信号的调节作用研究表明, CB1受体一般位于突触前膜的神经末梢, 内源性麻酚类物质则由突触后膜的神经元释放到突触间隙, 内源性麻酚类物质与CB1受体结合后可以抑制突触前膜释放兴奋性神经递质而对突触后膜产生抑制作用; 而FAAH通常位于突触后膜的神经元胞体或树突, 通过调节内源性麻酚类物质的释放量来调节大麻酚信号而发挥作用[1,19].
关于内源性麻酚类物质以及受体CB1在调解人类结肠生理活动中作用及机制, 目前已有较多的报道[4-7], 但在人类结肠中是否存在FAAH的表达, 在何种细胞中表达以及是否对麻酚信号也存在与脑类似的调节作用目前尚不清楚, 本研究应用免疫组织化学, 免疫印迹以及定量PCR技术, 分别从蛋白和核酸两个水平对正常结肠壁内FAAH的表达情况进行分析, 结果发现人类结肠中确有FAAH的表达, 且通过定位染色研究发现, FAAH主要分布在结肠肌间神经丛和肠壁黏膜腺体以及肠吸收细胞, 提示在人类结肠同样存在FAAH对麻酚信号的调节作用, FAAH可以影响结肠的生理活动. 通过双重荧光染色我们还发现, FAAH在肠肌间神经丛的神经元中表达, 在位置与空间分布上与CB1受体基本呈对应趋势, 提示麻酚信号通路在肠神经系统存在与中枢神经系统类似的作用模式[20-23]. FAAH的主要作用是可以调节内源性麻酚类物质的水解和灭活, 通过激活CB1受体而发挥对结肠的抑制作用; CB1受体活化是FAAH作用的最主要机制, 当内源性麻酚类物质与CB1受体结合后, 使其活化, 通过G蛋白偶联转导, 抑制腺苷酸环化酶, 使cAMP含量减少, 突触前膜神经递质释放减少, 减少化学性刺激诱导的收缩运动[24-28]. 当然, FAAH还可以通过活化vanilloid受体或非受体介导的机制影响结肠的传输功能[6,29], 即使对CB1基因缺失小鼠的结肠动力仍具有较强的作用. 除了内源性麻酚类物质以外, FAAH还可催化其他种类的酰胺类物质水解, 包括油酸酰胺(oleamide, OLA)和棕榈酰乙醇胺(palmitoylethanolamine, PEA), OLA及PEA也可减少胃肠传输功能[30-31], 表明除了通过内源性麻酚类物质的作用外FAAH还参与了其他酰胺类物质介导的信号通路, FAAH具有更强的结肠调节功能.
在试验中我们还发现, FAAH除了在肠肌间神经丛的神经元中表达以外, 还在结肠黏膜内的腺体和吸收细胞中有强阳性的表达, 提示FAAH在结肠中还具有其他的生理调节作用, 由于肠腺体和吸收细胞的主要功能是分泌和吸收, FAAH在两者中的分布说明FAAH可能参与了结肠的分泌和吸收功能; 由于人类的食物或排泄物中不可避免的有麻酚类物质的存在, 如果这些物质被吸收, 那么体内维持正常生理活动的麻酚信号系统将受到严重干扰, 因此有学者推测, 人类胃肠道中可能存在催化麻酚类物质的水解和灭活作用的酶类, 针对外源性麻酚类物质起作用[32-33]. 本研究在上述假说的基础上, 进一步通过免疫学染色和定量PCR技术证实, 人类结肠黏膜细胞内确实存在此种酶类-FAAH的表达, FAAH可能在胃肠道的吸收过程中催化了外源性麻酚类物质的灭活, 保证了人体内生理性麻酚信号的稳定[34].
可见, FAAH无论是对于维持生理性麻酚信号的稳定, 还是调节生理性麻酚信号的功能进而调节结肠的生理活动, 都具有重要意义. 任何可能引起FAAH功能异常的因素均可导致生理性麻酚信号失调, 进而导致结肠的生理功能异常, 比如动力低下, 肠分泌减少以及免疫失调等, 大麻酚信号通路对结肠的生理性调节作用为功能性胃肠病的研究提供了一个新的研究靶点, 相信对于大麻酚信号通路的深入研究必将为功能性胃肠病的病因和治疗带来突破的进展.
总之, 人类正常结肠壁内无论是蛋白还是核酸水平均存在FAAH的表达, FAAH主要表达在结肠肌间神经丛的神经元内和肠黏膜表面的吸收细胞和腺体内, 在肌间神经丛内FAAH的分布与CB1受体呈对应趋势.
大麻酚信号通路是近几年来发现的一个新的信号通路, 参与了人体内许多重要生理活动的调节, 该系统由内源性麻酚类物质及其受体CB1, 以及一些可以调节内源性麻酚类物质合成与代谢的酶类组成. FAAH是近年来发现的一种位于线粒体和微粒体膜上的生物酶, 可以对内源性麻酚类物质起催化水解作用, 调节内源性麻酚类物质的代谢.
谭学瑞, 教授, 汕头大学医学院第一附属医院院长室; 汪思应, 教授, 安徽医科大学实验动物中心
关于内源性麻酚类物质以及受体CB1在调解人类结肠生理活动中作用及机制, 目前已有较多的报道, 但在人类结肠中是否存在FAAH的表达, 在何种细胞中表达以及是否对麻酚信号也存在与脑类似的调节作用目前尚不清楚.
研究表明, FAAH在脑, 肝脏等多个器官参与了内源性信号脂肪酰胺类物质的代谢, 可以催化内源性大麻酚的水解和灭活, 因此FAAH也是大麻酚信号通路的重要组成部分之一.
本文对正常结肠壁内FAAH的表达和分布进行研究, 进一步探讨大麻酚信号通路在调节结肠生理活动中的作用.
大麻酚信号通路对结肠的生理性调节作用为功能性胃肠病的研究提供了一个新的研究靶点, 相信对于大麻酚信号通路的深入研究必将为功能性胃肠病的病因和治疗带来突破的进展.
本文选题较新, 设计合理, 结论可靠, 有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Wilson RI, Nicoll RA. Endocannabinoid signaling in the brain. Science. 2002;296:678-682. [PubMed] [DOI] |
| 2. | Roth MD, Baldwin GC, Tashkin DP. Effects of delta-9-tetrahydrocannabinol on human immune function and host defense. Chem Phys Lipids. 2002;121:229-239. [PubMed] [DOI] |
| 3. | Pinto L, Izzo AA, Cascio MG, Bisogno T, Hospodar-Scott K, Brown DR, Mascolo N, Di Marzo V, Capasso F. Endocannabinoids as physiological regulators of colonic propulsion in mice. Gastroenterology. 2002;123:227-234. [PubMed] [DOI] |
| 4. | Mascolo N, Izzo AA, Ligresti A, Costagliola A, Pinto L, Cascio MG, Maffia P, Cecio A, Capasso F, Di Marzo V. The endocannabinoid system and the molecular basis of paralytic ileus in mice. FASEB J. 2002;16:1973-1975. [PubMed] |
| 5. | Wright K, Rooney N, Feeney M, Tate J, Robertson D, Welham M, Ward S. Differential expression of cannabinoid receptors in the human colon: cannabinoids promote epithelial wound healing. Gastroenterology. 2005;129:437-453. [PubMed] |
| 6. | Storr M, Sibaev A, Marsicano G, Lutz B, Schusdziarra V, Timmermans JP, Allescher HD. Cannabinoid receptor type 1 modulates excitatory and inhibitory neurotransmission in mouse colon. Am J Physiol Gastrointest Liver Physiol. 2004;286:G110-G117. [PubMed] [DOI] |
| 7. | Maccarrone M, Gasperi V, Fezza F, Finazzi-Agrò A, Rossi A. Differential regulation of fatty acid amide hydrolase promoter in human immune cells and neuronal cells by leptin and progesterone. Eur J Biochem. 2004;271:4666-4676. [PubMed] [DOI] |
| 8. | Izzo AA, Capasso F, Costagliola A, Bisogno T, Marsicano G, Ligresti A, Matias I, Capasso R, Pinto L, Borrelli F. An endogenous cannabinoid tone attenuates cholera toxin-induced fluid accumulation in mice. Gastroenterology. 2003;125:765-774. [PubMed] [DOI] |
| 9. | Mang CF, Erbelding D, Kilbinger H. Differential effects of anandamide on acetylcholine release in the guinea-pig ileum mediated via vanilloid and non-CB1 cannabinoid receptors. Br J Pharmacol. 2001;134:161-167. [PubMed] [DOI] |
| 10. | Steffens M, Szabo B, Klar M, Rominger A, Zentner J, Feuerstein TJ. Modulation of electrically evoked acetylcholine release through cannabinoid CB1 receptors: evidence for an endocannabinoid tone in the human neocortex. Neuroscience. 2003;120:455-465. [PubMed] [DOI] |
| 11. | Weber A, Ni J, Ling KH, Acheampong A, Tang-Liu DD, Burk R, Cravatt BF, Woodward D. Formation of prostamides from anandamide in FAAH knockout mice analyzed by HPLC with tandem mass spectrometry. J Lipid Res. 2004;45:757-763. [PubMed] [DOI] |
| 12. | Ueda N, Puffenbarger RA, Yamamoto S, Deutsch DG. The fatty acid amide hydrolase (FAAH). Chem Phys Lipids. 2000;108:107-121. [PubMed] [DOI] |
| 13. | Park B, Gibbons HM, Mitchell MD, Glassa M. Identification of the CB1 cannabinoid receptor and fatty acid amide hydrolase (FAAH) in the human placenta. Placenta. 2003;24:473-478. [PubMed] [DOI] |
| 14. | Palmer SL, Khanolkar AD, Makriyannis A. Natural and synthetic endocannabinoids and their structure-activity relationships. Curr Pharm Des. 2000;6:1381-1397. [PubMed] [DOI] |
| 15. | Bambico FR, Duranti A, Tontini A, Tarzia G, Gobbi G. Endocannabinoids in the treatment of mood disorders: evidence from animal models. Curr Pharm Des. 2009;15:1623-1646. [PubMed] [DOI] |
| 16. | Mazzola C, Medalie J, Scherma M, Panlilio LV, Solinas M, Tanda G, Drago F, Cadet JL, Goldberg SR, Yasar S. Fatty acid amide hydrolase (FAAH) inhibition enhances memory acquisition through activation of PPAR-alpha nuclear receptors. Learn Mem. 2009;16:332-337. [PubMed] [DOI] |
| 17. | Ahn K, Johnson DS, Mileni M, Beidler D, Long JZ, McKinney MK, Weerapana E, Sadagopan N, Liimatta M, Smith SE. Discovery and characterization of a highly selective FAAH inhibitor that reduces inflammatory pain. Chem Biol. 2009;16:411-420. [PubMed] [DOI] |
| 18. | Fowler CJ, Holt S, Tiger G. Acidic nonsteroidal anti-inflammatory drugs inhibit rat brain fatty acid amide hydrolase in a pH-dependent manner. J Enzyme Inhib Med Chem. 2003;18:55-58. [PubMed] [DOI] |
| 19. | Justinova Z, Mangieri RA, Bortolato M, Chefer SI, Mukhin AG, Clapper JR, King AR, Redhi GH, Yasar S, Piomelli D. Fatty acid amide hydrolase inhibition heightens anandamide signaling without producing reinforcing effects in primates. Biol Psychiatry. 2008;64:930-937. [PubMed] [DOI] |
| 20. | Seierstad M, Breitenbucher JG. Discovery and development of fatty acid amide hydrolase (FAAH) inhibitors. J Med Chem. 2008;51:7327-7343. [PubMed] [DOI] |
| 21. | Mileni M, Johnson DS, Wang Z, Everdeen DS, Liimatta M, Pabst B, Bhattacharya K, Nugent RA, Kamtekar S, Cravatt BF. Structure-guided inhibitor design for human FAAH by interspecies active site conversion. Proc Natl Acad Sci U S A. 2008;105:12820-12824. [PubMed] [DOI] |
| 22. | Labar G, Michaux C. Fatty acid amide hydrolase: from characterization to therapeutics. Chem Biodivers. 2007;4:1882-1902. [PubMed] [DOI] |
| 23. | Iwasaki S, Ishiguro H, Higuchi S, Onaivi ES, Arinami T. Association study between alcoholism and endocannabinoid metabolic enzyme genes encoding fatty acid amide hydrolase and monoglyceride lipase in a Japanese population. Psychiatr Genet. 2007;17:215-220. [PubMed] [DOI] |
| 24. | Holt S, Nilsson J, Omeir R, Tiger G, Fowler CJ. Effects of pH on the inhibition of fatty acid amidohydrolase by ibuprofen. Br J Pharmacol. 2001;133:513-520. [PubMed] [DOI] |
| 25. | Haller J, Barna I, Barsvari B, Gyimesi Pelczer K, Yasar S, Panlilio LV, Goldberg S. Interactions between environmental aversiveness and the anxiolytic effects of enhanced cannabinoid signaling by FAAH inhibition in rats. Psychopharmacology (Berl). 2009;204:607-616. [PubMed] [DOI] |
| 26. | Parker LA, Limebeer CL, Rock EM, Litt DL, Kwiatkowska M, Piomelli D. The FAAH inhibitor URB-597 interferes with cisplatin- and nicotine-induced vomiting in the Suncus murinus (house musk shrew). Physiol Behav. 2009;97:121-124. [PubMed] [DOI] |
| 27. | Naidu PS, Booker L, Cravatt BF, Lichtman AH. Synergy between enzyme inhibitors of fatty acid amide hydrolase and cyclooxygenase in visceral nociception. J Pharmacol Exp Ther. 2009;329:48-56. [PubMed] [DOI] |
| 28. | Valitutti G, Duranti A, Mor M, Piersanti G, Piomelli D, Rivara S, Tontini A, Tarzia G, Traldi P. The collisional behavior of ESI-generated protonated molecules of some carbamate FAAH inhibitors isosteres and its relationships with biological activity. J Mass Spectrom. 2009;44:561-565. [PubMed] [DOI] |
| 29. | Capasso R, Izzo AA, Fezza F, Pinto A, Capasso F, Mascolo N, Di Marzo V. Inhibitory effect of palmitoylethanolamide on gastrointestinal motility in mice. Br J Pharmacol. 2001;134:945-950. [PubMed] [DOI] |
| 30. | Bisogno T, Melck D, De Petrocellis L, Bobrov MYu, Gretskaya NM, Bezuglov VV, Sitachitta N, Gerwick WH, Di Marzo V. Arachidonoylserotonin and other novel inhibitors of fatty acid amide hydrolase. Biochem Biophys Res Commun. 1998;248:515-522. [PubMed] [DOI] |
| 31. | Lichtman AH, Hawkins EG, Griffin G, Cravatt BF. Pharmacological activity of fatty acid amides is regulated, but not mediated, by fatty acid amide hydrolase in vivo. J Pharmacol Exp Ther. 2002;302:73-79. [PubMed] [DOI] |
| 32. | Katayama K, Ueda N, Kurahashi Y, Suzuki H, Yamamoto S, Kato I. Distribution of anandamide amidohydrolase in rat tissues with special reference to small intestine. Biochim Biophys Acta. 1997;1347:212-218. [PubMed] |
| 33. | Bisogno T, De Petrocellis L, Di Marzo V. Fatty acid amide hydrolase, an enzyme with many bioactive substrates. Possible therapeutic implications. Curr Pharm Des. 2002;8:533-547. [PubMed] [DOI] |
| 34. | Capasso R, Matias I, Lutz B, Borrelli F, Capasso F, Marsicano G, Mascolo N, Petrosino S, Monory K, Valenti M. Fatty acid amide hydrolase controls mouse intestinal motility in vivo. Gastroenterology. 2005;129:941-951. [PubMed] [DOI] |