修回日期: 2009-07-10
接受日期: 2009-07-13
在线出版日期: 2009-08-08
目的: 观察嗜酸乳杆菌治疗DSS诱导小鼠实验性结肠炎的疗效以及对转录因子STAT1, T-bet及GATA3的影响, 了解嗜酸乳杆菌的作用机制.
方法: 采用2.5% DSS诱导小鼠结肠炎模型, 70只Balb/c小鼠随机分为7组: 模型组、阴性对照组(菌粉保护剂组)、阳性对照组(美沙拉嗪组)、嗜酸乳杆菌低剂量组(1×109 CFU/L)、中剂量组(1×1010 CFU/L)、高剂量组(1×1011 CFU/L)、正常组. 用DAI评分和病理组织学积分检测各干预组疗效, RT-PCR法检测结肠组织中STAT1、T-bet、GATA3的表达水平, Western blot和免疫组织化学法检测结肠组织中T-bet的表达.
结果: 模型组小鼠DAI积分及组织病理学积分要明显高于正常组(均P<0.05), 嗜酸乳杆菌低、中、高剂量组和美沙拉嗪干预后, 小鼠DAI积分及组织病理学积分较模型组有明显下降(6.20±2.64, 5.00±1.21, 5.72±2.63, 5.81±1.32 vs 7.81±1.02; 4.25±2.05, 2.56±1.81, 2.20±1.12, 3.10±2.60 vs 5.80±2.94, 均P<0.05); 嗜酸乳杆菌低、中、高剂量组及美沙拉嗪干预后转录因子在核酸水平较模型组STAT1、T-bet的表达降低(均P<0.05); GATA3的表达升高(均P<0.05), 但仍低于正常组. 而T-bet的蛋白和免疫组织化学表达都与mRNA有相同趋势, 较模型组降低(0.27±0.04, 0.23±0.02, 0.18±0.04, 0.27±0.11 vs 0.30±0.04; 0.263±0.045, 0.234±0.015, 0.114±0.025, 0.252±0.024 vs 0.322±0.064, 均P<0.05). 其中又以嗜酸乳杆菌高剂量组效果最佳.
结论: 嗜酸乳杆菌对实验性结肠炎小鼠有治疗作用, 可抑制转录因子的表达, 其部分作用机制可能为通过抑制STAT1、T-bet信号分子的激活来抑制Th1型免疫反应, 减少对GATA3的抑制而发挥治疗作用.
引文著录: 任科雨, 卢放根, 吴小平, 王正根. 嗜酸乳杆菌对小鼠结肠炎的疗效及结肠黏膜转录因子表达的影响. 世界华人消化杂志 2009; 17(22): 2251-2258
Revised: July 10, 2009
Accepted: July 13, 2009
Published online: August 8, 2009
AIM: To investigate the therapeutic efficacy of Lactobacillus acidophilus against experimental murine colitis and its effects on the expression of STAT1, T-bet and GATA3.
METHODS: Experimental murine colitis was induced with 2.5% dextran sulfate sodium (DSS). A total of 70 mice were randomly and equally divided into seven groups: model control group, negative control group, mesalamine group, low-dose Lactobacillus acidophilus group, medium-dose Lactobacillus acidophilus group, high-dose Lactobacillus acidophilus group and normal control group. The expression of STAT1, T-bet and GATA3 mRNAs in colonic mucosa was measured by reverse transcription-polymerase chain reaction (RT-PCR). The expression of T-bet protein was measured by Western blot and immunohistochemistry (IHC). Colonic tissue damage was assessed using histopathologic score. The body weight and disease activity index (DAI) of all rats were evaluated daily.
RESULTS: Compared with the normal control group, the disease activity index and histopathologic scores were significantly increased (both P < 0.05) in the model control group. All doses of Lactobacillus acidophilus and mesalamine could significantly reduce disease activity index and histopathologic scores when compared to the model control group (6.20 ± 2.64, 5.00 ± 1.21, 5.72 ± 2.63 and 5.81 ± 1.32 vs 7.81 ± 1.02; 4.25 ± 2.05, 2.56 ± 1.81, 2.20 ± 1.12 and 3.10 ± 2.60 vs 5.80 ± 2.94; all P < 0.05). The expression levels of STAT1 and T-bet mRNAs in all Lactobacillus acidophilus groups (low-, medium- and high-dose) and mesalazine group were lower than that in the model control group (all P < 0.05). Moreover, the expression levels of T-bet protein in all Lactobacillus acidophilus groups and mesalazine group were also significantly lower than that in the model control group (0.27 ± 0.04, 0.23 ± 0.02, 0.18 ± 0.04 and 0.27 ± 0.11 vs 0.30 ± 0.04; 0.263 ± 0.045, 0.234 ± 0.015, 0.114 ± 0.025 and 0.252 ± 0.024 vs 0.322 ± 0.064; all P < 0.05). Optimum effects were achieved in the high-dose Lactobacillus acidophilus group.
CONCLUSION: Inhibition of transcriptional factors STAT1/T-bet activation maybe one mechanism contributing to the therapeutic effects of Lactobacillus acidophilus against ulcerative colitis.
- Citation: Ren KY, Lu FG, Wu XP, Wang ZG. Clinical efficacy of Lactobacillus acidophilus against experimental murine colitis and its effects on the expression of STAT1, T-bet and GATA3. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2251-2258
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2251.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2251
溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明的肠道非特异性的炎症, 研究表明细菌抗原激活肠黏膜免疫系统产生一系列致病性的细胞因子在UC的发病中有重要的作用[1]. 尤其是T淋巴细胞产生的细胞因子似乎启动和维持了肠道的慢性炎症[2-4]. Th1/Th2失衡及失控的Th1细胞对肠腔内微生物的反应是导致UC病理改变的重要原因. Th细胞分化成不同功能性的Th1/Th2亚群的过程被转录因子紧密调控, T-bet和GATA3分别是Th1/Th2极化的主要驱动者[5-6], 两者相互调节、相互抑制决定Th细胞分化的重要转录因子, 两者表达异常可以影响免疫应答, 导致免疫调控网络失衡. 而肠道内细菌抗原影响Th细胞的分化在肠道疾病中备受关注, 作为宿主-共生菌相互关系的维持者, 在T淋巴细胞, T-bet被IFN-γ/STAT1信号途径激活, 形成自我激活的反馈调节环路, 在机体的先天和获得性免疫中都发挥重要作用, T-bet与相关疾病的联系成为研究的热点, 已有学者提出可以将T-bet作为相关疾病免疫治疗的靶点[7]. 研究表明Th1类的细胞因子如IL-12、IFN-γ等是引起免疫损伤的重要细胞因子, 但是肠道菌群与炎症因子上游的转录因子的关系仍不明确. DSS是由蔗糖合成的一种硫酸多糖体, 国外1985年诱导动物UC成功, 并发现其病理改变比其他UC动物模型更接近人类UC之后便广泛用于实验性UC研究[8]. 胡仁伟 et al[9]、张永锋 et al[10]发现单次使用DSS可诱导Balb/c小鼠发生以结肠黏膜浅小溃疡为特征的急性炎症性病变, 该模型制作简便、经济, 易于复制, 是研究UC发病机制和药物治疗较理想的工具. 我们应用从肠道中分离的嗜酸乳杆菌对DSS诱导的急性实验性UC进行治疗, 观察转录因子T-bet、GATA3、STAT1的变化.
清洁级♀Balb/c小鼠70只, 周龄6-8 wk, 体质量20±2 g, 购于湖南农业大学东创实验动物科技公司, 24℃恒温恒湿, 12 h光照和12 h暗室清洁级动物饲养环境, 小鼠饮水经煮沸消毒, 饲料经60℃照射消毒. 嗜酸乳杆菌菌粉由本实验室自正常人肠道中自行分离鉴定冻干保存(批号JF20071126). 美沙拉嗪由法国爱的发制药集团提供(批号2001201). TRIzol Reagent系Invitrogen公司出品. 引物为广州英俊公司合成, 逆转录酶系Fermentas公司出品. 鼠抗T-bet多克隆抗体Santa Cruz公司(H-210): sc-21003. HRP-兔IgG: 北京中杉.
1.2.1 乳杆菌悬液、药液的配制: 乳杆菌菌粉用无菌生理盐水配成悬液, 比浊法调整菌悬液终浓度为1×1011 CFU/L, 梯度稀释法稀释成1×1010 CFU/L、1×109 CFU/L, 每只鼠每天每次给0.2 mL ig. 小鼠的药物剂量按人与各种动物之间的用药剂量换算[11], 美沙拉嗪用无菌生理盐水稀释成浓度为27.8 g/L的溶液, 每只鼠每天每次给0.2 mL ig.
1.2.2 小鼠疾病活动度积分的计算: 参照Hamamoto et al[12]标准, 每日观察小鼠的体质量、大便性状和隐血情况, 计算每只小鼠的疾病活动度(DAI)积分, 评估结肠炎活动程度, 见表1.
1.2.3 小鼠组织病理学积分的计算: 参照Dieleman et al的评分标准[13]对每只小鼠的结肠病理切片进行组织学损伤学评分. 由2位有经验的病理医生对结肠组织学损伤进行评分, 每个切片随机选取至少9个高倍视野(400倍)进行计分, 组织学损伤程度用炎症、病变深度、隐窝破坏评分与病变范围评分表示. 取平均值作为结肠组织学损伤计分.
1.2.4 Balb/c小鼠急性溃疡性结肠炎模型的建立、分组及取材: 清洁级Balb/c小鼠70只, 随机分成7组, 每组10只. 模型组: DSS造模+空针插胃; 阴性对照组: DSS造模+菌粉冻干保护剂(1.1 g/L)灌胃; 阳性对照组: DSS造模+美沙拉嗪(27.8 g/L)灌胃; 嗜酸乳杆菌低剂量组: DSS造模+1×109 CFU/L菌液灌胃; 嗜酸乳杆菌中剂量组: DSS造模+1×1010 CFU/L菌液灌胃; 嗜酸乳杆菌高剂量组: DSS造模+1×1011 CFU/L菌液灌胃; 正常组: 正常饮水. 参照Cooper et al方法[14], 给Balb/c小鼠2.5% DSS溶液自由饮用7 d造成急性溃疡性结肠炎模型, 正常组予以正常饮食饮水. 观察小鼠每天的一般情况、体质量变化和粪便性状; 邻联甲苯胺法检测小鼠粪便隐血情况; 7 d后处死小鼠, 分离结肠, 沿肠系膜纵轴剪开肠腔, 剪取距肛门2 cm左右病变的结肠段, 纵向剖开冰生理盐水冲洗干净后, 一部分结肠组织经中性甲醛溶液固定后, 常规脱水、浸蜡、透明、包埋, 4 μm厚度切片, 行免疫组织化学染色. 其余部分结肠组织迅速置于液氮中然后转入-80℃冰箱保存, 留待行T-bet、STAT1、GATA3的表达检测.
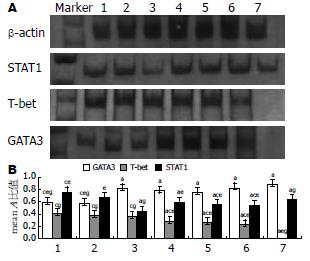
1.2.5 RT-PCR检测T-bet mRNA表达: TRIzol法提取组织的RNA进RT-PCR扩增. T-bet正义引物5'-GCCAGGGAACCGCTTATATG-3', 反义引物5'-GACGATCATCTGGGTCACATTGT-3', 扩增产物136 bp; GATA3正义引物5'-GGGTTCGGATGTAAGTCG-3', 反义引物5'-AGATGTGGCTCAGGGATG-3', 扩增产物320 bp; STAT1正义引物5'-CACCAGAACCGATGGAGCTT-3', 反义引物5'-TCCGGGACATCTCATCAAACT-3', 扩增产物150 bp. TRIzol一步法提取组织总RNA, 取RNA产物10 mg, 用M-MLV逆转录酶合成cDNA, 然后用PCR扩增仪进行PCR反应. 用聚丙烯凝胶电泳, 电泳结束后银染置凝胶成像系统中进行分析, 计算与内参β-actin的比值用以校正.
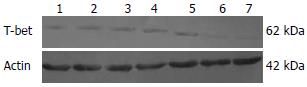
1.2.6 Western blot检测结肠组织T-bet蛋白水平的表达: 取结肠组织100 mg, 加入蛋白裂解液制备蛋白样品. 一抗(鼠抗T-bet多克隆)抗体浓度1:300.
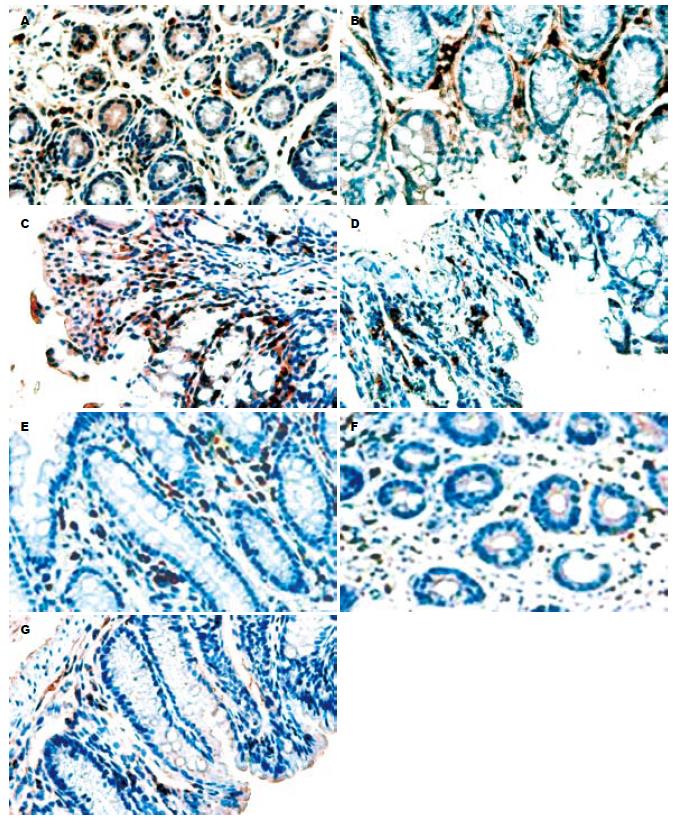
1.2.7 免疫组织化学SP法检测结肠组织T-bet表达: 结肠末端(距肛门1 cm)处剪取0.5 cm长结肠, 0.4%甲醛溶液浸泡, 石蜡包埋、切片, 按照SP免疫组织化学染色试剂盒说明步骤完成免疫组织化学染色, 以PBS替代一抗作为阴性对照. 在光镜下观察免疫组织化学染色结果, 染色阳性表达为胞核呈棕褐色颗粒. 每张切片随机选取5个高倍视野, 计数10 000个细胞, 计算阳性细胞百分比.
统计学处理 结果以mean±SD表示, 统计方法采用SPSS11.5软件进行分析, 组间两两比较, 采用t检验分析, P<0.05为差异具有显著性.
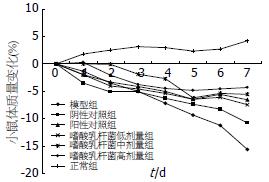
正常组小鼠毛色光滑、精神活跃, 大便成形无腹泻便血, 体质量随着时间稍有波动, 呈逐渐增加趋势; 饮用DSS小鼠出现毛色耸立干枯, 精神萎靡, 活动减少, 大便稀软甚至腹泻, 并有粪便隐血阳性和体质量下降等, 在第7天体质量下降至最低, 其余各干预组小鼠体质量也逐渐降低, 以模型组体质量下降最明显; 经嗜酸乳杆菌和美沙拉嗪治疗后, 小鼠体质量下降变缓, 腹泻和粪便隐血情况好转. 在第7天各干预组体质量下降要明显低于模型组(P<0.05), 嗜酸乳杆菌高剂量组对体质量减轻的保护强于中低剂量组和美沙拉嗪(P>0.05, 图1).
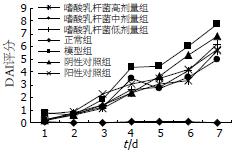
正常组小鼠疾病活动度积分(DAI积分: 综合粪便性状、隐血和体质量变化)始终维持在零水平, 模型组小鼠DAI积分显著增高, 呈逐渐升高趋势, 各干预组小鼠DAI积分也逐渐增高, 在低于模型组小鼠DAI积分水平波动; 在第7天模型组小鼠DAI评分达到7.81分, 美沙拉嗪治疗组DAI评分下降至5.81分, 嗜酸乳杆菌高中低剂量组DAI评分分别为5.72、5.00、6.20分, 明显低于模型组(P<0.05), 而各干预组疗效相当, 无明显差异(P>0.05); 其中又以嗜酸乳杆菌中剂量组DAI积分降低最明显(图2).
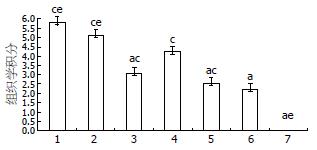
图3 为各组小鼠第7天的结肠的炎症浸润评分、病变深度评分、隐窝破坏评分及总体组织损伤评分直方图. 由图可见, 模型组病理组织学积分达到5.80分, 光镜下可见黏膜缺损, 上皮细胞缺失, 腺体破坏严重, 结构紊乱, 杯状细胞严重减少, 炎症细胞浸润. 阳性对照组应用美沙拉嗪治疗后组织病理学积分下降至3.10分, 嗜酸乳杆菌治疗后积分下降更明显, 黏膜损伤程度轻, 炎症细胞浸润减少, 与模型组相比较有明显差异(P<0.05). 但嗜酸乳杆菌低剂量组治疗效果不明显, 其病理学积分要低于模型组(P>0.05), 但高于美沙拉嗪和中剂量组、高剂量组(图3-4).
应用凝胶成像分析系统进行密度扫描, 用目的基因与内参的比值来表示目的定量基因mRNA的含量. 同模型组相比, 美沙拉嗪和嗜酸乳杆菌各治疗组中T-bet、STAT1的表达显著下降, 而GATA3的表达量升高, 有明显差异(P<0.05). 嗜酸乳杆菌高剂量组中T-bet的表达量最低(P<0.05), 而美沙拉嗪组中STAT1的表达量最低(P<0.05, 图5).
Western blot结果显示嗜酸乳杆菌中低剂量组和美沙拉嗪组与模型组T-bet表达水平相当(P>0.05); 嗜酸乳杆菌高剂量组T-bet表达水平下降至与正常水平相当, 与模型组以及嗜酸乳杆菌低剂量组和美沙拉嗪组差异明显(P<0.05, 图6, 表2).
以胞核见棕褐色为阳性, 在400倍视野下采图应用分析测量图像软件ImagePro-Plus 6.0进行半定量测量其平均光密度. 其中正常组为0.065±0.002, 阴性对照组和模型组分别为0.288±0.078、0.322±0.074, 模型组T-bet表达量最高, 较正常组和各干预组明显增多(P<0.05), 嗜酸乳酸杆菌治疗后, T-bet表达量减少, 以益生菌高剂量组效果最为显著, T-bet表达量为0.114±0.025.
在溃疡性结肠炎的治疗中美沙拉嗪仍然是经典的一线治疗药物, 临床缓解率只有50%左右, 而且在治疗过程中会出现复发的现象. 由于UC是病因不明的慢性复发性的肠道炎症, 其迁延不愈和反复发作的特点需要长期服药, 停药后易复发, 患者对药物的不耐受和不良反应成了制约其疗效的关键因素之一. 这为寻找新的治疗UC的高效低毒的药物提供契机. 近年关于肠腔内源性微生物在溃疡性结肠炎病发病中的地位获得越来越广泛的认同, 有研究发现菌群失调是溃疡性结肠炎的重要病因之一, 大量的动物实验[15-17]倾向于益生菌减少、致病菌增多触发了肠道的炎症反应, 在诱导实验性结肠炎小鼠模型的动物实验中发现, 无菌动物难以成模[18], 也提示肠道菌群可能参与UC的发病. 同时在对UC患者的肠道菌群分析中也发现, 存在乳杆, 双歧杆菌等保护性菌群的减少, 而肠球菌、肠杆菌等致病菌增多的现象[19-22], 而给予乳杆, 双歧杆菌等益生菌治疗, 可以改变肠道菌群组成, 减轻黏膜炎症[21,23]. 于是益生菌的应用逐渐成为溃疡性结肠炎治疗的一个新的方向. 目前益生菌在临床主要用于活动期的辅助治疗, 而麻继臣 et al[24]总结国内外数据库关于益生菌用于UC缓解期的维持治疗RCT的系统分析表明, 益生菌和美沙拉嗪均可显著降低缓解期UC的复发率, 二者无显著性差异也说明益生菌在UC的治疗中具有非常重要的作用.
本实验结果表明, 嗜酸乳杆菌在延缓体质量下降, 改善DAI积分和病理学积分方面接近或者优于美沙拉嗪, 呈剂量依赖性. 也有研究发现保加利亚乳杆菌(L. bulgaricus)治疗乙酸诱导的大鼠结肠炎有类似的结果[25], 而LGG不仅不能改善肠道的炎性症状 ,而且还会使DSS诱导的大鼠结肠炎进一步恶化[26], 这些研究结果的不一致性说明乳杆菌属的不同菌株对UC有相同甚至相反的治疗作用, 是否不同种乳杆菌治疗作用的差异与不同的动物模型以及不同菌株在肠道中的寄存部位和代谢特征同值得进一步研究. 而本实验发现的嗜酸乳杆菌对实验性UC有治疗作用是否能作为治疗UC的或者辅助治疗药物也值得进一步研究.
免疫学异常在UC发生发展中的作用已得到公认, 表现为细胞因子表达的异常, 总的来说是抗炎因子的产生减少和致炎因子的产生增多[27-30]. 细胞因子产生的调节主要是通过在细胞水平对Th1/Th2细胞分化的调节作用形成的. 最近的研究多集中于益生菌通过调节核因子NF-κB通路[31-33]而对UC黏膜免疫反应的调控, 这也提示益生菌可能对核因子的产生和转位有一定的影响. 本研究发现, 嗜酸乳杆菌干预后STAT1、T-bet表达水平下降而GATA3表达水平升高, 说明嗜酸乳杆菌对机体免疫学作用可能是通过抑制STAT1、T-bet的表达, 阻断UC小鼠Th1型免疫反应, 而趋向于保护性的Th2型反应. 而Peña et al[34]和McCarthy et al[35]的研究证实给予IL-10敲除结肠炎大鼠喂饲罗伊氏乳杆菌, 干酪乳杆菌和L. salivarius 433118能够减少IL-12.IFN-γ的分泌, 减轻组织损伤, 这也从另外一个侧面反映了乳酸杆菌可以阻断Th1型免疫反应, 从而达到治疗结肠炎的目的. 此外有趣的是, 在研究T-bet在肠黏膜中的表达发现, T-bet主要分布在炎症损伤最明显的固有层, 大部分聚集在腺体间和炎症细胞浸润的部位, 应用美沙拉嗪和嗜酸乳杆菌干预后, 在黏膜炎症减轻、炎症细胞浸润减少的同时伴随着T-bet在上述部位活化减少, 说明T-bet很可能在UC免疫学损伤中起重要作用. 同时也发现, 在对STAT1表达的干预中, 美沙拉嗪的抑制作用最强. 美沙拉嗪作用于炎症最明显的固有层, 其作用机制是通过抗炎症介质的产生从而发挥对机体免疫的间接调节作用的. 而嗜酸乳杆菌仅黏附于黏膜表面不进入黏膜内, 可能是通过改善肠黏膜屏障减少抗原物质的进入从而减少STAT1的活化发挥治疗作用的. 是否是由于美沙拉嗪和嗜酸乳杆菌作用位点的不同而引起作用效果的差异还需进一步研究.
总之, 嗜酸乳杆菌对UC小鼠有治疗作用, 其中以1×1011 CFU/L浓度级效果最佳, 嗜酸乳杆菌对UC的治疗作用可能与抑制核转录因子T-bet, STAT1的活化, 增加GATA3的活化有关.
溃疡性结肠炎(UC)是一种病因不明的肠道非特异性的炎症, 研究表明细菌抗原激活肠黏膜免疫系统产生一系列致病性的细胞因子在UC的发病中有重要的作用. 尤其是T淋巴细胞产生的细胞因子似乎启动和维持了肠道的慢性炎症. Th细胞分化成不同功能性的Th1/Th2亚群的过程被转录因子紧密调控, T-bet和GATA3分别是Th1/Th2极化的主要驱动者, 两者相互调节、相互抑制决定Th细胞分化的重要转录因子, 两者表达异常可以影响免疫应答, 导致免疫调控网络失衡.
戈之铮, 教授, 上海交通大学医学院附属仁济医院消化科
益生菌已被用于UC的治疗, 并且被证实有一定的效果, 但其具体的作用机制仍然不明确.
胡仁伟 et al、张永锋 et al发现单次使用DSS可诱导Balb/c小鼠发生以结肠黏膜浅小溃疡为特征的急性炎症性病变, 该模型制作简便、经济, 易于复制, 是研究UC发病机制和药物治疗较理想的工具.
本文应用自人体肠道中分离的嗜酸乳杆菌干预UC小鼠, 从转录因子水平探讨其可能的作用机制.
嗜酸乳杆菌对UC小鼠有治疗作用, 其中以1×1011 CFU/L浓度级效果最佳, 嗜酸乳杆菌对UC的治疗作用可能与抑制核转录因子T-bet, STAT1的活化, 增加GATA3的活化有关.
本文拟通过观察嗜酸乳杆菌治疗DSS诱导实验性结肠炎的疗效以及对转录因子STAT1/T-bet/GATA3的影响, 希望从免疫调节的核因子转录水平来了解嗜酸乳杆菌的作用机制, 为临床提高嗜酸乳杆菌治疗溃疡性结肠炎的理论依据.
编辑: 李军亮 电编:何基才
| 1. | Shanahan F. Inflammatory bowel disease: immunodiagnostics, immunotherapeutics, and ecotherapeutics. Gastroenterology. 2001;120:622-635. [PubMed] [DOI] |
| 2. | Atreya R, Mudter J, Finotto S, Müllberg J, Jostock T, Wirtz S, Schütz M, Bartsch B, Holtmann M, Becker C. Blockade of interleukin 6 trans signaling suppresses T-cell resistance against apoptosis in chronic intestinal inflammation: evidence in crohn disease and experimental colitis in vivo. Nat Med. 2000;6:583-588. [PubMed] [DOI] |
| 3. | Fuss IJ, Marth T, Neurath MF, Pearlstein GR, Jain A, Strober W. Anti-interleukin 12 treatment regulates apoptosis of Th1 T cells in experimental colitis in mice. Gastroenterology. 1999;117:1078-1088. [PubMed] [DOI] |
| 4. | Plevy SE, Landers CJ, Prehn J, Carramanzana NM, Deem RL, Shealy D, Targan SR. A role for TNF-alpha and mucosal T helper-1 cytokines in the pathogenesis of Crohn's disease. J Immunol. 1997;159:6276-6282. [PubMed] |
| 5. | Szabo SJ, Kim ST, Costa GL, Zhang X, Fathman CG, Glimcher LH. A novel transcription factor, T-bet, directs Th1 lineage commitment. Cell. 2000;100:655-669. [PubMed] [DOI] |
| 6. | Kurata H, Lee HJ, McClanahan T, Coffman RL, O'Garra A, Arai N. Friend of GATA is expressed in naive Th cells and functions as a repressor of GATA-3-mediated Th2 cell development. J Immunol. 2002;168:4538-4545. [PubMed] |
| 7. | Weigmann B, Neurath MF. T-bet as a possible therapeutic target in autoimmune disease. Expert Opin Ther Targets. 2002;6:619-622. [PubMed] [DOI] |
| 8. | Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 1990;98:694-702. [PubMed] |
| 12. | Hamamoto N, Maemura K, Hirata I, Murano M, Sasaki S, Katsu K. Inhibition of dextran sulphate sodium (DSS)-induced colitis in mice by intracolonically administered antibodies against adhesion molecules (endothelial leucocyte adhesion molecule-1 (ELAM-1) or intercellular adhesion molecule-1 (ICAM-1). Clin Exp Immunol. 1999;117:462-468. [PubMed] [DOI] |
| 13. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 14. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 15. | Schultz M, Veltkamp C, Dieleman LA, Grenther WB, Wyrick PB, Tonkonogy SL, Sartor RB. Lactobacillus plantarum 299V in the treatment and prevention of spontaneous colitis in interleukin-10-deficient mice. Inflamm Bowel Dis. 2002;8:71-80. [PubMed] [DOI] |
| 16. | McCarthy J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan EE, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK. Double blind, placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance. Gut. 2003;52:975-980. [PubMed] [DOI] |
| 17. | Conte MP, Schippa S, Zamboni I, Penta M, Chiarini F, Seganti L, Osborn J, Falconieri P, Borrelli O, Cucchiara S. Gut-associated bacterial microbiota in paediatric patients with inflammatory bowel disease. Gut. 2006;55:1760-1767. [PubMed] [DOI] |
| 18. | Madsen KL, Doyle JS, Jewell LD, Tavernini MM, Fedorak RN. Lactobacillus species prevents colitis in interleukin 10 gene-deficient mice. Gastroenterology. 1999;116:1107-1114. [PubMed] [DOI] |
| 19. | 崔 海宏, 陈 村龙, 孙 勇, 王 亚东, 张 耀东, 杨 玉捷, 王 群英, 潘 令嘉. 炎症性肠病患者肠黏膜菌群改变及抗体反应. 胃肠病学和肝脏病学杂志. 2003;12:276-278. |
| 21. | Macfarlane S, Furrie E, Kennedy A, Cummings JH, Macfarlane GT. Mucosal bacteria in ulcerative colitis. Br J Nutr. 2005;93 Suppl 1:S67-S72. [PubMed] [DOI] |
| 22. | Bullock NR, Booth JC, Gibson GR. Comparative composition of bacteria in the human intestinal microflora during remission and active ulcerative colitis. Curr Issues Intest Microbiol. 2004;5:59-64. [PubMed] |
| 23. | Cui HH, Chen CL, Wang JD, Yang YJ, Cun Y, Wu JB, Liu YH, Dan HL, Jian YT, Chen XQ. Effects of probiotic on intestinal mucosa of patients with ulcerative colitis. World J Gastroenterol. 2004;10:1521-1525. [PubMed] |
| 25. | Sengül N, Aslím B, Uçar G, Yücel N, Işik S, Bozkurt H, Sakaoğullari Z, Atalay F. Effects of exopolysaccharide-producing probiotic strains on experimental colitis in rats. Dis Colon Rectum. 2006;49:250-258. [PubMed] [DOI] |
| 26. | Geier MS, Butler RN, Giffard PM, Howarth GS. Lactobacillus fermentum BR11, a potential new probiotic, alleviates symptoms of colitis induced by dextran sulfate sodium (DSS) in rats. Int J Food Microbiol. 2007;114:267-274. [PubMed] [DOI] |
| 29. | Nielsen OH, Kirman I, Rüdiger N, Hendel J, Vainer B. Upregulation of interleukin-12 and -17 in active inflammatory bowel disease. Scand J Gastroenterol. 2003;38:180-185. [PubMed] [DOI] |
| 30. | Kim N, Kunisawa J, Kweon MN, Eog Ji G, Kiyono H. Oral feeding of Bifidobacterium bifidum (BGN4) prevents CD4(+) CD45RB(high) T cell-mediated inflammatory bowel disease by inhibition of disordered T cell activation. Clin Immunol. 2007;123:30-39. [PubMed] [DOI] |
| 31. | Bai AP, Ouyang Q, Xiao XR, Li SF. Probiotics modulate inflammatory cytokine secretion from inflamed mucosa in active ulcerative colitis. Int J Clin Pract. 2006;60:284-288. [PubMed] [DOI] |
| 33. | Kim YG, Ohta T, Takahashi T, Kushiro A, Nomoto K, Yokokura T, Okada N, Danbara H. Probiotic Lactobacillus casei activates innate immunity via NF-kappaB and p38 MAP kinase signaling pathways. Microbes Infect. 2006;8:994-1005. [PubMed] |
| 34. | Peña JA, Rogers AB, Ge Z, Ng V, Li SY, Fox JG, Versalovic J. Probiotic Lactobacillus spp. diminish Helicobacter hepaticus-induced inflammatory bowel disease in interleukin-10-deficient mice. Infect Immun. 2005;73:912-920. [PubMed] [DOI] |
| 35. | McCarthy J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan EE, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK. Double blind, placebo controlled trial of two probiotic strains in interleukin 10 knockout mice and mechanistic link with cytokine balance. Gut. 2003;52:975-980. [PubMed] [DOI] |