修回日期: 2009-07-03
接受日期: 2009-07-06
在线出版日期: 2009-08-08
目的: 探讨小干扰RNA降低环氧化酶-2(cyclooxygenase-2, COX-2)基因对肝癌细胞HepG2增殖与细胞外信号调节蛋白激酶(ERK)表达的影响.
方法: 将人肝癌细胞株HepG2细胞分为4组: COX-2 siRNA干预组、阴性对照siRNA组、空脂质体组、空白对照组. 脂质体转染法将COX-2 siRNA转染入HepG2细胞; MTT法测定转染后24, 48, 72 h的增殖抑制率; 流式细胞仪测定转染后24 h的细胞周期分布; 半定量RT-PCR与Western blot检测转染后24 h肝癌细胞COX-2和ERK1/2的表达.
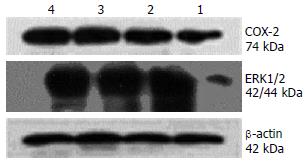
结果: COX-2 siRNA干预组的增殖抑制率明显高于阴性对照组和空脂质体转染组(67.08% vs 2.45%, 1.56%, 均P<0.01); COX-2 siRNA干预组G1期细胞明显增多, 与空白组、空脂质体组及阴性对照组相比, 均具有显著差异(72.80% vs 50.27%, 50.97%, 53.13%, 均P<0.05); RT-PCR显示: COX-2 siRNA干预组COX-2, ERK1, ERK2 mRNA表达(0.58, 0.32, 0.48)明显降低, 与空白组(0.93, 0.76, 0.72)、空脂质体组(0.89, 0.64, 0.67)及阴性对照组(0.83, 0.71, 0.65)比较, 差异具有统计学意义(均P<0.05), Western blot显示以上各项指标表达趋势与RT-PCR相同.
结论: 小干扰RNA可降低肝癌细胞HepG2的COX-2基因表达, 抑制肝癌细胞的生长. COX-2促进肝癌生长可能与ERK1/2通路调控有关.
引文著录: 葛金华, 朱月永, 刘豫瑞, 江家骥, 董菁. siRNA降低COX-2基因表达对肝癌细胞系HepG2增殖的影响. 世界华人消化杂志 2009; 17(22): 2244-2250
Revised: July 3, 2009
Accepted: July 6, 2009
Published online: August 8, 2009
AIM: To explore the effects of siRNA-mediated downregulation of COX-2 gene expression on the proliferation of hepatocellular carcinoma HepG2 cells.
METHODS: HepG2 cells were divided into four groups: COX-2 siRNA intervention group, control siRNA intervention group, empty liposome group and blank control group. COX-2 siRNA was transfected into HepG2 cells by lipofection. Cell proliferation inhibition was measured at 24, 48 and 72 h after transfection by MTT (thiazolyl blue) assay. The changes in cell cycle distribution were detected at 24 h after transfection by flow cytometry. The expression levels of COX-2 and ERK1/2 mRNAs and proteins were detected at 24 h after transfection by semiquantitative RT-PCR and Western blot, respectively.
RESULTS: The proliferation inhibition rate achieved in the COX-2 siRNA intervention group was higher than those in the control siRNA intervention group and empty liposome group (67.08% vs 2.45% and 1.56%, both P < 0.01). The percentage of HepG2 cells arrested at G1 phase (DNA presynthetic phase) was increased in the COX-2 siRNA intervention group as compared to the control siRNA intervention group, empty liposome group and blank control group (72.80% vs 50.27%, 50.97% and 53.13%, all P < 0.05). Semiquantitative RT-PCR analysis showed that the expression levels of COX-2, ERK1 and ERK2 mRNAs in the COX-2 siRNA intervention group were significantly decreased as compared to the control siRNA intervention group, empty liposome group and blank control group (0.58 vs 0.83, 0.89 and 0.93; 0.32 vs 0.71, 0.64 and 0.76; 0.48 vs 0.65, 0.67 and 0.72; all P < 0.05). Similar results were obtained for protein expression as revealed by Western blot analysis.
CONCLUSION: siRNA can downregulate the expression of COX-2 gene in hepatocellular carcinoma HepG2 cells and inhibit their proliferation. COX-2 promotes the development of primary hepatic carcinoma perhaps through regulation of ERK1/2 pathway.
- Citation: Ge JH, Zhu YY, Liu YR, Jiang JJ, Dong J. siRNA-mediated downregulation of COX-2 gene expression alters the proliferation of hepatocellular carcinoma HepG2 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2244-2250
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2244.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2244
肝癌的病因和发病机制复杂, 可能与乙型肝炎病毒[1]、丙型肝炎病毒[2]、黄曲霉毒素[3]、饮用水污染[4]、遗传因素[5]等多种因素的综合作用有关. 近年来, 从基因水平来研究原发性肝癌的致病因素也成为学者们的一个热点课题.
环氧化酶-2(cyclooxygenase-2, COX-2)是前列腺素(prostaglandin, PG)合成的限速酶. 已证实COX-2在多种癌前病变及恶性肿瘤中表达增高[6-18], 参与恶性肿瘤的演进. 近年来一些研究[19-21]发现COX-2在原发性肝癌(primary hepatic carcinoma, PHC)表达增高, 推测其可能参与了PHC的发生及进展. 另有研究提示COX-2可经其催化产物PG刺激ERK1/2表达及活化, 促进胰腺癌细胞的增殖[22]. 我们推测在肝癌细胞中, 过度表达的COX-2也可经其催化产物刺激ERK1/2表达及活化, 进而促进肝癌细胞的增殖. 因此, 本课题通过小干扰RNA(small interfering RNA, siRNA)降低COX-2基因表达, 观察其对肝癌细胞HepG2增殖的影响, 并探讨其可能的作用机制, 旨在为治疗肝癌的新手段提供实验依据.
人肝癌细胞株HepG2细胞购自上海科学院细胞中心. siRNA及转染试剂Lipofectamine2000购自广州市锐博生物科技有限公司. COX-2siRNA序列如下: 靶序列: 5'-GCT GGG AAG CCT TCT CTA A-3'; 正义链: 5'-GCU GGG AAG CCU UCU CUA AdT dT-3'; 反义链: 3'-dTd TCG ACC CUU CGG AAG AGA UU-5'. RPMI 1640培养基、胎牛血清购自美国Gibco公司. PCR引物、2×Taq PCR Master Mix购自上海鼎安生物科技有限公司. COX-2、ERK1/2抗体、辣根过氧化物酶标记的山羊抗小鼠IgG购自Santa Cruz公司.
1.2.1 细胞培养和siRNA转染: 人肝癌细胞株HepG2细胞在含100 mL/L胎牛血清RPMI 1640培养液中培养, 2.5 g/L胰蛋白酶消化. 1×107/L细胞接种于细胞培养板(MTT使用96孔板, 余实验用6孔板). 根据说明书建议, 将siRNA浓度稀释为50 nmol/L, 用脂质体转染法转染siRNA. 实验分为4组, COX-2 siRNA干预组、阴性对照siRNA组、空脂质体组、空白对照组.
1.2.2 MTT法测定细胞增殖抑制率: 转染后分别培养24、48、72 h. MTT法测定细胞增殖抑制率, 运用酶联免疫检测仪测定490 nm处的吸光度(A值), 按照公式计算细胞增殖抑制率(cells inhibitor, CI)/% = 1-(处理组平均A值/空白组平均A值)×100%.
1.2.3 流式细胞仪测定细胞周期分布: 转染后培养24 h, 收集细胞. 750 mL/L乙醇固定30 min, 碘化丙啶(PI)染色, 避光, 室温作用30 min, 过滤, 调整细胞浓度为1×106/L单细胞悬液, 于流式细胞仪上检测, 用Coulter分析系统对检测结果进行分析.
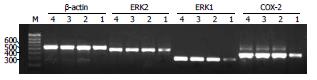
1.2.4 半定量RT-PCR检测COX-2、ERK1/2 mRNA的表达: 收集转染后培养24 h的各组细胞, 提取细胞总RNA并逆转录成cDNA. PCR引物序列如下: COX-2(373 bp)上游引物: 5'-CCT ACT GGA AGC CAA GCA CTT T-3'; 下游引物: 5'-TAT GAC TCC TTT CTC CGC AAC A-3'; ERK1(332 bp)上游引物: 5'-TAC ACG CAG TTG CAG TAC ATC G-3'; 下游引物: 5'-CGC AGG ATC TGG TAG AGG AAG T-3'; ERK2(499 bp)上游引物: 5'-GGA GCT TGT GGA AAT ACC TTG G-3'; 下游引物: 5'-GAC GCA GTG TTC CTC TCT GCT A-3'; β-Actin(556 bp)上游引物: 5'-AAA GAC CTG TAC GCC AAC ACA G-3'; 下游引物: 5'-TTT TAG GAT GGC AAG GGA CTT C-3'. COX-2、ERK1/2、β-actin的反应参数均为: 94℃ 5 min(预变性), 94℃ 30 s(变性), 58℃ 30 s(退火), 72℃ 30 s(延伸)30个循环, 最终延伸72℃ 7 min. 取PCR产物5 μL加入1.5%琼脂糖凝胶, 在110 mV电压条件下进行电泳40 min, 自动凝胶成像分析仪下进行灰度扫描并观察拍照, 并用Quantity One软件进行灰度值的比较. 以β-actin作为内对照, 计算记录COX-2、ERK1/2的相对含量, 结果以COX-2、ERK1/2条带密度占β-actin条带密度的百分率表示.
1.2.5 Western blot测定COX-2、ERK1/2蛋白的表达: 收集各组细胞, 提取总蛋白, 将样品加于100 g/L不连续SDS聚丙烯酰胺凝胶加样孔中, 起初电压为80 V, 当溴酚蓝前沿进入分离胶后, 把电压提高到120 V, 继续电泳直至分离胶底部. 电转移至硝酸纤维素膜, 封闭, 与COX-2抗体(1:100)、ERK1抗体(1:100)、ERK2抗体(1:100)4℃孵育过夜, 辣根过氧化物酶标记的山羊抗小鼠IgG(1:4000)室温摇晃1 h, 显色, 暗室曝光, 洗片. 显影信号的强弱用密度分析值反映.
统计学处理 测定值以mean±SD. 采用SPSS11.0统计软件包分析. 组间比较采用多样本均数的One-way ANOVA检验. 两组均数比较采用t检验. P<0.05表示差异有统计学意义, P<0.01表示有显著性差异.
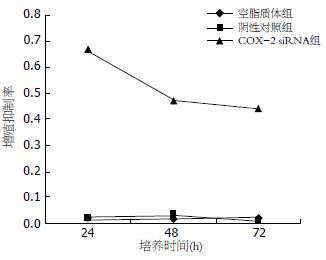
COX-2siRNA转染对HepG2细胞增殖有明显抑制作用. 增殖抑制率明显高于阴性对照组、空脂质体组(P<0.01). 同时, 阴性对照组与空脂质体组之间的差异无显著性(P>0.05). COX-2 siRNA组24 h增殖抑制率高于48及72 h(P<0.05, 表1, 图1).
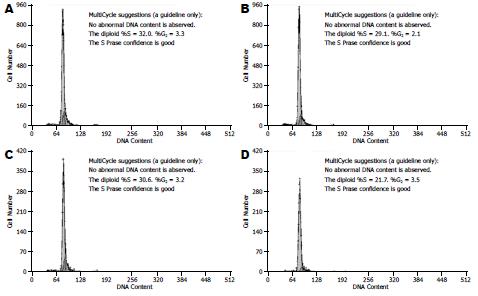
siRNA组细胞G1期(DNA合成前期)细胞明显增多, S期(DNA合成期)细胞明显减少, 与空白组、空脂质体组及阴性对照组相比, 均具有明显差异(表2, 图2). 提示COX-2 siRNA对HepG2细胞的细胞周期具有明显的G1/S阻滞作用.
| 分组 | G1 | S | G2/M |
| 空白对照组 | 50.27±2.62 | 43.97±5.89 | 5.76±3.44 |
| 空脂质体组 | 50.97±1.31 | 42.60±3.12 | 6.43±1.96 |
| 阴性对照组 | 53.13±1.87 | 39.77±2.49 | 7.10±0.96 |
| COX-2 siRNA组 | 72.80±2.07 | 22.57±0.85a | 4.63±1.23 |
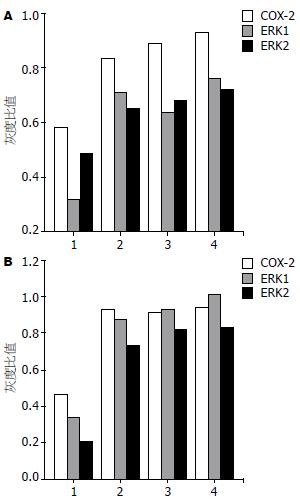
与空白对照组、空脂质体组及阴性对照组比较, COX-2 siRNA组的COX-2、ERK1/2 mRNA表达明显降低, 差异具有统计学意义(P<0.05), 空脂质体组、阴性对照组与空白对照组之间差异无统计学意义(P>0.05, 表3, 图3, 图4A).
| 分组 | mRNA | 蛋白 | ||||
| COX-2 | ERK1 | ERK2 | COX-2 | ERK1 | ERK2 | |
| 空白对照组 | 0.93±0.029 | 0.76±0.104 | 0.72±0.052 | 0.94±0.024 | 1.02±0.080 | 0.83±0.150 |
| 空脂质体组 | 0.89±0.049 | 0.64±0.037 | 0.67±0.029 | 0.92±0.090 | 0.93±0.116 | 0.82±0.212 |
| 阴性对照组 | 0.83±0.049 | 0.71±0.048 | 0.65±0.035 | 0.93±0.045 | 0.87±0.104 | 0.73±0.105 |
| COX-2 siRNA组 | 0.58±0.122a | 0.32±0.071a | 0.48±0.013a | 0.46±0.029b | 0.34±0.029b | 0.21±0.068b |
RNA干扰技术(RNA interference, RNAi)是指由短双链RNA诱导的同源mRNA的降解过程, 可使基因的表达受到抑制. 外源性或内源性双RNA(double-stranded RNA, dsRNA)导入细胞后, 激活细胞内的一种被称作Dicer的酶复合物, 该酶复合物由核酸内切酶和解旋酶等组成. 他能识别异常双链RNA, 并将其切割成短双链RNA(21-23 bp), 即siRNA. siRNA对目标RNA的干涉包括: siRNA转染和目标RNA含量或蛋白质表达水平的分析.
本实验利用阳离子脂质体将COX-2 siRNA转染入肝癌细胞, MTT法观察HepG2细胞系增殖特性的变化. 结果显示: COX-2 siRNA转染入肝癌细胞24、48、72 h后, 肝癌细胞增殖均被明显抑制, 尤其以转染后24 h最为显著, 我们认为其原因可能为: 脂质体转染是一种即时转染方法, 起效快、耗时较短, 转染后24 h抑制效率最高; 随着细胞的增殖, 48、72 h后转染细胞逐渐被未转染细胞稀释, 导致抑制率逐渐下降. Cheng et al[23]采用选择性COX-2抑制剂NS-398作用于肝癌细胞, RT-PCR及Western blot检测COX-2表达降低后, 肝癌细胞增殖明显受抑制. 同我们的实验结果类似, 证实了COX-2对肝癌细胞增殖的促进作用.
流式细胞仪检测转染后24 h细胞周期结果显示: 转染COX-2 siRNA的肝癌细胞72.80%被阻滞于G0/G1期, 无法进入S、G2及M期, 有丝分裂停止, COX-2 siRNA降低COX-2基因表达, 可有效阻断肝癌细胞的有丝分裂. Wang et al[24]在喉癌细胞中做了类似实验, 他们用RNA干扰技术沉默COX-2基因表达, 使得喉癌细胞阻滞与G0/G1期, 抑制喉癌细胞有丝分裂进程. 进一步证实了COX-2对癌细胞有丝分裂的促进作用.
虽已证实COX-2在肝癌进程中有重要作用, 参与了多个环节, 但其确切机制尚不清楚. 细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase, ERK)包括ERK1和ERK2. 在肿瘤细胞中, 各种因素[25-26]激活ERK1/2后, 活化的ERK1/2激酶移位到细胞核, 调控信号转导途径的关键效应分子(如NF-κB、AP-1、c-Myc等)的表达, 在肿瘤细胞的增殖中起重要作用[27]. Yu et al[28]在食管鳞状上皮细胞癌研究中证实: ERK1/2受到COX-2催化生成的产物前列腺E2(prostaglandin E2, PGE2)刺激后被激活, 活化的ERKl/2将信号从细胞表面受体转导至胞核, 最终促进食管鳞癌细胞增殖. 因此, 我们有理由相信, 在肝癌细胞中, 过量表达的COX-2同样可以通过其催化产物PG, 刺激ERKl/2表达及活化, 通过ERK1/2信号传导通路促进肝癌细胞的增殖, 而COX-2作为ERKl/2活化的促进因素被降低表达后, ERKl/2表达将有可能减少.
为了证明这一观点, 我们将COX-2 siRNA转染入肝癌细胞, 24 h后RT-PCR及Western blot检测COX-2、ERKl/2的表达, 结果显示: COX-2、ERKl/2较对照组显著减少, 而3个对照组间比较无明显差别. 说明RNAi技术可有效降低COX-2基因表达, 且随着COX-2表达减少, ERKl/2缺少刺激信号, 表达和活化减少, 从而抑制了肝癌的增殖, 提示COX-2促进肝癌生长可能与ERK1/2通路调控有关. 有学者在其他肿瘤上的研究亦得出类似结论, 如Chan et al[29]在胃癌细胞上的研究发现, COX-2 siRNA可沉默胃癌细胞COX-2表达, 并认为RNAi技术有望成为特异性的COX-2抑制剂, 应用于胃癌的预防和治疗. 由此, 我们推测COX-2可通过MAPK/ERK1/2通路促进肝癌生长. 然而, COX-2促进肿瘤的演进机制复杂, 有学者提出COX-2可能通过参与肿瘤血管的生成[26-28]、参与肿瘤细胞的增殖和抑制凋亡[29-30]、参与免疫抑制[31]等诸多因素促进肿瘤细胞增殖, 具体机制未阐明[32-35]. 本文证实ERK1/2信号传导通路仅仅是其促肿瘤生长的诸多因素之一, 在环氧化酶-2与肝癌关系上, 目前仍然有许多方面需要进一步探索.
本实验采用脂质体转染的方法相对简单、耗时短, 随着细胞的增殖, 转染细胞很快被未转染细胞稀释. 若能构建带筛选标记的siRNA表达质粒, 进行稳定转染, 以获得较长时间的基因沉默效应, 则可能收获更为理想的干扰效果. 此外, 若能采用实时荧光定量PCR, 检测结果则特异性更强、更精确.
总之, 本研究证实COX-2可能通过MAPK/ERK1/2途径参与肝癌演进. COX-2 siRNA能够沉默COX-2的表达, 对肝癌细胞具有生长抑制和细胞周期阻滞的作用. RNAi技术将有可能成为治疗肝癌的新的手段. 但是许多问题还有待解决, COX-2促进肝癌细胞增殖的机制仍未完全阐明, 深入研究COX-2与肝癌的关系不仅可以进一步揭示肝癌发生的分子机制, 更可为肝癌的综合治疗探索一条新的途径.
基因治疗是目前的研究热点, 既可以为应用研究, 也被用于探讨肿瘤发生机制. 通过RNAi技术, 研究者可以降低靶蛋白的表达, 进而研究相关上下游蛋白的变化, 可以通过这种模式探讨靶蛋白在细胞内的动态功能.
魏经国, 教授, 中国人民解放军第四军医大学唐都医院放射科
尽管已知COX-2在多种肿瘤生长过程中扮演重要角色, 但其下游的工作机制尚不明晰.
Cheng et al将COX-2抑制剂NS-398作用于肝癌细胞, 发现COX-2表达降低后, 肝癌细胞增殖明显受抑制, 研究结果与本文可相互验证; Wang et al在喉癌细胞中实验结果与本文类似. 这些研究均提示COX-2可能在癌症细胞的有丝分裂中扮演重要角色, 进一步的应用基础研究将为药物研发提供新的治疗靶点.
本文创新之处是对于COX-2可能干预的下游基因进行了探讨, 自靶基因功能降低的角度, 探讨了对ERK的影响. 虽然具体细节尚待进一步研究, 但是初步表明COX-2可能具有调节ERK的作用.
小干扰RNA可降低肝癌细胞HepG2的COX-2基因表达, 抑制肝癌细胞的生长.
本实验设计严谨, 方法应用得当, 数据准确, 结果可信, 具有很好的指导意义.
编辑: 李军亮 电编:何基才
| 1. | Pujol FH, Devesa M. Genotypic variability of hepatitis viruses associated with chronic infection and the development of hepatocellular carcinoma. J Clin Gastroenterol. 2005;39:611-618. [PubMed] [DOI] |
| 2. | Bantel H, Lügering A, Heidemann J, Volkmann X, Poremba C, Strassburg CP, Manns MP, Schulze-Osthoff K. Detection of apoptotic caspase activation in sera from patients with chronic HCV infection is associated with fibrotic liver injury. Hepatology. 2004;40:1078-1087. [PubMed] [DOI] |
| 3. | Omer RE, Verhoef L, Van't Veer P, Idris MO, Kadaru AM, Kampman E, Bunschoten A, Kok FJ. Peanut butter intake, GSTM1 genotype and hepatocellular carcinoma: a case-control study in Sudan. Cancer Causes Control. 2001;12:23-32. [PubMed] [DOI] |
| 4. | Hitzfeld BC, Höger SJ, Dietrich DR. Cyanobacterial toxins: removal during drinking water treatment, and human risk assessment. Environ Health Perspect. 2000;108 Suppl 1:113-122. [PubMed] [DOI] |
| 5. | Marrero JA. Hepatocellular carcinoma. Curr Opin Gastroenterol. 2005;21:308-312. [PubMed] [DOI] |
| 6. | McLean MH, Murray GI, Fyfe N, Hold GL, Mowat NA, El-Omar EM. COX-2 expression in sporadic colorectal adenomatous polyps is linked to adenoma characteristics. Histopathology. 2008;52:806-815. [PubMed] [DOI] |
| 7. | von Rahden BH, Stein HJ, Hartl SA, Theisen J, Stigler B, Siewert JR, Sarbia M. Expression of prostaglandin E synthase in Barrett's cancer. Dis Esophagus. 2008;21:304-308. [PubMed] [DOI] |
| 8. | Yamac D, Ayyildiz T, Coşkun U, Akyürek N, Dursun A, Seckin S, Koybasioglu F. Cyclooxygenase-2 expression and its association with angiogenesis, Helicobacter pylori, and clinicopathologic characteristics of gastric carcinoma. Pathol Res Pract. 2008;204:527-536. [PubMed] [DOI] |
| 9. | Takatori H, Natsugoe S, Okumura H, Matsumoto M, Uchikado Y, Setoyama T, Sasaki K, Tamotsu K, Owaki T, Ishigami S. Cyclooxygenase-2 expression is related to prognosis in patients with esophageal squamous cell carcinoma. Eur J Surg Oncol. 2008;34:397-402. [PubMed] [DOI] |
| 10. | Hermanova M, Trna J, Nenutil R, Dite P, Kala Z. Expression of COX-2 is associated with accumulation of p53 in pancreatic cancer: analysis of COX-2 and p53 expression in premalignant and malignant ductal pancreatic lesions. Eur J Gastroenterol Hepatol. 2008;20:732-739. [PubMed] [DOI] |
| 11. | Lim K, Han C, Xu L, Isse K, Demetris AJ, Wu T. Cyclooxygenase-2-derived prostaglandin E2 activates beta-catenin in human cholangiocarcinoma cells: evidence for inhibition of these signaling pathways by omega 3 polyunsaturated fatty acids. Cancer Res. 2008;68:553-560. [PubMed] [DOI] |
| 12. | Surowiak P, Pawełczyk K, Maciejczyk A, Pudełko M, Kołodziej J, Zabel M, Murawa D, Drag M, Gansukh T, Dietel M. Positive correlation between cyclooxygenase 2 and the expression of ABC transporters in non-small cell lung cancer. Anticancer Res. 2008;28:2967-2974. [PubMed] |
| 13. | Kulkarni S, Patil DB, Diaz LK, Wiley EL, Morrow M, Khan SA. COX-2 and PPARgamma expression are potential markers of recurrence risk in mammary duct carcinoma in-situ. BMC Cancer. 2008;8:36. [PubMed] [DOI] |
| 14. | Kim JS, Li S, Kim JM, Yeo SG, Kim KH, Cho MJ. Cyclooxygenase-2 expression as a predictor of para-aortic lymph node recurrence in uterine cervical cancer. Int J Radiat Oncol Biol Phys. 2008;70:1516-1521. [PubMed] [DOI] |
| 15. | Aparicio Gallego G, Díaz Prado S, Jiménez Fonseca P, García Campelo R, Cassinello Espinosa J, Antón Aparicio LM. Cyclooxygenase-2 (COX-2): a molecular target in prostate cancer. Clin Transl Oncol. 2007;9:694-702. [PubMed] [DOI] |
| 16. | Wu Y, Liu H, Li J. Expression of p63 and cyclooxygenase-2 and their correlation in skin tumors. J Huazhong Univ Sci Technolog Med Sci. 2007;27:206-208. [PubMed] [DOI] |
| 17. | Samaka RM, Abdou AG, Abd El-Wahed MM, Kandil MA, El-Kady NM. Cyclooxygenase-2 expression in chronic gastritis and gastric carcinoma, correlation with prognostic parameters. J Egypt Natl Canc Inst. 2006;18:363-374. [PubMed] |
| 18. | Mehar A, Macanas-Pirard P, Mizokami A, Takahashi Y, Kass GE, Coley HM. The effects of cyclooxygenase-2 expression in prostate cancer cells: modulation of response to cytotoxic agents. J Pharmacol Exp Ther. 2008;324:1181-1187. [PubMed] [DOI] |
| 19. | Foster J, Black J, LeVea C, Khoury T, Kuvshinoff B, Javle M, Gibbs JF. COX-2 expression in hepatocellular carcinoma is an initiation event; while EGF receptor expression with downstream pathway activation is a prognostic predictor of survival. Ann Surg Oncol. 2007;14:752-758. [PubMed] [DOI] |
| 21. | Hu KQ, Yu CH, Mineyama Y, McCracken JD, Hillebrand DJ, Hasan M. Inhibited proliferation of cyclooxygenase-2 expressing human hepatoma cells by NS-398, a selective COX-2 inhibitor. Int J Oncol. 2003;22:757-763. [PubMed] |
| 22. | Stoeltzing O, Liu W, Fan F, Wagner C, Stengel K, Somcio RJ, Reinmuth N, Parikh AA, Hicklin DJ, Ellis LM. Regulation of cyclooxygenase-2 (COX-2) expression in human pancreatic carcinoma cells by the insulin-like growth factor-I receptor (IGF-IR) system. Cancer Lett. 2007;258:291-300. [PubMed] [DOI] |
| 23. | Cheng AS, Chan HL, Leung WK, Wong N, Johnson PJ, Sung JJ. Specific COX-2 inhibitor, NS-398, suppresses cellular proliferation and induces apoptosis in human hepatocellular carcinoma cells. Int J Oncol. 2003;23:113-119. [PubMed] |
| 24. | Wang R, Wang X, Lin F, Gao P, Dong K, Zhang HZ. shRNA-targeted cyclooxygenase (COX)-2 inhibits proliferation, reduces invasion and enhances chemosensitivity in laryngeal carcinoma cells. Mol Cell Biochem. 2008;317:179-188. [PubMed] [DOI] |
| 25. | Chang F, Steelman LS, Lee JT, Shelton JG, Navolanic PM, Blalock WL, Franklin RA, McCubrey JA. Signal transduction mediated by the Ras/Raf/MEK/ERK pathway from cytokine receptors to transcription factors: potential targeting for therapeutic intervention. Leukemia. 2003;17:1263-1293. [PubMed] [DOI] |
| 26. | Reddy KB, Nabha SM, Atanaskova N. Role of MAP kinase in tumor progression and invasion. Cancer Metastasis Rev. 2003;22:395-403. [PubMed] [DOI] |
| 27. | Raviv Z, Kalie E, Seger R. MEK5 and ERK5 are localized in the nuclei of resting as well as stimulated cells, while MEKK2 translocates from the cytosol to the nucleus upon stimulation. J Cell Sci. 2004;117:1773-1784. [PubMed] [DOI] |
| 28. | Yu L, Wu WK, Li ZJ, Wong HP, Tai EK, Li HT, Wu YC, Cho CH. E series of prostaglandin receptor 2-mediated activation of extracellular signal-regulated kinase/activator protein-1 signaling is required for the mitogenic action of prostaglandin E2 in esophageal squamous-cell carcinoma. J Pharmacol Exp Ther. 2008;327:258-267. [PubMed] [DOI] |
| 29. | Chan MW, Wong CY, Cheng AS, Chan VY, Chan KK, To KF, Chan FK, Sung JJ, Leung WK. Targeted inhibition of COX-2 expression by RNA interference suppresses tumor growth and potentiates chemosensitivity to cisplatin in human gastric cancer cells. Oncol Rep. 2007;18:1557-1562. [PubMed] |
| 30. | 产 松苗, 欧 希龙, 孙 为豪, 陈 国胜, 颜 芳. 贲门癌组织环氧化酶-2和血管生成因子的表达及其与血管生成的关系. 世界华人消化杂志. 2007;15:3097-3103. [DOI] |
| 31. | 产 松苗, 欧 希龙, 孙 为豪, 陈 国胜, 颜 芳, 邵 耘, 许 海尘, 薛 绮萍. 食管癌组织环氧化酶-2的表达与血管生成的关系. 世界华人消化杂志. 2006;14:1388-1393. [DOI] |
| 32. | Wu AW, Gu J, Li ZF, Ji JF, Xu GW. COX-2 expression and tumor angiogenesis in colorectal cancer. World J Gastroenterol. 2004;10:2323-2326. [PubMed] |
| 33. | 金 春亭, 鲁 蓓, 李 海军, 李 玉珍, 武 欣, 范 婕, 张 林西. 环氧化酶-2选择性抑制剂抑制人食管癌细胞的生长及其诱导凋亡. 世界华人消化杂志. 2007;15:440-446. [DOI] |
| 34. | Pai R, Soreghan B, Szabo IL, Pavelka M, Baatar D, Tarnawski AS. Prostaglandin E2 transactivates EGF receptor: a novel mechanism for promoting colon cancer growth and gastrointestinal hypertrophy. Nat Med. 2002;8:289-293. [PubMed] [DOI] |
| 35. | Pockaj BA, Basu GD, Pathangey LB, Gray RJ, Hernandez JL, Gendler SJ, Mukherjee P. Reduced T-cell and dendritic cell function is related to cyclooxygenase-2 overexpression and prostaglandin E2 secretion in patients with breast cancer. Ann Surg Oncol. 2004;11:328-339. [PubMed] [DOI] |