修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-08-08
目的: 观察熊果酸(UA)对肝纤维化大鼠肝组织TGF-β1基因与蛋白及α平滑肌肌动蛋白(α-SMA)表达的影响, 并探讨其抗肝纤维化作用机制.
方法: SD大鼠96只随机分为正常对照组(N组)、模型组(M组)、UA低剂量组(U1组)、UA中剂量组(U2组)、UA高剂量组(U3组)及秋水仙碱组(C组), 每组16只. 除N组外, 均用二甲基亚硝胺(Dimethylnitrosamine, DMN)诱导肝纤维化4 wk, 分别给予安慰剂、不同剂量的UA、秋水仙碱腹腔注射, 治疗4 wk处死大鼠, 取肝组织行病理HE染色及VG染色判断炎症和肝纤维化程度; 分别采用免疫组织化学和Western blot检测TGF-β1蛋白和α-SMA蛋白的表达; 采用RT-PCR检测TGF-β1 mRNA的表达.
结果: U2和U3组肝细胞坏死和纤维组织增生明显减轻; M组TGF-β1蛋白、TGF-β1 mRNA及α-SMA蛋白较N组的表达明显增加(8.76±1.47 vs 1.48±0.24; 0.60±0.11 vs 0.05±0.02; 0.51±0.10 vs 0.09±0.02, 均P<0.01). U1组和C组TGF-β1蛋白的表达较M组降低(P<0.05), U2和U3组TGF-β1蛋白的表达较M组明显降低(5.32±1.63, 3.98±0.67 vs 8.76±1.47, 均P<0.01), 且低于C组的表达(7.14±1.29, P<0.05或0.01). U2和U3组的TGF-β1 mRNA的表达也明显低于M组(0.36±0.07, 0.25±0.06 vs 0.60±0.11, 均P<0.01)和C组(0.47±0.10, P<0.05或0.01). U1-U3组较M组α-SMA蛋白的表达明显降低(0.36±0.08, 0.23±0.02, 0.15±0.03 vs 0.51±0.10, 均P<0.01); U2和U3组α-SMA蛋白的表达也显著低于C组(0.43±0.05, 均P<0.01).
结论: UA能明显改善肝纤维化大鼠的肝脏组织结构, 减轻肝纤维化; 其抗肝纤维化的机制可能与降低TGF-β1表达, 抑制HSC的激活有关.
引文著录: 欧阳灿晖, 朱萱, 张焜和, 戴颖, 陈江, 何文华, 李博, 李弼民. 熊果酸对肝纤维化大鼠肝组织TGF-β1和α-SMA表达的影响. 世界华人消化杂志 2009; 17(22): 2237-2243
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: August 8, 2009
AIM: To observe the effects of ursolic acid (UA) on the expression of transforming growth factor-β1 (TGF-β1) mRNA and protein and alpha-smooth muscle actin (α-SMA) protein in liver tissue of rats with dimethylnitrosamine (DMN)-induced liver fibrosis, and explore the mechanism underlying their anti-fibrotic effects.
METHODS: After liver fibrosis in rats was induced by DMN for four weeks, rats were given different doses of UA, colchicine and placebo for another four weeks by intraperitoneal injection. Hepatic lobule constitution, hepatic cell necrosis and fibrous tissue hyperplasia were observed by HE and VG staining. The levels of TGF-β1 and α-SMA proteins were measured by immunohistochemistry and Western blot. The expression of TGF-β1 mRNA was measured by RT-PCR.
RESULTS: The degree of hepatic cell necrosis and fibrous tissue hyperplasia was decreased markedly in rats treated with UA. The expression levels of TGF-β1 mRNA and protein and α-SMA protein in the model control group were significantly higher than those in the normal control group (8.76 ± 1.47 vs 1.48 ± 0.24, 0.60 ± 0.11 vs 0.05 ± 0.02 and 0.51 ± 0.10 vs 0.09 ± 0.02, respectively; all P < 0.01). The expression levels of TGF-β1 protein in the U1 (low-dose UA) group and colchine group were lower than those in the model control group, while the expression levels of TGF-β1 protein in the U2 (medium-dose UA) and U3 (high-dose UA) groups were not only significantly lower than that in the model control group (5.32 ± 1.63 and 3.98 ± 0.67 vs 8.76 ± 1.47, both P < 0.01), but also lower than that in the colchine group (7.14 ± 1.29, P < 0.05 or 0.01). Furthermore, the expression levels of TGF-β1 mRNA in the U2 and U3 groups were lower than those in the model control group (0.36 ± 0.07 and 0.25 ± 0.06 vs 0.60 ± 0.11, both P < 0.01) and colchine group (0.47 ± 0.10, P < 0.05 or 0.01). The expression levels of α-SMA protein in the U1, U2 and U3 groups were significantly lower than those in the model control group (0.36 ± 0.08, 0.23 ± 0.02 and 0.15 ± 0.03 vs 0.51±0.10, all P < 0.01) and colchine group (0.43 ± 0.05, all P < 0.01).
CONCLUSION: UA significantly ameliorates DMN-induced liver fibrosis perhaps through activation of HSC and downregulation of TGF-β1 expression.
- Citation: Ouyang CH, Zhu X, Zhang KH, Dai Y, Chen J, He WH, Li B, Li BM. Effects of ursolic acid on the expression of transforming growth factor-β1 and alpha-smooth muscle actin in fibrotic liver in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2237-2243
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2237
肝星状细胞(hepatic stellate cell, HSC)和转化生长因子-β(transforming growth factor β, TGF-β)在肝纤维化发病中扮演主要角色[1]. 各种原因引起肝损伤时氧化应激等刺激可激活HSC[2], 活化的HSC能合成TGF-β等促肝纤维化因子, 他们进一步刺激HSC转化为肌纤维母细胞(myofibroblast, MFB), 并促进细胞外基质(extracellular matrix, ECM)合成[3]. 当病程发展到肝硬化时, 各种治疗难以奏效, 而在肝纤维化早期阶段病变是可逆的[4]. 我们前期研究发现熊果酸(ursolic acid, UA)在体外可以明显抑制HSC-T6细胞的增殖、诱导其凋亡[5], 体内实验证实他可阻断氧化应激, 上调基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)并下调TIMP-1的基因表达, 具有治疗肝纤维化的作用[6]. 本实验拟进一步观察其在体内是否能降低关键的促肝纤维化因子的表达以及抑制HSC激活的作用.
清洁级♂SD大鼠, 体质量160-200 g, 由南昌大学医学院动科部提供; 二甲基亚硝胺(天津化学试剂研究所产品), UA(江中本草天根公司产品), 秋水仙碱(美国Sigma公司产品), TRIzol总RNA提取试剂盒(美国Gibco公司产品); dNTP、M-MLVRT 5×Buffer、M-MLV Reverse Transcriptase、Oligo(dT)15、RNasin Inhibitor均购自美国Promega公司; TGF-β1引物由上海生工生物工程公司合成; 总蛋白提取试剂盒(北京普利莱基因技术有限公司产品); TGF-β1 mAb(Sigma公司产品)、α-SMA mAb(Santa cruz公司产品); β-actin多克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG(北京中杉生物公司产品).
1.2.1 分组及药物处理: 清洁级健康♂SD大鼠96只, 入实验室适应1 wk后, 随机分成正常对照组(N组)、模型组(M组)、UA低剂量组(U1组)、UA中剂量组(U2组)、UA高剂量组(U3组)及秋水仙碱组(C组), 每组16只. N组按1 mL/(kg•d)生理盐水腹腔注射, M组、U1-U3组及C组给予1% DMN(1 mL/kg)腹腔注射, 均为每周连续3 d, 共4 wk(参照Lee et al的方法). 然后U1-U3组分别给予10、20、40 mg/(kg•d)的UA腹腔注射, C组给予秋水仙碱0.1 mg/(kg•d)腹腔注射, N组和M组每天按1 mL/kg生理盐水腹腔注射. 药物治疗第4周末处死各组大鼠, 分别取部分肝左叶用100 g/L中性甲醛固定, 其余部分迅速置于液氮, 液氮过夜后放于-80℃冰箱保存.
1.2.2 肝组织病理学及免疫组织化学检测: 在药物治疗第4周末处死各组大鼠, 切取肝左叶相同部位标本置于PBS液中充分洗涤, 以100 g/L中性甲醛固定后, 石蜡包埋并切片后, 行HE染色和VG染色, 并用半定量标准判断胶原纤维增生程度, 判定标准参照2000-09修订的病毒性肝炎防治方案[7]. 免疫组织化学检测TGF-β1蛋白表达(结果判定参考文献[8]): 取10个较好的高倍视野, 按显色程度分弱、中、强3种, 分别记以1、2、3分; 按显色范围分为4度: +显色范围占高倍视野<25%; ++显色占高倍视野25%-50%; +++显色占高倍视野50%-75%; ++++显色占高倍视野>75%. 将每个高倍视野显色程度和范围换算成"显色指数", 显色指数 = 显色程度×显色范围(+为1分、++为2分、+++为3分、++++为4分), 取其均数为每个检测指标的最终显色指数.
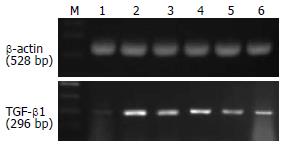
1.2.3 肝脏组织中TGF-β1的mRNA的检测: (1)总RNA提取: 取50-100 mg冻存肝组织标本放入1 mL玻璃匀浆器中加1 mL TRIzol室温下匀浆, 抽提组织RNA, 加0.2 mL氯仿, 4℃, 12 000 g下低温离心15 min, 取上清加等体积异戊醇, 4℃, 12 000 g下低温离心10 min, 750 mL/L乙醇l mL洗涤, 加20 μL DEPCH2O, -80℃冰箱内保存. A260/A280均在1.8-2.0. (2)RT-PCR: 逆转录: 取RNA 10 μL, Oligo(dT)3 μL, DEPCH2O 1 μL在PCR仪中70℃, 加热5 min, 再冰浴3 min, 加入MMLV Buffer、dNTP、RNasin、DEPCH2O共25 μL, 在PCR仪中42℃加热60 min. PCR扩增: 反应总体积为25 μL, 含10 μL 2×TaqPCR MasterMix, 8 μL ddH2O, cDNA 5 μL, 上游下游引物各1 μL(各目的基因引物设计见表1). PCR反应参数: TGF-β1: 95℃ 3 min预变性, 95℃ 30 s, 58℃ 30 s, 72℃ 45 s, 共30个循环; 内参β-actin: 95℃ 5 min预变性, 94℃ 30 s, 55℃ 30 s, 72℃ 30 s, 共循环30次, 最后彻底延伸于72℃ 5 min, 4℃保存. (3)电泳分析: 从上述DNA产物取5 μL行琼脂糖电泳, 凝胶图像分析系统进行光密度扫描, 以TGF-β1/β-actin的灰度比值表示相对表达水平, 实验重复6次.
| 目的基因 | 引物序列 | 产物长度(bp) |
| TGF-β1 | 上游5-CCATGACATGAACCGACCCT-3 | 296 |
| 下游5-CCGGGTTGTGTTGGTTGTAG-3 | ||
| β-actin | 上游:5-CTACAATGAGCTGCGTGTGG-3 | 528 |
| 下游5-AAGGAAGGCTGGAAGAGTG-3 |
1.2.4 Western blot检测α-SMA蛋白的表达: 按总蛋白提取试剂盒提取各组肝组织的总蛋白, Bradford法对蛋白样品进行定量. 取出30 μg蛋白上样样品至EP管中, 加入4×SDS上样缓冲液至终浓度为1×SDS. 95℃煮10 min进行蛋白质变性. 进行100 g/L的SDS-PAGE凝胶电泳, 然后将蛋白质转至硝酸纤维膜上, 用50 g/L的脱脂牛奶于4℃封闭过夜后, 分别用α-SMA抗体(1:200)β-actin (1:1000)4℃孵育过夜, 然后加入辣根过氧化物酶标记的山羊抗小鼠-IgG抗体(1:10000)室温2 h. 最后加ECL发光剂于暗室充分反应后用胶片曝光. 将每个样本所测得的α-SMA蛋白灰度值, 分别与对应的β-actin蛋白的灰度值相比, 计算二者灰度比值.
统计学处理 实验数据以mean±SD表示, 数值变量资料多组间比较采取单因素方差分析, 用SNK和LSD法进行多重比较. 计数资料则采用Kruskal-Wallis秩和检验, 所有数据采用SPSS11.5软件包分析, P<0.05为差异统计学意义有显著性差异.
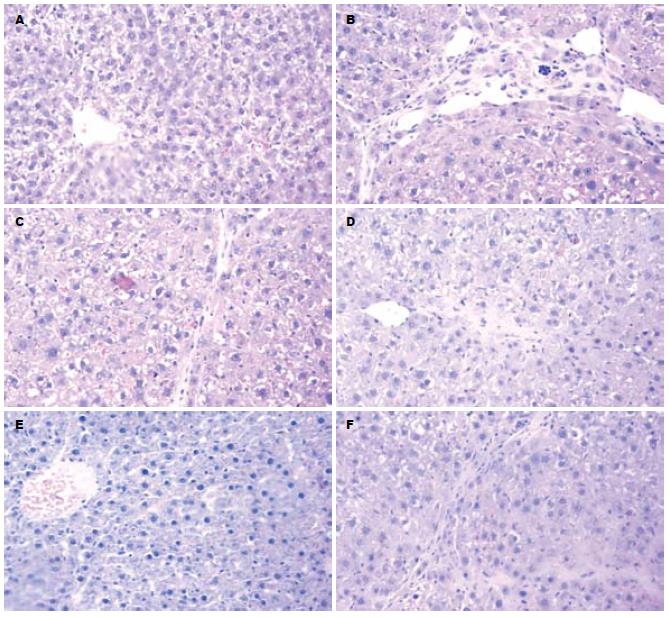
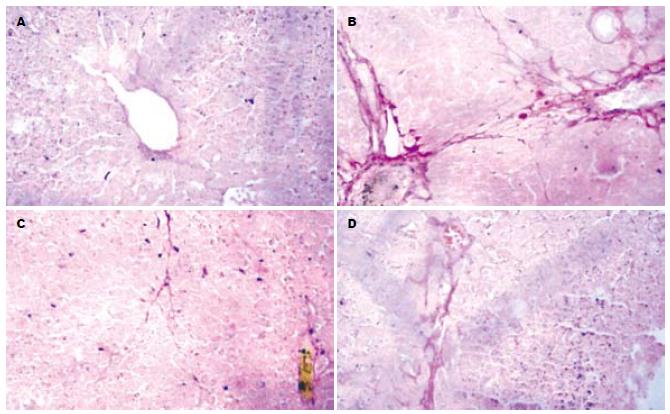
HE染色光镜下观察: N组肝脏肝小叶结构正常, 肝细胞索排列规则, 肝细肝窦与汇管区成纤维细胞少(图1A); M组肝小叶结构紊乱, 肝索排列紊乱, 肝细胞空泡变性, 部分肝细胞坏死, 少量炎性细胞浸润, 纤维组织增生明显(图1B); C组肝小叶结构稍紊乱, 肝细胞体积增大, 纤维组织增生较明显, 轻于模型组(图1F). 不同剂量UA作用4 wk后, 能明显改善肝小叶结构, 减轻肝细胞坏死, 减少胶原纤维的沉积和纤维组织增生, 其中又以中、高剂量作用最强(图1C-E); VG染色光镜观察: N组结果同HE染色(图2A); M组正常肝小叶结构破坏, 肝索排列紊乱, 汇管区可见大量胶原纤维, 胶原纤维构成的纤维间隔形成, 肝窦内连续或断续性环状胶原沉积(图2B); UA各治疗组肝组织胶原纤维增生有不同程度改善, 其中U3组肝小叶结构基本完整, 纤维组织增生不明显, 胶原纤维间隔较少(图2C). C组肝小叶正常结构部分破坏, 纤维组织增生较多, 胶原纤维沉积较多, 但较模型组轻(图2D). 与N组相比, M组、U组及C组肝纤维化程度明显增高(P<0.01); 与M相比, U2、U3组肝纤维化程度均明显减轻(P<0.05、P<0.01); C组与M组之间无明显差异; UA不同剂量治疗组之间有显著差异(P<0.05).
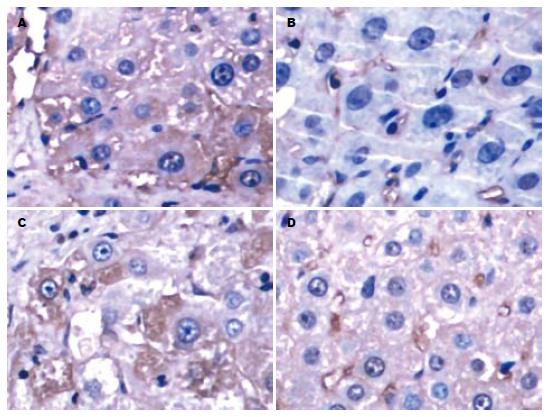
正常肝组织中仅微弱表达TGF-β1蛋白, 显色极淡. M组较N组TGF-β1阳性信号明显增强(8.76±1.47 vs 1.48±0.24, P<0.01), 阳性染色分布于变性的肝细胞、间质细胞、纤维化区、肝窦壁、汇管区、血管壁及部分胆管细胞, 显色大部分呈深棕黄色. U1组和C组TGF-β1蛋白的表达较M组减低(7.23±1.30 vs 8.76±1.47, 7.14±1.29 vs 8.76±1.47, 均P<0.05), U2和U3组TGF-β1蛋白的表达不仅较M组明显减低(5.32±1.63, 3.98±0.67 vs 8.76±1.47, 均P<0.01), 而且低于C组的表达(5.32±1.63 vs 7.14±1.29, P<0.05; 3.98±0.67 vs 7.14±1.29, P<0.01, 图3).
TGF-β1 mRNA在M组比N组表达显著增加(0.60±0.11 vs 0.05±0.02, P<0.01); U1组和C组TGF-β1 mRNA的表达均较M组减低(0.46±0.08 vs 0.60±0.11, 0.47±0.10 vs 0.60±0.11, 均P<0.05), U2和U3组TGF-β1 mRNA的表达不仅较M组明显减低(0.36±0.07, 0.25±0.06 vs 0.60±0.11, 均P<0.01), 而且低于C组的表达(0.36±0.07 vs 0.47±0.10, P<0.05; 0.25±0.06 vs 0.47±0.10, P<0.01, 图4).
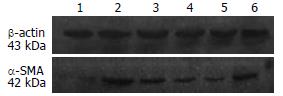
M组的α-SMA蛋白表达明显高于N组(0.51±0.10 vs 0.09±0.02, P<0.01); C组与M组α-SMA蛋白的表达无显著性差异(0.43±0.05 vs 0.51±0.10, P>0.05); U1-U3组较M组α-SMA蛋白的表达明显降低(0.36±0.08 vs 0.51±0.10, 0.23±0.02 vs 0.51±0.10, 0.15±0.03 vs 0.51±0.10, 均P<0.01); UA各剂量组之间α-SMA蛋白的表达有显著性差异(P<0.01); U2和U3组α-SMA蛋白的表达也显著低于C组(0.23±0.02 vs 0.43±0.05, 0.15±0.03 vs 0.43±0.05, 均P<0.01, 图5).
目前, 对于肝纤维化的发病机制有了较清晰的认识, HSC和TGF-β在肝纤维化的发病中扮演主要角色[1]. 正常肝星状细胞处于静止期, 产生少量的ECM包括层粘连蛋白(laminin, LN)、胶原Ⅳ型等基底膜构成成分. 在各种原因引起肝损伤时, 静止的HSC受肝细胞、枯否细胞、窦内皮细胞等旁分泌的促纤维化因子刺激, 逐渐从无增殖性的贮脂细胞转化为有增殖性的, 脂质和维生素A丢失并表达α-SMA, 他被认为是肝纤维化发病的关键事件[7]. MFB不仅能产生几乎所有的ECM成分, 还能产生一系列的细胞因子和趋化因子[8]. 完全转化的MFB表达各种细胞因子的受体, 并能接受自分泌的细胞因子的刺激, 在这些旁分泌和自分泌的促肝纤维化因子当中, TGF-β1被认为是促肝纤维作用最强的因子之一[9]. TGF-β是一族具有广泛生物学活性的多肽 (包括TGF-β1, TGF-β2及TGF-β3亚型). 在肝纤维化发病过程中, TGF-β在启动并促进HSC向MFB转化的进程中起关键的作用. TGF-β可使静息状态下的HSC被激活或转化为MFB, 并能刺激这些细胞向损伤部位迁移、增殖[10]. 同时活化的HSC能自分泌TGF-β, 是肝纤维化后期TGF-β1的主要来源. 自分泌的TGF-β又作用于HSC, 形成恶性循环, 导致ECM不断产生和沉积, 肝组织瘢痕化[11]. 此外, TGF-β又能抑制MMPs的表达并上调TIMP-1的表达从而阻止ECM的降解, 进一步促进肝纤维化的发展[12-13]. 因而, 抑制肝组织中TGF-β的表达对于逆转肝纤维化具有重要意义. Ueberham et al[14]研究就发现调控TGF-β的表达可逆转肝纤维化, 说明肝纤维化的发生与TGF-β表达水平直接相关. 在多个肝纤维化模型实验中, 通过抑制RNA干涉等基因技术抑制TGF-β的表达或阻断他的信号通路可阻止肝纤维化[15-19].
中药用于抗纤维化有较长的历史, 近年研究发现从植物中药提取的有效成分如氧化苦参碱(oxymatrine)、表没食子儿茶素-3-没食子酸酯(epigallocatechin-3-gallate, EGCG)、丹酚酸B盐(salvianolic acid B, SA-B)及β-榄香烯均可抑制TGF-β表达或信号转导, 并具有抗肝纤维化的作用[20-23]. UA是一种存在于许多植物药(如丹参、白花蛇舌草、女贞子等)中的天然五环三萜类化合物, 具有抗氧化、抗炎、抗病毒、抗肿瘤等多种生物学效应[24-25]. 近年来发现UA可保护肝脏损伤[26], 他对细胞内ROS的产生有较强的抑制作用[27], 但UA的抗肝纤维化作用及机制研究甚少. 我们以往的研究中首先发现UA在体外可以抑制HSC-T6细胞的增殖, 诱导其凋亡, 凋亡机制可能与上调Bax、caspase3蛋白表达有关[5]; 体内实验发现UA能阻断氧化应激和脂质过氧化, 上调MMP-1表达、下调TIMP-1基因表达[6]. 本次研究进一步证明UA能明显改善肝纤维化大鼠的肝脏组织结构, 减轻肝细胞坏死和纤维组织增生. 实验发现UA治疗组的肝组织中α-SMA的表达明显降低, 提示转化的MFB减少, 这可能是UA抑制HSC的激活或诱导其凋亡的结果. 我们还发现UA能降低肝纤维化大鼠肝组织中TGF-β1 mRNA及蛋白的表达, 由于TGF-β1是关键的促肝纤维化因子, UA抑制TGF-β的表达可间接抑制HSC的激活, 又能阻断HSC与TGF-β1之间的恶性循环, 这可能是UA抗肝纤维化的作用机制之一. Murakami et al[28]研究发现UA能拮抗TGF-β1与其受体结合. 有学者报道, TGF-β1还可诱导肝细胞凋亡, 抑制肝细胞的分裂和增殖[29]. 而沉默TGF-β1使之表达缺陷后可触发凋亡的肝细胞恢复增殖和再生[30]. 这可能是UA具有保护肝细胞及抗肝纤维化双重作用的机制.
总之, 我们的实验证明UA能明显改善肝纤维化大鼠的肝脏组织结构, 减轻肝细胞坏死和纤维组织增生, 疗效优于秋水仙碱, 显示出诱人的应用前景. 其抗肝纤维化机制可能与降低TGF-β1表达、抑制HSC的激活以及阻断HSC与TGF-β1之间的恶性循环有关.
肝纤维化是各种原因引起慢性肝损伤后的可逆性创伤愈合反应, 肝纤维化发展到晚期即为肝硬化, 他是一个全球性的主要健康问题. 肝硬化的治疗不仅费用巨大, 而且收效甚微, 因此尽早阻止或逆转肝纤维化、防止肝硬化的发生具有重要意义.
张锦生, 教授, 复旦大学上海医学院病理学系; 刘绍能, 主任医师, 中国中医科学院广安门医院消化科
转化生长因子β(TGF-β)是作用最强的促肝纤维因子之一, 他激活肝星状细胞(HSC)转化为肌纤维母细胞(MFB), MFB产生ECM并自分泌的TGF-β等细胞因子, 这些细胞因子又作用于HSC, 形成恶性循环, 导致肝纤维化进行性发展. 抑制TGF-β等促肝纤维化因子的表达或阻断他们的信号转导是当前研究的热点.
Gressner et al对近年来的研究进行回顾后认为, HSC和TGF-β在肝纤维化发病中扮演主要角色, 也是肝纤维化治疗的主要靶点.
熊果酸能明显改善肝纤维化大鼠的肝脏组织结构, 减轻肝纤维化; 其抗肝纤维化的机制可能与降低TGF-β1表达、抑制HSC的激活以阻断HSC与TGF-β1之间的恶性循环有关.
本实验证明UA能降低TGF-β1表达、抑制HSC的激活, 其抗肝纤维化疗效优于秋水仙碱, 为熊果酸应用于抗肝纤维化治疗提供了一定理论依据.
本研究选题尚可, 设计合理, 结果可靠, 具有较好的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 2. | Urtasun R, Nieto N. [Hepatic stellate cells and oxidative stress]. Rev Esp Enferm Dig. 2007;99:223-230. [PubMed] |
| 3. | Gressner OA, Weiskirchen R, Gressner AM. Evolving concepts of liver fibrogenesis provide new diagnostic and therapeutic options. Comp Hepatol. 2007;6:7. [PubMed] [DOI] |
| 4. | Friedman SL, Bansal MB. Reversal of hepatic fibrosis -- fact or fantasy? Hepatology. 2006;43:S82-S88. [PubMed] [DOI] |
| 7. | Reeves HL, Friedman SL. Activation of hepatic stellate cells--a key issue in liver fibrosis. Front Biosci. 2002;7:d808-d826. [PubMed] [DOI] |
| 8. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 9. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 10. | Liu X, Hu H, Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis. Liver Int. 2006;26:8-22. [PubMed] [DOI] |
| 11. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] |
| 12. | Ogawa K, Chen F, Kuang C, Chen Y. Suppression of matrix metalloproteinase-9 transcription by transforming growth factor-beta is mediated by a nuclear factor-kappaB site. Biochem J. 2004;381:413-422. [PubMed] [DOI] |
| 13. | Yang C, Zeisberg M, Mosterman B, Sudhakar A, Yerramalla U, Holthaus K, Xu L, Eng F, Afdhal N, Kalluri R. Liver fibrosis: insights into migration of hepatic stellate cells in response to extracellular matrix and growth factors. Gastroenterology. 2003;124:147-159. [PubMed] [DOI] |
| 14. | Ueberham E, Löw R, Ueberham U, Schönig K, Bujard H, Gebhardt R. Conditional tetracycline-regulated expression of TGF-beta1 in liver of transgenic mice leads to reversible intermediary fibrosis. Hepatology. 2003;37:1067-1078. [PubMed] [DOI] |
| 15. | Arias M, Sauer-Lehnen S, Treptau J, Janoschek N, Theuerkauf I, Buettner R, Gressner AM, Weiskirchen R. Adenoviral expression of a transforming growth factor-beta1 antisense mRNA is effective in preventing liver fibrosis in bile-duct ligated rats. BMC Gastroenterol. 2003;3:29. [PubMed] [DOI] |
| 16. | Kim KH, Kim HC, Hwang MY, Oh HK, Lee TS, Chang YC, Song HJ, Won NH, Park KK. The antifibrotic effect of TGF-beta1 siRNAs in murine model of liver cirrhosis. Biochem Biophys Res Commun. 2006;343:1072-1078. [PubMed] [DOI] |
| 17. | Chen HN, Fan S, Weng CF. Down-regulation of TGFbeta1 and leptin ameliorates thioacetamide-induced liver injury in lipopolysaccharide-primed rats. J Endotoxin Res. 2007;13:176-188. [PubMed] [DOI] |
| 18. | Jiang W, Yang CQ, Liu WB, Wang YQ, He BM, Wang JY. Blockage of transforming growth factor beta receptors prevents progression of pig serum-induced rat liver fibrosis. World J Gastroenterol. 2004;10:1634-1638. [PubMed] |
| 20. | 甄 茂川, 王 效民, 尹 震宇, 汪 谦, 刘 平果, 吴 国洋, 俞 可克, 李 岗山. EGCG对肝纤维化大鼠TGF-β1和CTGF表达的影响. 世界华人消化杂志. 2008;16:3828-3834. [DOI] |
| 21. | Wu XL, Zeng WZ, Jiang MD, Qin JP, Xu H. Effect of Oxymatrine on the TGFbeta-Smad signaling pathway in rats with CCl4-induced hepatic fibrosis. World J Gastroenterol. 2008;14:2100-2105. [PubMed] [DOI] |
| 23. | 胡 胜军, 杨 玲, 朱 清静, 彭 汉光. β-榄香烯对实验性肝纤维化大鼠TGF-β1、α-SMA、Col-Ⅰ表达的影响. 世界华人消化杂志. 2007;15:1324-1330. [DOI] |
| 24. | Dufour D, Pichette A, Mshvildadze V, Bradette-Hébert ME, Lavoie S, Longtin A, Laprise C, Legault J. Antioxidant, anti-inflammatory and anticancer activities of methanolic extracts from Ledum groenlandicum Retzius. J Ethnopharmacol. 2007;111:22-28. [PubMed] [DOI] |
| 25. | Tang C, Lu YH, Xie JH, Wang F, Zou JN, Yang JS, Xing YY, Xi T. Downregulation of survivin and activation of caspase-3 through the PI3K/Akt pathway in ursolic acid-induced HepG2 cell apoptosis. Anticancer Drugs. 2009;20:249-258. [PubMed] [DOI] |
| 26. | Saravanan R, Viswanathan P, Pugalendi KV. Protective effect of ursolic acid on ethanol-mediated experimental liver damage in rats. Life Sci. 2006;78:713-718. [PubMed] [DOI] |
| 27. | Ali MS, Ibrahim SA, Jalil S, Choudhary MI. Ursolic acid: a potent inhibitor of superoxides produced in the cellular system. Phytother Res. 2007;21:558-561. [PubMed] [DOI] |
| 28. | Murakami S, Takashima H, Sato-Watanabe M, Chonan S, Yamamoto K, Saitoh M, Saito S, Yoshimura H, Sugawara K, Yang J. Ursolic acid, an antagonist for transforming growth factor (TGF)-beta1. FEBS Lett. 2004;566:55-59. [PubMed] [DOI] |
| 29. | Black D, Lyman S, Qian T, Lemasters JJ, Rippe RA, Nitta T, Kim JS, Behrns KE. Transforming growth factor beta mediates hepatocyte apoptosis through Smad3 generation of reactive oxygen species. Biochimie. 2007;89:1464-1473. [PubMed] [DOI] |
| 30. | Arendt E, Ueberham U, Bittner R, Gebhardt R, Ueberham E. Enhanced matrix degradation after withdrawal of TGF-beta1 triggers hepatocytes from apoptosis to proliferation and regeneration. Cell Prolif. 2005;38:287-299. [PubMed] [DOI] |