修回日期: 2009-06-25
接受日期: 2009-06-29
在线出版日期: 2009-08-08
目的: 评价IL-10基因修饰骨髓源性肝干细胞(BDLSCs)移植对肝纤维化大鼠细胞外基质(ECM)积聚的影响.
方法: 利用免疫磁珠细胞分选(magnetic bead cell sorting, MACS)方法分选大鼠β2m-/Thy-1+ BDLSCs. 将腺病毒介导的IL-10基因转导至BDLSCs, 采用ELISA法检测IL-10蛋白分泌水平. 将大鼠随机分为4组: 正常组、模型组、BDLSCs组及BDLSCs/IL-10组. 采用PCR法检测Y染色体性别决定基因Sry; 采用VG染色法观测肝组织胶原沉积面积; Western blot法检测肝组织α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达; 采用碱水解法检测肝组织羟脯氨酸(hydroxyproline, Hyp)浓度; ELISA法检测血清透明质酸(HA)、层粘连蛋白(LN)和Ⅲ型前胶原(PCⅢ)等细胞外基质含量.
结果: MASC法能成功分选纯化BDLSCs. IL-10修饰BDLSCs持续高浓度分泌IL-10蛋白至胞外, 移植后能顺利种植于肝内, 减轻胶原沉积, 减少α-SMA表达从而抑制肝星状细胞活化, 与BDLSCs组比较, BDLSCs/IL-10组大鼠肝组织Hyp水平显著降低(255.0±50.5 μg/g vs 373.0±26.7 μg/g, P<0.01), 血清HA, LN及PCⅢ水平也有所降低, 差异具有统计学意义(40.5±7.7 μg/L vs 79.4±10.3 μg/L, 61.5±16.4 μg/L vs 77.7±12.6 μg/L, 14.3±0.8 μg/L vs 14.9±1.5 μg/L, P<0.01或0.05).
结论: IL-10基因修饰BDLSCs移植能有效减少肝纤维化大鼠ECM的积聚, 为治疗肝纤维化提供了新思路.
引文著录: 兰玲, 陈源文, 孙超, 刘博伟, 孙巧玲. IL-10基因修饰骨髓源性肝干细胞移植对肝纤维化大鼠细胞外基质积聚的影响. 世界华人消化杂志 2009; 17(22): 2231-2236
Revised: June 25, 2009
Accepted: June 29, 2009
Published online: August 8, 2009
AIM: To investigate the effects of transplanting interleukin 10 (IL-10)-modified bone marrow-derived liver stem cells (BDLSCs) on accumulation of extracellular matrix in fibrotic liver in rats.
METHODS: Rat beta-2 microglobulin (β2m)-/Thy-1+ BDLSCs were isolated by magnetic bead cell sorting (MACS), and transduced with adenovirus-mediated IL-10 gene. The level of IL-10 protein secretion by BDLSCs was assessed by ELISA. The rats were divided randomly into four groups: normal group, model group, BDLSCs group and BDLSCs plus IL-10 group. IL-10 gene-modified BDLSCs from male rats were transplanted into female liver fibrosis rats via a branch of the portal vein. Sry gene was amplified by PCR to evaluate the implantation of BDLSCs in liver. Collagen area in liver tissues was detected by Van Gieson's (VG) staining. Expression of α-smooth muscle actin (α-SMA) protein in liver tissue was determined by Western blot. Hydroxyproline (Hyp) in liver tissues was quantified by the alkaline hydrolysis method. Extracellular matrix (ECM) proteins in serum were quantified by ELISA.
RESULTS: BDLSCs were successfully isolated by MACS. IL-10 secreted by IL-10 gene-modified BDLSCs presented persistently at a high level. Transduced BDLSCs were implanted successfully into impaired liver. Transplantation of IL-10 gene-modified BDLSCs lessened deposition of collagen, decreased α-SMA expression and thereby suppressed activation of hepatic stellate cells. Compared with the BDLSCs group, the level of Hyp in liver tissue decreased markedly in the BDLSCs plus IL-10 group (255.0 ± 50.5 μg/g vs 373.0 ± 26.7 μg/g, P < 0.01), and the levels of ECM proteins in serum also decreased (40.5 ± 7.7 μg/L vs 79.4 ± 10.3 μg/L, 61.5 ± 16.4 μg/L vs 77.7 ± 12.6 μg/L, 14.3 ± 0.8 μg/L vs 14.9 ± 1.5 μg/L, P < 0.01 or 0.05).
CONCLUSION: Transplantation of IL-10 gene-modified BDLSCs can effectively decrease accumulation of ECM in fibrotic liver in rats, suggesting the potential utility of this novel combined strategy of cell transplantation with gene therapy for the treatment of liver fibrosis.
- Citation: Lan L, Chen YW, Sun C, Liu BW, Sun QL. Transplantation of interleukin 10-modified bone marrow-derived liver stem cells reduces accumulation of extracellular matrix in fibrotic liver in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2231-2236
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2231.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2231
近年来, 设法使用骨髓干细胞(bone marrow stem cells, BMSCs)补充丢失的肝细胞以治疗急、慢性肝病成为研究热点之一. 其中, β2m-/Thy-1+骨髓源性肝干细胞(bone marrow-derived liver stem cells, BDLSCs)的成功分离[1-4]为肝病的治疗提供了更为适宜的种子细胞, 解决了混杂的BMSCs向肝细胞分化的不确定性[5-8]. 然而, 由慢性肝病发展而来的肝纤维化有其特殊的病理特征, 即功能性肝细胞减少和细胞外基质(extracellular matrix, ECM)过度积聚共存, 功能有限的BDLSCs却不能有效降解ECM[9]. 因此, 采取单纯BDLSCs移植治疗肝纤维化可能无法全面、有效地解决问题. 那么, 如何让BMSCs在弥补肝细胞数量的同时获得促进ECM降解的能力呢? 也许对其进行基因修饰不失为一种很好的选择. 我们在前期研究中, 已将抗炎症因子-白介素10(interleukin 10, IL-10)基因成功转导入BDLSCs[10]. 此次研究我们设想将IL-10基因修饰的BDLSCs移植入肝纤维化大鼠体内, 以期达到更好的促进ECM降解的目的, 为全面、有效地治疗肝纤维化提供新思路.
DMEM/F12培养液、胎牛血清为美国Gibco产品; 免疫磁珠荧光分选试剂盒为加拿大Stem Cell公司产品; 兔抗大鼠白蛋白(albumin, ALB)多克隆抗体为美国DAKO产品; 小鼠抗大鼠甲胎蛋白(α-fetoprotein, AFP)mAb为美国Sigma产品; FITC标记的羊抗兔(或小鼠)IgG抗体为美国Jackson产品; 核染色试剂DAPI为美国Sigma产品; 大鼠IL-10 ELISA试剂盒为美国R&D产品; 小鼠抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)mAb为美国Sigma公司产品; 小鼠抗大鼠β-肌动蛋白(β-actin)mAb为美国Santa Cruz公司产品; 透明质酸(hyaluronic acid, HA)、层粘连蛋白(laminin, LN)、Ⅲ型前胶原(procollagen Ⅲ, PCⅢ)ELISA试剂盒为上海海军医学研究所产品; 羟脯氨酸(hydroxyproline, Hyp)含量测定试剂盒为南京建成生物工程研究所产品.
1.2.1 免疫磁珠细胞分选(magnetic bead cell sorting, MACS)法分选β2m-/Thy-1+ BDLSCs: 按文献[2]使用免疫磁珠荧光分选试剂盒, 从胆总管结扎7 d的♂Wistar大鼠股骨和胫骨中分选出β2m-/Thy-1+ BDLSCs.
1.2.2 IL-10基因转导BDLSCs以及IL-10分泌水平检测: BDLSCs培养24 h后, 去除未贴壁细胞, 将腺病毒介导的IL-10基因以最佳转染复数500 pfu/mL[10]转导入BDLSCs, 再培养24 h后用于大鼠体内移植. 取部分转导后的细胞继续培养, 分别于转导2、4、6、8、10 d后收集培养液上清, 使用ELISA检测IL-10蛋白含量, 未经IL-10基因转导的单纯BDLSCs作为对照.
1.2.3 CCl4诱导的肝纤维化大鼠模型的建立及细胞移植: ♀Wistar大鼠被随机分为4组: (1)正常组(normal): 皮下注射橄榄油(3 mL/kg), 每周2次, 首剂加倍, 共注射8 wk; (2)模型组(model): 皮下注射体积分数400 mL/L CCl4(CCl4:橄榄油 = 2:3, 3 mL/kg), 注射次数和时间同正常组, 于4 wk末经门静脉分支输注无菌生理盐水(normal saline, NS)1 mL, 1:1000冰冷去甲肾上腺素/NS压迫注射部位止血, 关腹, 正常饲养; (3)BDLSCs组: 造模方法同模型组, 于4 wk末经门静脉分支输注β2m-/Thy-1+ BDLSCs悬液1 mL(2×105 cells/1 mL NS), 后续处理同模型组; (4)BDLSCs/IL-10组: 输注物为IL-10基因修饰β2m-/Thy-1+ BDLSCs悬液1 mL(2×105 cells/1 mL NS), 余同BDLSCs组. 大鼠于造模8 wk末处死, 留取全血和肝组织备用.
1.2.4 PCR法检测性别交叉移植BDLSCs的导入: 提取肝组织基因组DNA, 行PCR扩增, GAPDH为内参. 引物如下: Sry(NM_012772, 53℃, 217 bp), 5'-CATCGAAGGGTTAAAGTGCC-3'和5'-GCTGTTTCTGCTGTAGTGGGT-3'; GAPDH(NM_002046, 58℃, 450 bp), 5'-ACCACAGTCCATGCCATCAC-3'和5'- TCCACCACCCTGTTGCTGTA-3'. PCR反应条件: 94℃预变性5 min; 94℃变性30 s, 相应退火温度退火45 s, 72℃延伸45 s, 共30个循环; 72℃延伸7 min.
1.2.5 肝组织胶原面积测定: 采用VG染色法, 将肝组织石蜡切片脱蜡至水, 苏木素液深染10-15 min, VG中染1 min, 洗涤, 烘干, 脱水, 透明, 封片, 应用Image Quant 5.1图像分析软件对胶原染色面积进行定量.
1.2.6 Western blot法检测肝组织α-SMA蛋白表达: 提取肝组织蛋白, 定量, 与SDS上样缓冲液混合, 100℃沸水中加热3-5 min使蛋白变性; 制胶, 上样, 电泳, 切胶, 湿转膜器恒流250 mA转PVDF膜35-40 min; 1×TBST洗膜5 min×3次, 置于经封闭液稀释的一抗(小鼠抗大鼠α-SMA mAb: 1:1000稀释, 小鼠抗大鼠β-actin mAb: 1:500稀释)中, 4℃轻摇过夜; 1×TBST洗膜5 min×3次, 置于经1×TBST稀释的二抗(HRP标记山羊抗小鼠IgG: 1:5000稀释)中, 25℃轻摇2 h; 暗室中发光, 压片, 显影, 定影; 采用Quantity One 4.6.2 1-D灰度分析软件测量灰度值, 进行相对定量.
1.2.7 碱水解法检测肝组织Hyp含量: 称取肝组织, 操作步骤按试剂盒说明书进行, 使用分光光度计, 在550 nm处测定吸光度值(A值). 计算公式如下: Hyp含量(mg/g) = [(测定管A值-空白管A值)/(标准管A值-空白管A值)]×标准管含量(5 mg/L)×[水解液总体积(10 mL)/组织量].
1.2.8 血清HA、LN、PCⅢ水平检测: 采用ELISA法测定, 操作步骤按试剂盒说明书进行.
统计学处理 计量资料以mean±SD表示, 组间比较采用方差分析(ANOVA)或Kruskal-Wallis检验, P<0.05为差异有统计学意义.
利用MACS法能成功分离纯化β2m-/Thy-1+ BDLSCs. 流式分析显示, 分选后β2m-/Thy-1+细胞纯度持续高于96%, 细胞活力大于95%.
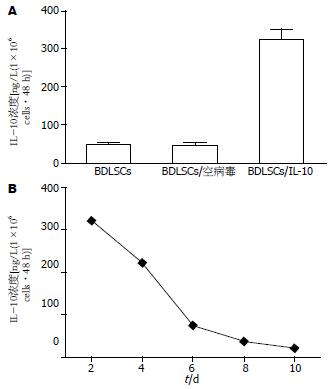
ELISA结果显示, IL-10修饰BDLSCs分泌的IL-10水平明显高于单纯BDLSCs和空载腺病毒修饰BLDSC的分泌水平(322.38±28.73 vs 46.11±7.36 vs 43.98±9.14 ng/L/1×106 cells•48 h)(P<0.01, 图1A), 且至少持续6 d呈高浓度水平(图1B).
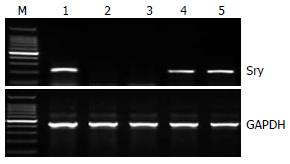
♂大鼠Y染色体性别决定基因Sry PCR检测结果发现, 移植4 wk后, 仍有外源性BDLSCs种植于肝脏, BDLSCs组和BDLSCs-/IL-10组的肝组织均呈Sry基因阳性表达, 而正常组和模型组则无(图2).
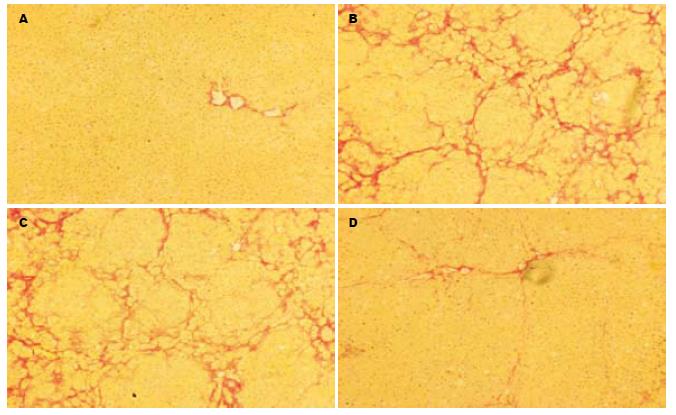
VG染色结果证实, 模型组大鼠肝组织内胶原纤维(红染区域)交连呈网状, 伴肝小叶结构紊乱; 单纯BDLSCs移植后, 肝组织胶原沉积有所减少, 纤维间隔变细, 肝小叶结构紊乱减轻; 而IL-10基因修饰BDLSCs移植后, 肝组织胶原沉积明显减少, 纤维间隔不明显, 肝小叶结构紊乱基本消失(图3).
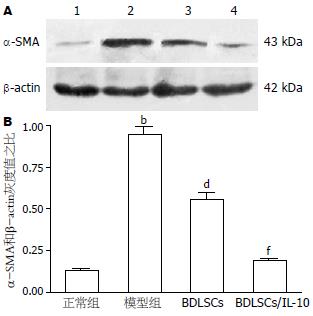
α-SMA表达增强是HSC活化的重要标志. Western blot结果显示, 与正常组相比, 模型组大鼠肝组织的α-SMA蛋白表达量显著增多(P<0.01); BDLSCs组α-SMA的表达则较模型组明显下调(P<0.01); 而BDLSCs/IL-10组α-SMA的表达量又较BDLSCs组进一步减少(P<0.01, 图4).
血清HA、LN和PCⅢ水平能反映肝组织ECM的沉积程度. ELISA检测结果显示, 模型组大鼠的血清HA、LN和PCⅢ水平较正常组明显升高(P<0.01); 而BDLSCs组和BDLSCs/IL-10组的上述3项指标均显著下降, 与模型组相比差异具有统计学意义(P<0.05), 其中对HA和LN这两项指标含量的抑制, IL-10基因修饰BDLSCs移植要强于单纯BDLSCs移植(P<0.01, 表1). 另一检测结果显示, 模型组大鼠肝组织的Hyp含量较正常组显著升高(P<0.01); BDLSCs组较模型组有所下降(P<0.05); 而BDLSCs/IL-10组又较BDLSCs组明显降低(P<0.01), 接近正常组水平(P>0.05, 表1).
肝纤维化是各种慢性肝病演变为肝硬化的必经阶段, 其迁延的病程使其具有不同于其他肝病如急性肝衰竭、遗传代谢性肝病等的病理特征, 即在功能性肝细胞相对减少的同时, 尚存在ECM的过度积聚. 然而, BDLSCs自身促进ECM降解、抑制肝组织纤维化形成的能力极其有限, 对已经破坏和异常重构的纤维支架很难恢复[9]. 正因如此, 多项研究发现, 单纯BDLSCs移植治疗肝纤维化的效果不佳[11-13]. 如能将转基因技术应用于干细胞, 则可能在一定程度上避开二者单独应用的弊端, 凸显优势[14]. 抗炎症因子IL-10是慢性肝病的重要保护因子, 能控制局部炎症反应以保护肝细胞, 并通过抑制炎症介质的释放和核因子κB活性等途径阻止肝纤维化的发生和发展[15-17]. IL-10修饰BDLSCs移植可能有利于肝内炎症反应的减轻、ECM的降解以及BDLSCs的增殖. 因此, 我们设想将目前公认的抗纤维化因子-IL-10基因转导入BDLSCs后再行体内移植, 以期增强ECM降解的作用.
我们在研究中选取经门静脉分支移植的原因有2点: (1)动物实验常用经外周静脉如尾静脉注射的方法必须历经全身体内循环, 这会降低种植于肝脏的细胞数量, 也会因细胞携带的腺病毒感染, 给多个器官带来毒性和免疫原性, 而经门静脉分支注射, 靶向性好, 可使大多数移植细胞直接进入门静脉而种植于肝内, 且避免了对其他器官的不必要损伤; (2)门静脉血流量大, 经其注射后不易止血, 而选取门静脉某一分支进行细胞移植, 出血量相对较少, 仅需冰冷去甲肾上腺素压迫, 即可迅速止血. 我们通过性别交叉移植后Y染色体基因的检测以验证供体细胞在肝内的种植情况, 结果提示, 经门静脉分支移植能够将BDLSCs有效导入肝脏, 在肝内种植至少维持4 wk.
肝组织胶原面积染色是最为直观的反映ECM沉积程度的指标. 我们通过观察发现, IL-10基因修饰BDLSCs移植较单纯BDLSCs移植更能广泛而明显的减少肝纤维化大鼠肝脏的胶原沉积, 改善肝纤维化程度. 肝组织Hyp的含量也能反映胶原代谢情况和ECM降解程度. 结果证实, IL-10基因修饰BDLSCs移植可显著降低肝组织Hyp含量, 其抑制作用明显强于单纯BDLSCs移植.
HSC的激活和增殖是肝纤维化发生、发展的关键环节[18]. 肝脏损伤时, HSC脂滴消失, 增殖活跃, 胞质内α-SMA产生增多, 表型转换为肌纤维母细胞, 合成和分泌大量转化生长因子-β1(transforming growth factor-β1, TGF-β1), 维持HSC在活化状态, 分泌大量ECM[19]. 其中α-SMA的表达被认为是HSC激活的标志, 常被用作判断活化HSC数量的指标[20]. 研究表明, 单纯BDLSCs和IL-10基因修饰BDLSCs移植均可使肝纤维化大鼠肝组织的α-SMA表达下调, 在整体水平上抑制HSC的激活和转化, 尤以IL-10基因修饰BDLSCs移植所起的抑制作用更为显著.
血清HA、PCⅢ和LN等ECM水平对肝纤维化的诊断和疗效判定具有重要意义[21]. 研究发现, 单纯BDLSCs与IL-10基因修饰BDLSCs移植降低血清PCⅢ水平的作用等同, 而在下调HA和LN含量方面, IL-10基因修饰BDLSCs移植的作用则优于单纯BDLSCs移植.
总之, IL-10基因修饰BDLSCs移植能明显减少胶原沉积, 抑制HSC活化, 促进ECM降解. 这一基因和干细胞联合移植的全新尝试为有效治疗肝纤维化提供了可行思路. 我们后续还将对IL-10基因修饰BDLSCs移植是否能切实逆转大鼠肝纤维化、改善肝功能以及提高存活率和生存质量进行全面评价.
肝纤维化同时具有功能性肝细胞减少和细胞外基质(ECM)过度积聚两方面的病理特征, 而现有的肝纤维化治疗方法以及正在探索的实验研究均不能同时解决上述两方面问题. 其中, 利用骨髓源性肝干细胞(BDLSCs)移植治疗肝纤维化, 降解ECM的能力就极其有限, 治疗肝纤维化的总体效果不佳.
张凤春, 教授, 上海交通大学医学院附属仁济医院肿瘤中心; 倪润洲, 教授, 南通大学附属医院消化内科
利用骨髓干细胞(BMSCs)移植治疗肝纤维化已成为研究热点. 然而, BMSCs向肝细胞分化的不确定性以及降解ECM能力的有限性限制了其在肝纤维化治疗中的应用, 如能解决上述问题, 将为提高肝纤维化治疗的全面性和有效性开辟新途径.
Avital et al从大鼠BMSCs中成功分离出具有肝细胞特异性表型的β2m-/Thy-1+ BDLSCs, 解决了混杂的BMSCs向肝细胞分化的不确定性, 为肝病的治疗提供了更为适宜的种子细胞. Hung et al利用抗炎症因子IL-10治疗大鼠肝纤维化, 显示出ECM降解作用, 阻止肝纤维化的发展. 如能将二者联合应用, 对肝纤维化的治疗可能大有裨益.
本研究将转基因技术应用于干细胞, 利用IL-10基因和BDLSCs联合移植治疗肝纤维化, 二者相辅相成, 兼顾了两方面的病理改善, 对肝纤维化可能起到双重逆转作用, 是全面治疗肝纤维化的全新尝试.
肝纤维化的病理改变尚属于可逆期, 以此为切入点进行早期治疗, 有望改善病情.
β2m-/Thy-1+骨髓源性肝干细胞: 从骨髓干细胞中分选出的一种细胞亚群, 其细胞膜表型为Thy-1(即CD90)阳性, β2m(即β2-微球蛋白)阴性, 该干细胞亚群表达肝细胞特异性表型, 具有向成熟肝细胞分化倾向, 因此被称为"β2m-/Thy-1+骨髓源性肝干细胞".
本文实验设计合理, 统计学方法正确, 研究内容有一定的创新性和潜在的科学价值.
编辑: 李军亮 电编:何基才
| 1. | Avital I, Inderbitzin D, Aoki T, Tyan DB, Cohen AH, Ferraresso C, Rozga J, Arnaout WS, Demetriou AA. Isolation, characterization, and transplantation of bone marrow-derived hepatocyte stem cells. Biochem Biophys Res Commun. 2001;288:156-164. [PubMed] [DOI] |
| 2. | 兰 玲, 孙 超, 陈 源文, 李 定国. 大鼠β2m-/Thy-1+骨髓源性肝干细胞的体外分选及鉴定. 上海交通大学学报(医学版). 2007;27:1293-1296. |
| 3. | Inderbitzin D, Avital I, Gloor B, Keogh A, Candinas D. Functional comparison of bone marrow-derived liver stem cells: selection strategy for cell-based therapy. J Gastrointest Surg. 2005;9:1340-1345. [PubMed] [DOI] |
| 4. | Wang C, Chelly MR, Chai N, Tan Y, Hui T, Li H, Farkas DL, Demetriou AA. Transcriptomic fingerprinting of bone marrow-derived hepatic beta2m-/Thy-1+ stem cells. Biochem Biophys Res Commun. 2005;327:252-260. [PubMed] [DOI] |
| 5. | Kanazawa Y, Verma IM. Little evidence of bone marrow-derived hepatocytes in the replacement of injured liver. Proc Natl Acad. Sci U S A. 2003;100 Suppl 1:11850-11853. [PubMed] [DOI] |
| 6. | Baba S, Fujii H, Hirose T, Yasuchika K, Azuma H, Hoppo T, Naito M, Machimoto T, Ikai I. Commitment of bone marrow cells to hepatic stellate cells in mouse. J Hepatol. 2004;40:255-260. [PubMed] [DOI] |
| 7. | Kisseleva T, Uchinami H, Feirt N, Quintana-Bustamante O, Segovia JC, Schwabe RF, Brenner DA. Bone marrow-derived fibrocytes participate in pathogenesis of liver fibrosis. J Hepatol. 2006;45:429-438. [PubMed] [DOI] |
| 8. | Forbes SJ, Russo FP, Rey V, Burra P, Rugge M, Wright NA, Alison MR. A significant proportion of myofibroblasts are of bone marrow origin in human liver fibrosis. Gastroenterology. 2004;126:955-963. [PubMed] [DOI] |
| 9. | Ishikawa T, Terai S, Urata Y, Marumoto Y, Aoyama K, Sakaida I, Murata T, Nishina H, Shinoda K, Uchimura S. Fibroblast growth factor 2 facilitates the differentiation of transplanted bone marrow cells into hepatocytes. Cell Tissue Res. 2006;323:221-231. [PubMed] [DOI] |
| 10. | 兰 玲, 陈 源文, 孙 超, 孙 巧玲, 李 定国. 腺病毒介导的白介素10基因体外转导大鼠β2m-/Thy-1+骨髓源性肝干细胞. 胃肠病学和肝病学杂志. 2008;17:22-26. |
| 11. | Russo FP, Alison MR, Bigger BW, Amofah E, Florou A, Amin F, Bou-Gharios G, Jeffery R, Iredale JP, Forbes SJ. The bone marrow functionally contributes to liver fibrosis. Gastroenterology. 2006;130:1807-1821. [PubMed] [DOI] |
| 12. | Shackel N, Rockey D. In pursuit of the "Holy Grail"--stem cells, hepatic injury, fibrogenesis and repair. Hepatology. 2005;41:16-18. [PubMed] [DOI] |
| 13. | Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40:1304-1311. [PubMed] [DOI] |
| 14. | Moore DJ, Markmann JF, Deng S. Avenues for immunomodulation and graft protection by gene therapy in transplantation. Transpl Int. 2006;19:435-445. [PubMed] [DOI] |
| 15. | Safadi R, Ohta M, Alvarez CE, Fiel MI, Bansal M, Mehal WZ, Friedman SL. Immune stimulation of hepatic fibrogenesis by CD8 cells and attenuation by transgenic interleukin-10 from hepatocytes. Gastroenterology. 2004;127:870-882. [PubMed] [DOI] |
| 16. | Hung KS, Lee TH, Chou WY, Wu CL, Cho CL, Lu CN, Jawan B, Wang CH. Interleukin-10 gene therapy reverses thioacetamide-induced liver fibrosis in mice. Biochem Biophys Res Commun. 2005;336:324-331. [PubMed] [DOI] |
| 17. | 孙 巧玲, 李 定国, 胡 良凯, 孙 超, 汪 保灿, 陈 源文. AdIL-10对肝星状细胞α-SMA、TGF-β1及TNF-α表达的影响. 胃肠病学和肝病学杂志. 2006;15:100-105. |
| 18. | Gressner AM, Weiskirchen R. The tightrope of therapeutic suppression of active transforming growth factor-beta: high enough to fall deeply? J Hepatol. 2003;39:856-859. [PubMed] [DOI] |
| 19. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 20. | Carpino G, Morini S, Ginanni Corradini S, Franchitto A, Merli M, Siciliano M, Gentili F, Onetti Muda A, Berloco P, Rossi M. Alpha-SMA expression in hepatic stellate cells and quantitative analysis of hepatic fibrosis in cirrhosis and in recurrent chronic hepatitis after liver transplantation. Dig Liver Dis. 2005;37:349-356. [PubMed] [DOI] |
| 21. | Gressner OA, Weiskirchen R, Gressner AM. Biomarkers of liver fibrosis: clinical translation of molecular pathogenesis or based on liver-dependent malfunction tests. Clin Chim Acta. 2007;381:107-113. [PubMed] [DOI] |