修回日期: 2009-06-25
接受日期: 2009-06-29
在线出版日期: 2009-07-28
目的: 探讨18F-FDG PET/C对进展期胃癌治疗前评估的可行性.
方法: 回顾性分析40例进展期胃癌患者18F-FDG PET/CT常规检查结果资料, 与内镜、手术病理和临床随访作对照; 其中14例患者行根治性手术, 余行化疗或姑息治疗. 根据解剖部位将淋巴结分为N1+N2和N3组, 淋巴结有无转移以组为单位. 原发灶、淋巴结及其他器官转移灶的判断通过目测分析结合标准化摄取值来确定.
结果: PET/CT对胃原发癌的灵敏度为97.5%. PET和CT的灵敏度分别为65%和90%; 14例根治手术患者N1、N2淋巴结有无转移PET/CT的确诊率为85.7%, 灵敏度为71.4%, 特异性为77.8%; 对N3淋巴结的灵敏度为100%. PET/CT发现21处临床未怀疑的转移灶; PET/CT检查后40%(16/40)的病例分期发生变化.
结论: 18F-FDG PET/CT可用于进展期胃癌的治疗前评估.
引文著录: 王欣, 于丽娟, 王大龙, 贾承晔, 田墨涵. 18F-FDG PET/CT对进展期胃癌治疗前评估的可行性. 世界华人消化杂志 2009; 17(21): 2159-2163
Revised: June 25, 2009
Accepted: June 29, 2009
Published online: July 28, 2009
AIM: To investigate the feasibility of using 18F-FDG PET/CT for pretherapeutic evaluation of advanced gastric cancer.
METHODS: The clinical records of 40 advanced gastric cancer patients who underwent 18F-FDG PET/CT before treatment were reviewed retrospectively. Of these patients, 14 patients underwent radical gastrectomy, and the other patients underwent chemotherapy or palliative gastrectomy. The lymph nodes were classified into two groups (N1 + N2 group and N3 group) based on anatomic sites. Lymph node metastasis was assessed on group basis. All PET/CT images were interpreted according to visual evaluation and standardized uptake values (SUVs).
RESULTS: The diagnostic sensitivity of 18F-FDG PET/CT, PET and CT for primary tumors was 97.5%, 65% and 90%, respectively. The sensitivity, specificity, and accuracy of 18F-FDG PET/CT for N1 + N2 metastases were 71.4%, 77.8% and 85.7%, respectively, while the sensitivity of PET/CT for N3 metastases was 100%. PET/CT detected 21 cases of metastases undetected by routine method. Accordingly, the TNM stage of tumors was upgraded in 40% of patients.
CONCLUSION: It is feasible to use 18F-FDG PET/CT for pretherapeutic evaluation of advanced gastric cancer, and the diagnostic outcomes revealed by PET/CT may have a clinically significant impact on the choice of initial therapy.
- Citation: Wang X, Yu LJ, Wang DL, Jia CY, Tian MH. Feasibility of using 18F-FDG PET/CT for pretherapeutic evaluation of advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2159-2163
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2159
胃癌在世界范围内发病率和死亡率均居恶性肿瘤前2位. 在我国胃癌男、女性世界调整死亡率均居于首位, 并且呈逐年上升趋势[1]. 临床上进展期胃癌占大多数, 治疗手段是以手术为主的综合治疗, 即手术切除辅以化疗、放疗、免疫治疗等其他治疗, 近年来, 在临床开展的术前辅助化疗, 即新辅助化疗治疗效果较满意, 日益引起重视[2], 因此, 进展期胃癌治疗前的全面评价, 包括对淋巴结转移的精确诊断, 对恰当的治疗策略的制定影响重大. 18氟-氟脱氧葡萄糖-正电子发射断层显像(18F-FDG PET), 虽然在肺癌等恶性肿瘤的诊断、分期或再分期以及疗效监测有很高的准确度, 但对胃癌的应用受限, 主要因为PET对早期胃癌和部分进展期胃癌原发灶、淋巴结转移的灵敏度较低[3-6], 其临床价值在于发现远隔转移和伴发的其他恶性病变[7].
正电子发射计算机断层成像/X线计算机断层成像(PET/CT), 于1998年由Townsend et al首先研制成功, 将PET和CT同机融合的PET/CT提供了最大限度的改善肿瘤的诊断、分期、远处播散灶的发现和定位的可能性[8]. 近些年, PET/CT已在多种消化器官肿瘤的应用上显示出优势[9-10], 但有关胃癌的研究较少; 最近2年有3位作者报道了18F-FDG PET/CT在胃癌术后复发监测中的应用[11-13], 结果并不一致; 但有学者提出PET/CT两种影像的互补, 有可能改变18F-FDG PET在胃癌评估中灵敏度较低的现状[14]. 本文的目的即在探讨18F-FDG PET/CT对进展期胃癌治疗前评估的可行性.
回顾分析40例进展期胃癌患者18F-FDG PET/CT常规检查的影像资料和临床资料; 全部病例18F-FDG PET/CT显像前未行针对胃癌的任何治疗; 糖尿病患者, 空腹血糖水平高于6.1 mmol/L的不在入选之列. 患者中男28例, 女12例, 年龄41-80岁; 原发灶10例位于上1/3, 18例位于中1/3, 12例位于下1/3; Bormann分型: Ⅰ型5例, Ⅱ型6例, Ⅲ型21例, Ⅳ型8例; 组织学类型: 高分化腺癌12例, 中分化腺癌8例, 低分化腺癌14例, 印戒细胞癌6例; 27例淋巴结转移; 8例肝转移, 3例肺转移, 5例骨转移, 2例肾上腺转移; 腹膜种植转移13例. 临床常规分期检查包括临床体格检查、胃镜、胸部平片或CT、骨骼ECT、上腹部CT及全腹超声. 其中14例行根治性手术, 余行化疗或姑息性治疗.
1.2.1 18F-FDG PET/CT检查: 检查前禁食6 h以上, 静脉注射18F-FDG 0.8-0.12 mCi/kg, 平静休息40-75 min后行PET/CT扫描, 扫描前po 500 mL纯净水, 以使胃腔膨胀. PET/CT扫描仪为Discovery ST(GE Corporation), PET 2D模式扫描, 2.5 min/床位, 迭代法重建; CT螺旋扫描200 mA, 0.75螺距, 3.75 mm层厚. 以CT数据为PET作衰减校正. 18F-FDG经mini-TRACE(GE Corporation)和FN自动化合成系统生产, 放化纯度大于98%.
1.2.2 图像分析方法: 在Xeleris图像处理工作站, 由2位有经验的医师共同阅读图像, 阅读前未告知胃镜检查结果, 以2位医师协商一致的意见为结果. PET判断胃癌以目测为主, 目测法以胃区的局灶放射性浓聚为恶性病变, 较弥漫的类似肝脏的放射性浓聚视为生理性摄取; CT以胃壁出现局限不规则增厚和密度较致密为胃癌确定表现; PET/CT图像融合后, 机器自带软件自动计算的SUV(标准化摄取值), 原发灶、淋巴结及其他器官转移灶SUV的最大值被记录. 淋巴结和其他器官转移转移以目测结合SUV值判断, 通常以SUVmax大于2.5为阳性.
1.2.3 诊断标准: 手术病理或上消化道内窥镜对原发灶; CT和临床随访对肝、肾上腺、淋巴结和肺转移; CT、脱落细胞和临床随访证实腹水、腹膜和胸膜的播散转移; 骨扫描和临床随访证实骨转移. 临床随访为: 可疑病变在初次发现和随后的复查比较有大小变化, 被判定为肯定的病灶.
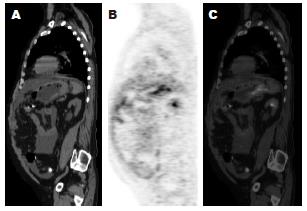
高、中分化腺癌摄取值多数较高, SUVmax: 3.3-13.5; 低分化腺癌摄取值范围较宽, SUVmax: 1.6-9.0(图1-2); 印戒细胞癌摄取偏低, SUVmax: 2.2-4.7, 平均值为3.7±0.9. 40例中单纯PET可确定26例为胃癌, 其余14例摄取程度较轻, 或难以和生理性摄取区分, 灵敏度65%; CT确定36例为胃癌, 灵敏度90%; PET/CT融合后可区分出39例胃癌, 灵敏度97.5%.
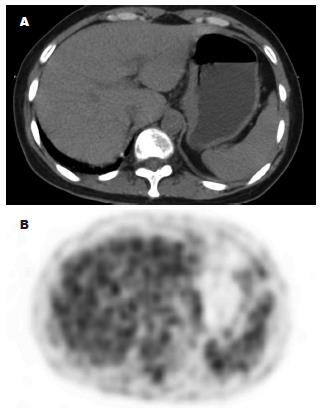
14例根治手术患者N1、N2淋巴结有无转移PET/CT总的正确诊断率85.7%, 灵敏度为71.4%, 特异性为77.8%(图3); 2例假阴性分别见于印戒细胞癌和低分化腺癌, 原发灶的摄取值分别为3.7和4.8, CT上可见胃周有小淋巴结, 但PET未见放射性摄取. 对N3淋巴结的灵敏度为100%.
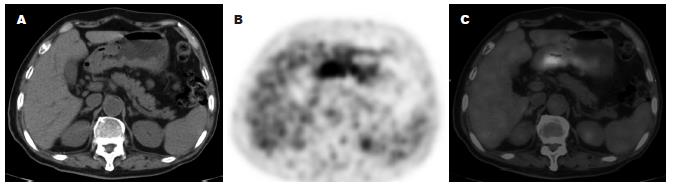
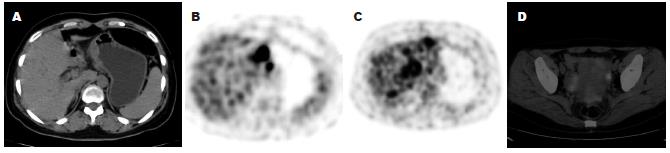
13例腹膜种植转移, PET/CT检查前仅发现3例. PET/CT正确诊断10例(76.9%), 8例PET上可见放射性摄取, SUVmax介于1.9-14.7, 5例无可辨的放射性摄取; 10例CT上可见网膜、腹膜增厚, 表现为脂肪间隙的混浊、索条影及结节、肿块形成, 少量积液, 但7例平扫CT漏诊(图4); 血行转移18处(肝转移8例, 骨转移5例, 肺转移3例, 肾上腺转移2例), PET/CT检查前仅发现7处. 肝转移SUVmax介于4.4-9.7, 多见于高分化腺癌(6/8). 骨转移SUVmax介于2.3-22.5, 多见于低分化腺癌(3/5); 3例CT上表现为以成骨为主的混合性骨破坏, 2例为溶骨破坏, 18F-FDG摄取值均高于原发灶. 肺转移3例, 都为低分化腺癌, CT为多发软组织密度小结节, PET未见放射性摄取. 肾上腺转移1例为双肾上腺肿块, 1例为单发肾上腺结节, SUVmax分别为13.0、7.0.
PET/CT检查后40%(16/40)的病例分期发生变化, 其中N分期下调2例, M分期下调1例, N分期上调5例, M分期上调8例.
进展期胃癌的原发灶的18F-FDG摄取表现多样, 部分腺癌摄取程度较高, 而印戒细胞癌和部分低分化腺癌的摄取较低[15-17], 甚至在单纯PET图像上难以和生理摄取区分; 一体化的PET/CT将放射性浓聚和CT形态有机的结合, 根据CT胃壁是否增厚、僵硬, 能够鉴别一部分生理性摄取和病变摄取, 显著提高原发癌的诊断阳性率. 需要注意的是PET/CT扫描前要让受检者充分饮水, 使胃壁舒张, 有助于减少胃壁的生理性摄取[18-20]和CT的诊断.
目前, 国内外缺少大样本的PET/CT在胃癌N分期应用的研究. 在我们14例根治手术患者的淋巴结转移的PET/CT图像分析中, 仍主要以淋巴结的SUV值≥2.5为阳性诊断标准, 对N1+N2淋巴结转移总的准确率为85.7%, N3淋巴结的阳性率为100%. 我们的研究中, 影响淋巴结诊断灵敏度的主要原因为黏液腺癌和印戒细胞癌转移淋巴结的低摄取, 这与Kim et al[21]的研究一致. 国外学者报道由于PET图像上胃周淋巴结常与原发灶融为一团, 无法区分, 导致单纯PET对N1淋巴结的检出不理想[16], 但PET显示出对淋巴结转移有很高的特异性[16,21]. 国内21例胃癌的研究显示, PET判断淋巴结转移的准确率和术中淋巴结评估的准确率接近, 为85.7%[22]. 已有学者提出将PET与CT结合, 有可明显改善胃癌的手术前分期[23], 但PET与CT如何结合, 其应用方法和诊断标准尚需进一步探索.
18F-FDG PET/CT对进展期胃癌胸部至腹腔远隔转移有很高的价值, 在我们的研究中PET/CT发现了21处未被临床怀疑的转移灶, 使40%的病例临床TNM分期发生变化. 我们的研究显示PET/CT对肝转移、骨转移以及腹膜转移都有很高的灵敏度, 与Yoshioka et al[15]的单纯PET的研究报告不同, 这得益于PET与CT的同机图像的互相补充, 使单纯PET上摄取较低的成骨转移、单纯PET上与胃肠道生理摄取难以区分的腹腔的异常放射性浓聚得到有效诊断; PET/CT有可能明显提高进展期胃癌治疗前分期的准确性, 从而有利于治疗决策的选择.
我们当前的回顾性研究还存在一定的缺陷, 根治手术病例较少, 未区分PET/CT对N1和N2淋巴结转移的诊断效能, 因而尚不能肯定PET/CT对淋巴结清扫范围的指导作用, 这有赖于进一步的前瞻性研究. 此外, PET/CT对进展期胃癌的诊断价值尚需与临床常用的增强MSCT进一步比较.
胃癌是人类最常见的恶性肿瘤之一, 在世界范围内发病率和死亡率均居恶性肿瘤前2位. 临床上进展期胃癌占大多数, 进展期胃癌治疗前的全面评价, 包括对淋巴结转移的精确诊断, 对恰当的治疗策略的制定影响重大.
张小晋, 主任医师, 北京积水潭医院消化内科.
正电子发射计算机断层成像/X线计算机断层成像(PET/CT), 将PET的功能成像和CT解剖成像整合为一体化成像仪, 于1998年由Townsend et al首先研制成功, 大量的临床应用显示PET与CT的融合图像对多种肿瘤的诊断与分期及治疗反应的评价具有重要价值, 但其在进展期胃癌的临床应用价值还未确定.
最近2年有2位作者分别报道了18F-FDG PET/CT对胃癌术后复发的监测有较高的应用价值; 也有学者提出PET/CT两种影像的互补, 有可能改变18F-FDG PET在胃癌评估中灵敏度较低的现状, 从而改善胃癌临床分期的精确度.
PET/CT扫描前应嘱患者充分饮水, 使胃壁舒张, 有助于减少胃壁的生理性摄取和CT的诊断.
1 PET: 正电子发射断层显像技术, 是经静脉注射微量标记了正电子核素的示踪剂, 在体外通过晶体探头探测正电子核素衰变发射的伽马射线, 进行断层成像的一种医学成像技术.
2 PET/CT: 是将一台PET成像仪和一台X线计算机断层成像仪(CT)放置在同一个机架内, 两者共用同一个扫描床的复合成像设备, 应用时进行CT和PET的成像, 可将两种医学图像精确融合成复合影像, 有利于病变的发现、定位和定性.
本研究立题较好, 设计合理, 因为是回顾性研究, 所以得出的结论有待进一步大范围的临床观察和考证.
编辑: 李军亮 电编:吴鹏朕
| 1. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:101-105. |
| 3. | Shoda H, Kakugawa Y, Saito D, Kozu T, Terauchi T, Daisaki H, Hamashima C, Muramatsu Y, Moriyama N, Saito H. Evaluation of 18F-2-deoxy-2-fluoro-glucose positron emission tomography for gastric cancer screening in asymptomatic individuals undergoing endoscopy. Br J Cancer. 2007;97:1493-1498. [PubMed] [DOI] |
| 4. | Kwee RM, Kwee TC. Imaging in assessing lymph node status in gastric cancer. Gastric Cancer. 2009;12:6-22. [PubMed] [DOI] |
| 6. | Yamada A, Oguchi K, Fukushima M, Imai Y, Kadoya M. Evaluation of 2-deoxy-2-[18F]fluoro-D-glucose positron emission tomography in gastric carcinoma: relation to histological subtypes, depth of tumor invasion, and glucose transporter-1 expression. Ann Nucl Med. 2006;20:597-604. [PubMed] [DOI] |
| 7. | Mukai K, Ishida Y, Okajima K, Isozaki H, Morimoto T, Nishiyama S. Usefulness of preoperative FDG-PET for detection of gastric cancer. Gastric Cancer. 2006;9:192-196. [PubMed] [DOI] |
| 8. | Beyer T, Townsend DW, Brun T, Kinahan PE, Charron M, Roddy R, Jerin J, Young J, Byars L, Nutt R. A combined PET/CT scanner for clinical oncology. J Nucl Med. 2000;41:1369-1379. [PubMed] |
| 10. | Jadvar H, Henderson RW, Conti PS. 2-deoxy-2-[F-18]fluoro-D-glucose-positron emission tomography/computed tomography imaging evaluation of esophageal cancer. Mol Imaging Biol. 2006;8:193-200. [PubMed] [DOI] |
| 11. | Park MJ, Lee WJ, Lim HK, Park KW, Choi JY, Kim BT. Detecting recurrence of gastric cancer: the value of FDG PET/CT. Abdom Imaging. 2008; Jun 10. [Epub ahead of print]. [PubMed] |
| 12. | Sim SH, Kim YJ, Oh DY, Lee SH, Kim DW, Kang WJ, Im SA, Kim TY, Kim WH, Heo DS. The role of PET/CT in detection of gastric cancer recurrence. BMC Cancer. 2009;9:73. [PubMed] [DOI] |
| 13. | Sun L, Su XH, Guan YS, Pan WM, Luo ZM, Wei JH, Wu H. Clinical role of 18F-fluorodeoxyglucose positron emission tomography/computed tomography in post-operative follow up of gastric cancer: initial results. World J Gastroenterol. 2008;14:4627-4632. [PubMed] [DOI] |
| 14. | Rosenbaum SJ, Stergar H, Antoch G, Veit P, Bockisch A, Kühl H. Staging and follow-up of gastrointestinal tumors with PET/CT. Abdom Imaging. 2006;31:25-35. [PubMed] [DOI] |
| 15. | Yoshioka T, Yamaguchi K, Kubota K, Saginoya T, Yamazaki T, Ido T, Yamaura G, Takahashi H, Fukuda H, Kanamaru R. Evaluation of 18F-FDG PET in patients with advanced, metastatic, or recurrent gastric cancer. J Nucl Med. 2003;44:690-699. [PubMed] |
| 16. | Yun M, Lim JS, Noh SH, Hyung WJ, Cheong JH, Bong JK, Cho A, Lee JD. Lymph node staging of gastric cancer using (18)F-FDG PET: a comparison study with CT. J Nucl Med. 2005;46:1582-1588. [PubMed] |
| 17. | Stahl A, Ott K, Weber WA, Becker K, Link T, Siewert JR, Schwaiger M, Fink U. FDG PET imaging of locally advanced gastric carcinomas: correlation with endoscopic and histopathological findings. Eur J Nucl Med Mol Imaging. 2003;30:288-295. [PubMed] |
| 18. | Tian J, Chen L, Wei B, Shao M, Ding Y, Yin D, Yao S. The value of vesicant 18F-fluorodeoxyglucose positron emission tomography (18F-FDG PET) in gastric malignancies. Nucl Med Commun. 2004;25:825-831. [PubMed] [DOI] |
| 19. | Yun M, Choi HS, Yoo E, Bong JK, Ryu YH, Lee JD. The role of gastric distention in differentiating recurrent tumor from physiologic uptake in the remnant stomach on 18F-FDG PET. J Nucl Med. 2005;46:953-957. [PubMed] |
| 20. | Kamimura K, Fujita S, Nishii R, Wakamatsu H, Nagamachi S, Yano T, Ogita M, Umemura Y, Fujimoto T, Nakajo M. An analysis of the physiological FDG uptake in the stomach with the water gastric distention method. Eur J Nucl Med Mol Imaging. 2007;34:1815-1818. [PubMed] [DOI] |
| 21. | Kim SK, Kang KW, Lee JS, Kim HK, Chang HJ, Choi JY, Lee JH, Ryu KW, Kim YW, Bae JM. Assessment of lymph node metastases using 18F-FDG PET in patients with advanced gastric cancer. Eur J Nucl Med Mol Imaging. 2006;33:148-155. [PubMed] [DOI] |