修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-07-28
目的: 探讨瘦素(leptin)在肝纤维化组织中的表达及其与肝纤维化过程中转化生长因子(TGF-β1)以及α平滑肌肌动蛋白(α-SMA)表达的相关性, 了解leptin与肝星状细胞(HSC)活化的关系.
方法: 健康♂SD大鼠40只, 随机分成正常对照组和CCl4诱导的肝纤维化模型组. 于造模2、4、6 wk末分批处死动物, 分别采用RT-PCR和Western blot、免疫组织化学方法联合检测leptin、TGF-β1及α-SMA在肝纤维化组织中的表达.
结果: 正常对照组肝脏组织中leptin、TGF-β1、α-SMA均有微量表达; CCl4注射2 wk后, leptin、TGF-β1、α-SMA表达开始增强, 2、4、6 wk肝组织中的表达强度呈明显递增趋势(P<0.05). leptin与TGF-β1和α-SMA表达均呈显著相关性(r = 0.668, 0.570, 均P<0.05).
结论: leptin的阳性表达随着肝纤维化程度的加重而增强. 在肝纤维化过程中leptin可能参与了HSC活化、增殖以及ECM的合成.
引文著录: 许晶, 朱净, 潘亮, 陆静贤, 肖明兵, 黄华, 倪润洲, 陆翠华. 瘦素在肝纤维化组织中的表达及其与肝星状细胞活化的关系. 世界华人消化杂志 2009; 17(21): 2127-2130
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: July 28, 2009
AIM: To investigate the expression of leptin in hepatic fibrosis and explore its correlation with the expression of TGF-β1 and α-SMA as well as its relation with the activation of hepatic stellate cells (HSC).
METHODS: Forty healthy male SD rats were randomly divided into normal control group and carbon tetrachloride treatment group. The rats were given a subcutaneous injection of either vehicle or carbon tetrachloride, and sacrificed at weeks 2, 4 and 6 after the injection, respectively. The mRNA and protein expression of leptin, TGF-β1 and α-SMA was assayed by reverse transcription-polymerase chain reaction (RT-PCR), Western blot and immunohistochemistry, respectively.
RESULTS: Leptin, TGF-β1 and α-SMA were lowly expressed in normal liver tissues. After injection of carbon tetrachloride, the expression of leptin, TGF-β1 and α-SMA began to increase at week 2 and was significantly higher at weeks 4 and 6 (P < 0.05), showing a gradually rising trend. The expression of leptin was positively correlated with that of TGF-β1 and α-SMA (r = 0.668 and 0.570, respectively; both P < 0.05).
CONCLUSION: The expression of leptin, TGF-β1 and α-SMA increases with the development of hepatic fibrosis. Leptin is probably involved in the activation of HSCs and the synthesis of extracellular matrix (ECM) in the development of hepatic fibrosis.
- Citation: Xu J, Zhu J, Pan L, Lu JX, Xiao MB, Huang H, Ni RZ, Lu CH. Expression of leptin in hepatic fibrosis and its relation with hepatic stellate cell activation. Shijie Huaren Xiaohua Zazhi 2009; 17(21): 2127-2130
- URL: https://www.wjgnet.com/1009-3079/full/v17/i21/2127.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i21.2127
leptin是由肥胖基因编码的一种由167个氨基酸组成的分泌型蛋白质[1], 主要由脂肪细胞分泌. 目前对于leptin的研究已由单纯的食欲控制和能量消耗[2-3], 扩展到免疫应答、血细胞生成、血管发生以及组织新陈代谢的调节过程. 1998年, Potter et al[4]发现分离培养的大鼠, 肝星状细胞(hepatic stellate cells, HSC)可大量表达leptin mRNA和蛋白后, leptin与肝病的关系开始受到关注. 本研究采用CCl4皮下注射制备肝纤维化模型, 分别用免疫组织化学和RT-PCR、Western blot联合检测leptin在肝纤维组织中的动态表达, 旨在进一步了解leptin在肝纤维化发生发展中的意义.
♂Sprague-Dawley大鼠40只, 体质量150±20 g, 由南通大学动物实验中心提供. RT-PCR两步法试剂盒购自上海捷瑞生物工程有限公司产品, PCR扩增用引物由上海生工生物工程技术服务有限公司设计并合成. 一抗兔抗大鼠leptin与转化生长因子β1(transforming growth factor-β1, TGF-β1)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)二抗均购自武汉博士德生物工程有限公司, 免疫组织化学试剂盒购自北京中杉生物有限公司.
1.2.1 分组及给药: SD大鼠用随机抽签法分为正常对照组和模型组. 正常对照组, 给予橄榄油溶液3 mL/kg皮下注射, 每周2次, 共6 wk; 模型2、4、6 wk组, 给予600 mL/L CCl4(精制橄榄油配置)3 mL/kg皮下注射, 每周称体质量1次, 根据体质量调整药物用量. 第6周模型组大鼠死亡2只.
1.2.2 标本处理: 于造模2、4、6 wk末分批处死大鼠, 大鼠处死时距离CCl4注射时间为72 h. 第2、4周末分别处死模型组大鼠8只, 正常对照组2只; 第6周末处死模型组大鼠14只, 正常对照组4只. 大鼠处死后, 取出肝脏, 一部分经冷生理盐水灌注冲洗残血后采用液氮快速冷冻并置-80℃冰箱中保存待测; 另一部分于100 g/L甲醛固定, 用于免疫组织化学及纤维化组织病理学观察.
1.2.3 RT-PCR检测leptin与TGF-β1、α-SMA mRNA的表达: 从GenBank查取leptin与TGF-β1、α-SMA基因序列, 以Primer5软件设计引物各一对, leptin: 5'-TGG TCC TAT CTG TCC TAT GTT-3', 5'-GGA GGT TCT CGC AGG TTC T-3'片段大小286 bp; TGF-β1: 5'-GCT AAT GGT GGA CCG CAA C-3', 5'-GCA GTG AGC ACT GAA GCG A-3'片段大小340 bp; α-SMA: 5'-CAG CGA TAA ACC AAC AAC A-3', 5'-ATA GGG ACC TCA GCA CAA A-3'片段大小570 bp; 内参照GAPDH: 5'-AAC GAC CCC TTC ATT GAC-3', 5'-TCC ACG ACA TAC TCA GCA C-3'片段大小191 bp. 上述引物均由上海生工生物技术服务有限公司合成. 采用TRIzol法提取肝组织总RNA. 按两步法RT-PCR试剂盒操作说明逆转录cDNA, 并进行PCR扩增. PCR产物经20 g/L琼脂糖凝胶电泳, 观察扩增条带.
1.2.4 Western blot检测leptin与TGF-β1、α-SMA蛋白的表达: 肝组织匀浆, 裂解液裂解后蛋白定量, 然后通过SDS-PAGE电泳分离, 硝酸纤维膜转膜后封闭2 h, 分别加入leptin与TGF-β1、α-SMA和β-actin一抗孵育过夜, 加leptin与TGF-β1、α-SMA和β-actin二抗孵育1 h后, 化学发光法显示蛋白条带, 胶片显影、定影.
1.2.5 免疫组织化学检测leptin与TGF-β1、α-SMA蛋白的表达: 在高倍镜下, 每张切片随机观察5个高倍视野, 根据细胞着色深度及阳性细胞数分别记分为0-3分, 着色深度以多数细胞呈色程度为准. 凡细胞质或腺腔内黏液着浅棕色者为1分、棕色者2分、深棕色者为3分、不着色为0分; 整块切片中阳性细胞占所有细胞中的比例<30%为1分、30%-70%为2分、>70%为3分、无细胞着色为0分. 根据上述2项指标的积分数分为4级, 0分为阴性(-)、2-3分为弱阳性(+)、4分为阳性(++)、5-6分为强阳性(+++). 4分以上为过表达. 同时设定阴性对照.
统计学处理 免疫组织化学资料采用秩变换方差分析统计和处理. RT-PCR资料采用捷达801分析软件中的凝胶分析软件对条带进行分析, 以各样本的平均IA值/各自GAPDH平均IA值来表示各目的基因的相对表达强度, 从而对各目的基因表达的强度作半定量分析. P<0.05差异有显著性. 所有数据由Stata7.0统计软件进行分析.
正常对照组所有SD大鼠肝脏组织小叶结构完整. CCl4注射第2周时, 所有样本肝小叶小片肝细胞坏死, 炎症细胞浸润, 有4个样本轻度脂肪变性. CCl4注射第4周时所有样本肝小叶大片肝细胞坏死, 肝细胞呈明显的脂肪变性, 胶原纤维由汇管区深入小叶内, 有2个样本轻度纤维间隔形成. CCl4注射第6周时肝细胞变性坏死更加严重, 所有样本均有大量纤维间隔形成.
在正常对照组和各肝纤维化模型组, 均扩增出286 bp大小的leptin片段, 内参照GAPDH片段大小为191 bp. leptin mRNA在2、4、6 wk表达逐渐增强. 经灰度扫描和与内参照比较分析发现, 随着CCl4注射时间的延长, 肝纤维化程度的加重, leptin mRNA的表达逐渐增强, 到第6周时达到高峰. TGF-β1、α-SMA mRNA在肝组织中的表达及变化趋势同leptin, 扩增的TGF-β1和α-SMA mRNA的片段大小分别为340 bp和570 bp. 上述3种mRNA的表达在各模型组与正常对照组表达差异有显著性(P<0.05, 图1).
将RT-PCR半定量结果分析后发现, 随着CCl4注射时间的延长, 肝纤维化程度的加重, 以上3种mRNA的表达逐渐增强, leptin与TGF-β1和α-SMA均有相关性显著性(r = 0.668, 0.570, P<0.05).
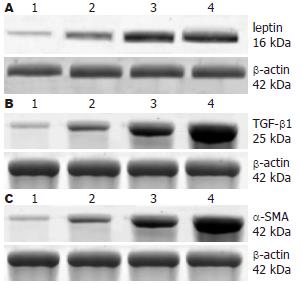
leptin蛋白的相对分子质量为16 kDa, 在正常对照组几乎无表达, 随着CCl4注射时间的延长, 表达逐渐增强, TGF-β1、α-SMA蛋白的分子量分别为25 kDa和42 kDa, 表达趋势同leptin蛋白. 经统计学分析, leptin与TGF-β1、α-SMA在各组间的表达有显著差异(P<0.05), 在6 wk组的表达显著高于正常对照组(P<0.05, 图2).
所需组织经由100 g/L甲醛固定, 脱水, 石蜡切片, 脱蜡至水, 自动免疫组织化学染色仪染色, 苏木素复染, 自来水冲洗, 蓝化, 切片经梯度酒精脱水干燥, 二甲苯透明, 中性树胶封固.
正常肝脏组织leptin有微量表达, α-SMA与TGF-β1表达弱阳性. CCl4注射2 wk后, α-SMA与TGF-β1开始表达, leptin表达增多, 主要分布在中央静脉及窦周细胞; 随着CCl4注射时间的延长, 以上三者的表达逐渐增强, 主要分布在门静脉、汇管区等纤维增生区域; 到第6周时, 上述3种蛋白质的表达最强. 三者的表达部位相同.
肝纤维化是各种原因引起的慢性肝损伤所共有的病理改变, 也是进一步向肝硬化发展的中间环节. 目前已明确HSC的激活和增殖是肝纤维化发生、发展的中心环节[5], 许多因素参与了该过程的发生.
从本研究结果看, leptin在正常对照组仅微量表达, 而随着CCl4注射时间的延长, 伴随肝纤维化程度的加重, leptin的表达逐步增强, 因此肝组织中leptin的表达水平与肝纤维化进展呈显著的正相关, 提示leptin可能参与了大鼠肝纤维化的形成过程, 其表达水平的上调与肝纤维化的发生和发展有关.
近来的研究表明, 分离培养的大鼠HSC表达leptin mRNA和蛋白质[6]; 原代培养的HSC加入leptin后, HSC的活化标志物α-SMA表达增强, 同时α1(Ⅰ)型前胶原的表达增加. 本结果表明, 正常肝组织α-SMA、Leptin微量表达, 而随着CCl4注射时间的延长, 肝纤维化程度的加重, α-SMA、leptin的表达均逐步增强, 至6 wk时达到高峰. 统计学结果表明, leptin与α-SMA在肝组织中的表达均同步增加, 两者呈显著动态相关. 提示leptin可能与HSC的活化有关.
TGF-β1是公认的HSC活化最强烈的刺激因子[7-8], HSC的活化及表型转化与TGF-β1密切相关. 用TGF-β1刺激, 能促进静态HSC向成纤维细胞转化, 并促使HSC合成大量ECM. 本实验结果也证实, 在大鼠纤维化肝组织中, TGF-β1的表达较对照组明显增加, 随着CCl4注射时间的延长, 表达逐渐增强. Ikejima et al[9]的研究发现, leptin功能性受体ob-Rb主要分布于窦内皮细胞、Kupffer细胞上, 而体外分离的HSC尚未发现有ob-Rb mRNA的表达, 因此认为leptin直接影响HSC活化的可能性较小. 在随后的研究中还发现[7-10], leptin通过激活STAT、AP-1、ET-1等信号通路, 增加窦内皮细胞的TGF-β1 mRNA的表达. 本研究相关性分析表明, 随着肝纤维化程度的加重, TGF-β1与leptin的表达呈显著正相关, 结合本实验研究结果, 我们推测, 各种肝损伤因素促发HSC活化并大量表达leptin, 其后leptin上调TGF-β1的水平, 并在其介导下进一步诱导HSC的活化和增殖, 加速肝纤维化的进程. 所以抑制leptin的表达, 有望能抑制HSC的活化, 从而减轻肝纤维化.
肝纤维化是多种慢性肝脏疾病发展至肝硬化的必经阶段, 瘦素(leptin)是由肥胖基因编码的一种由167个氨基酸组成的分泌型蛋白质, 主要由脂肪细胞分泌. 1998年, Potter发现分离培养的大鼠肝星状细胞可大量表达leptin mRNA和蛋白后, leptin与肝病的关系开始受到关注.
刘勇钢, 副主任医师, 天津市传染病医院病理科.
Potter et al发现分离培养的大鼠HSC可大量表达leptin mRNA和蛋白后, leptin与肝病的关系开始受到关注. Leclercq et al发现leptin缺乏的小鼠因CCl4所致的慢性肝脏损伤不发展为肝纤维化, 但给小鼠注射外源性leptin使其恢复到生理水平后, 小鼠发生了纤维化. Honda et al对先天leptin缺乏小鼠注射肝毒性药物硫代乙酰胺(TAA)后发现其肝脏组织中没有Ⅰ型前胶原的表达, 但经注射重组小鼠leptin后, 在肝小叶中出现了纤维染色, Ⅰ型前胶原mRNA的表达增加, 目前普遍认为, leptin在肝纤维化的发生发展中具有一定的作用..
根据本研究结果推测, 各种肝损伤因素促发HSC活化并大量表达leptin, 其后leptin上调TGF-β1的水平, 并在其介导下进一步诱导HSC的活化和增殖, 加速肝纤维化的进程.
本研究选题新颖, 设计合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Clement K, Boutin P, Froguel P. Genetics of obesity. Am J Pharmacogenomics. 2002;2:177-187. [PubMed] [DOI] |
| 2. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 3. | Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature. 1994;372:425-432. [PubMed] [DOI] |
| 4. | Potter JJ, Womack L, Mezey E, Anania FA. Transdifferentiation of rat hepatic stellate cells results in leptin expression. Biochem Biophys Res Commun. 1998;244:178-182. [PubMed] [DOI] |
| 5. | Mattioli B, Straface E, Quaranta MG, Giordani L, Viora M. Leptin promotes differentiation and survival of human dendritic cells and licenses them for Th1 priming. J Immunol. 2005;174:6820-6828. [PubMed] |
| 6. | Lin SY, Wang YY, Sheu WH. Increased serum leptin concentrations correlate with soluble tumour necrosis factor receptor levels in patients with cirrhosis. Clin Endocrinol (Oxf). 2002;57:805-811. [PubMed] [DOI] |
| 7. | Saxena NK, Ikeda K, Rockey DC, Friedman SL, Anania FA. Leptin in hepatic fibrosis: evidence for increased collagen production in stellate cells and lean littermates of ob/ob mice. Hepatology. 2002;35:762-771. [PubMed] [DOI] |
| 8. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 9. | Ikejima K, Takei Y, Honda H, Hirose M, Yoshikawa M, Zhang YJ, Lang T, Fukuda T, Yamashina S, Kitamura T. Leptin receptor-mediated signaling regulates hepatic fibrogenesis and remodeling of extracellular matrix in the rat. Gastroenterology. 2002;122:1399-1410. [PubMed] [DOI] |
| 10. | Tang M, Potter JJ, Mezey E. Leptin enhances the effect of transforming growth factor beta in increasing type I collagen formation. Biochem Biophys Res Commun. 2002;297:906-911. [PubMed] [DOI] |