修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-07-18
目的: 研究Survivin, COX-2, VEGF和肿瘤微血管密度(MVD)在大肠癌组织中的表达, 探讨其与大肠癌肿瘤血管生成的关系.
方法: 2007-09/2008-05哈尔滨医科大学附属第二临床医学院内镜下取材的大肠癌、肠息肉及肠炎标本. 所有标本均经病理检查证实诊断. 试验对象共分3组, 分别为大肠癌组织26例, 大肠息肉组织10例, 大肠黏膜慢性炎症组织7例. 采用免疫组织化学方法检测Survivin, COX-2, VEGF和CD34在大肠组织中的表达.
结果: Survivin, COX-2与VEGF蛋白在大肠癌组织中阳性表达率分别为76.9%, 80.8%和69.28%, 明显高于大肠息肉组与肠炎组的表达(P<0.01或0.05). 大肠癌组织中MVD(CD34)明显高于大肠息肉组与肠炎组(23.69±9.96 vs 13.10±7.05, 10.43±4.24, 均P<0.01). Survivin, COX-2和VEGF蛋白在大肠癌组中的表达与MVD相关(均P<0.05), Survivin和促血管形成因子COX-2, VEGF在大肠癌组织中的表达密切相关(χ2 = 11.18, 4.72, 均P<0.005).
结论: Survivin可能通过COX-2, VEGF促进大肠癌肿瘤血管的形成.
引文著录: 孔令建, 赵晶, 曲波, 樊微微, 高善玲. Survivin、COX-2及VEGF在大肠癌中的表达及与肿瘤微血管密度的关系. 世界华人消化杂志 2009; 17(20): 2048-2053
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: July 18, 2009
AIM: To simultaneously detect the expression of Survivin, cyclooxygenasa-2 (COX-2), vascular endothelial growth factor (VEGF) and CD34 in colorectal cancer and explore its correlation with tumor angiogenesis.
METHODS: All specimens (including 26 colorectal cancer specimens, 10 colorectal polyp specimens and 7 chronic colitis specimens) were collected from September 2007 to May 2008 at the Second Affiliated Hospital of Harbin Medical University. All specimens were pathologically reevaluated to confirm the initial diagnosis. The expression of Survivin, COX-2, VEGF and CD34 in these specimens was detected by immunohistochemistry.
RESULTS: The positive rates of Survivin, COX-2 and VEGF proteins in colorectal cancer tissue were 76.9%, 80.8% and 69.28% respectively, significantly higher than those in colorectal polyp and chronic colitis tissues (P < 0.01 or 0.05). The microvascular density (MVD) revealed by CD-34 immunostaining in colorectal cancer tissue was significantly higher than that in colorectal polyp and chronic colitis tissues (23.69 ± 9.96 vs 13.10 ± 7.05 and 10.43 ± 4.24, both P < 0.01). Furthermore, the expression of Survivin, COX-2 and VEGF proteins in colorectal cancer tissue is positively correlated with tumor microvessel count (all P < 0.05). In colorectal cancer tissue, the expression of Survivin was closely correlated with that of COX-2 and VEGF (χ2 = 11.18, 4.72, P < 0.05).
CONCLUSION: Survivin is probably able to promote tumor angiogenesis through regulating the expression of COX-2 and VEGF in colorectal cancer.
- Citation: Kong LJ, Zhao J, Qu B, Fan WW, Gao SL. Expression of Survivin, COX-2 and VEGF in colorectal cancer and its correlation with tumor angiogenesis. Shijie Huaren Xiaohua Zazhi 2009; 17(20): 2048-2053
- URL: https://www.wjgnet.com/1009-3079/full/v17/i20/2048.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i20.2048
肿瘤血管(tumor angiogenesis)是肿瘤生长、侵袭和转移的基础. 他的形成是一个多因素、级联、整体、动态的过程, 是多种血管调节因子共同作用的结果[1]. 大肠癌(colorectal cancer)是一种常见的恶性肿瘤, 其发病率近年来呈上升趋势, 但是其病因现在尚未完全清楚, 目前认为主要是环境因素与遗传因素综合作用的结果[2]. Survivin是近年来发现的一种凋亡抑制因子, 属于凋亡抑制蛋白(inhibitor of apoptosis proteins, IAP)家族, 广泛表达与多种恶性肿瘤组织中[3]. 当前研究显示, 不但具有抑制凋亡的作用, 而且与肿瘤血管生成以及肿瘤的耐药性有密切关系[4-5]. 本实验应用免疫组织化学方法, 测定Survivin、环氧合酶-2(cyclooxygenasa-2, COX-2)、血管内皮生长因子(vascular endothelial growth factor, VEGF)在大肠癌组织中的表达, 探讨他们在肿瘤血管形成中的作用和相互关系, 从而为大肠癌的早期诊断和治疗提供更为广阔的前景.
2007-09/2008-05哈尔滨医科大学附属第二临床医学院内镜下取材的大肠癌、肠息肉及肠炎标本. 所有标本均经病理检查证实诊断. 试验对象共分3组, 分别为大肠癌组织26例, 大肠息肉组织10例, 大肠黏膜慢性炎症组织7例. 其中大肠癌标本取材前患者未进行过放、化疗. Survivin兔抗人多克隆抗体、COX-2和VEGF兔抗人mAb、CD34鼠抗人mAb及试剂盒, 均购于北京中杉金桥生物技术有限公司.
1.2.1 指标检测: 采用免疫组织化学二步法检测Survivin, COX-2、VEGF和CD34在大肠癌组织、肠息肉组织和肠炎组织中的表达, 操作严格按照试剂盒说明书操作步骤进行.
1.2.2 结果判定: (1)Survivin: 胞质中染成棕黄色为阳性, 首先按染色强度计分: 无着色为0分, 染色弱1分, 染色清晰2分; 阳性范围≤10%为0分, 阳性范围≤25%为1分, 阳性范围≤50%为2分, 阳性范围>50%为3分. 根据2项相加数分为: 0-1为(-); 2分为(+); 3-4分为(++); 5-6分为(+++). (2)VEGF: 阳性染色模式为胞质着色, 呈浅黄色至棕黄色颗粒. 按胞质的着色强度分为: (-)细胞质不着色; (+)细胞质呈浅黄色颗粒; (++)细胞质呈棕黄色颗粒. (3)COX-2: 以胞质有棕黄色颗粒为阳性. 选择5个以上视野, 计数不少于500个细胞进行阳性计数及评分. 根据染色程度及染色细胞百分率进行评分: 基本不着色者为0分, 着色淡者为1分, 着色适中者为2分, 着色深者为3分; 着色细胞占计数细胞的百分率<5%为0分, 5%-为1分, 25%-为2分, 50%-为3分. 将每张切片的染色程度与染色细胞百分率得分相乘, 其乘积为最后得分. 0-1分为阴性(-), 2-3分为弱阳性(+), 4-6分为中等阳性(++), >6分为强阳性(+++). (4)CD34: CD34使各种大小血管均呈棕黄色染色, 主要使新生血管内皮细胞染成棕黄色. 肿瘤微血管计数(MVC)值采用Weidner计数法, 即先在低倍镜下寻找微血管密集区, 再在高倍镜(×200)下计数5个不同视野中的微血管数, 单个着色的内皮细胞或细胞丛均按独立的血管分别计数, 取以肿瘤细胞胞质内呈现棕黄色者计算其平均值.
统计学处理 统计学处理应用SPSS13.0软件完成, 计数资料用χ2检验、Fisher确切概率法及相关分析组间差异, 计量资料用t检验. P<0.05认为有统计学意义.
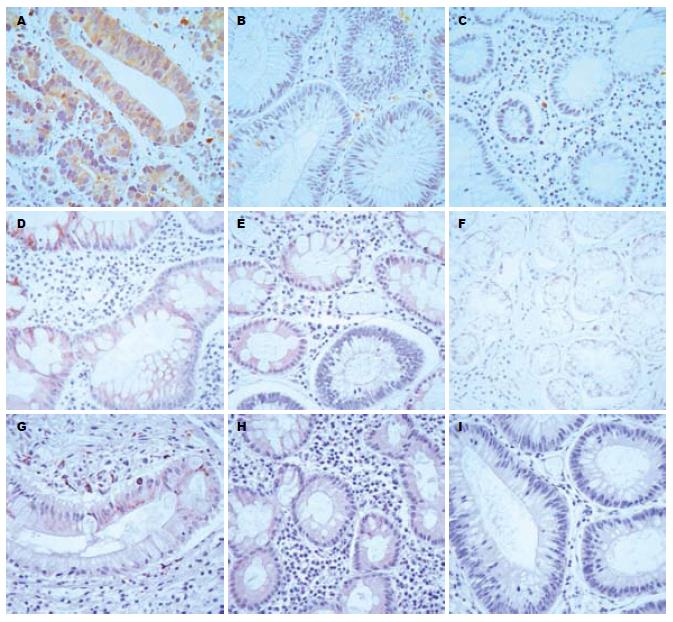
在大肠癌、大肠息肉和大肠炎3组中, Survivin的阳性表达率分别为76.9%、10.0%、14.3%; COX-2的阳性表达率分别为80.0%、20.0%、28.0%; VEGF的阳性表达率分别为69.2%、40.0%、28.6%. 大肠癌组Survivin、COX-2和VEGF阳性表达率明显高于其他2组, 差别有统计学意义(P<0.05, 图1, 表1).
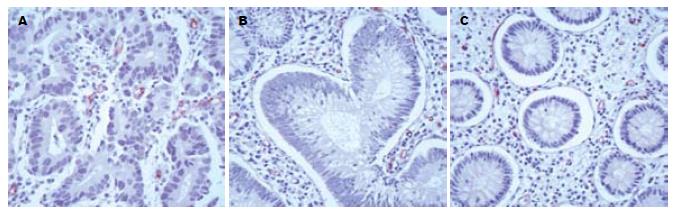
大肠癌组CD34的表达明显高于其他2组, MVD计数值(以mean±SD表示)差别有统计学意义(23.69±9.96 vs 13.10±7.05, 10.43±4.24, 均P<0.01, 图2).
在大肠癌组织中, Survivin、COX-2、VEGF阳性表达的MVD值明显高于阴性表达, 差别有统计学意义(25.80±10.03 vs 16.67±6.69; 26.74±9.63 vs 15.43±5.16; 28.22±8.42 vs 13.50±3.30, 均P<0.05). Survivin与COX-2、VEGF的表达均正相关(χ2 = 11.18, 4.72, 均P<0.005).
Survivin是近年来发现的一种新的凋亡抑制因子, 属于IAP家族的新成员具有不同于IAP家族其他成员的独特性质和结构[6]. 研究表明Survivin是迄今发现最强的凋亡抑制因子, 具有较强的抑制细胞的凋亡的功能, 促进肿瘤的发生. 本实验证实, Survivin在大肠癌中的阳性率为76.9%, 显著高于大肠息肉组和大肠炎症组, 说明Survivin的表达具有特异性, 以此可有助于鉴别肿瘤良恶性和提高恶性肿瘤的诊断率.
肿瘤新生血管的形成不但成为肿瘤生长的基础, 而且构成了肿瘤细胞侵袭转移的首要靶目标, 肿瘤细胞转移及其在转移部位的生长也依赖于肿瘤血管生成[7]. 肿瘤血管生成一方面保证了肿瘤生长所需要的营养供应, 促使肿瘤体积增加, 没有血管, 肿瘤一般只生长到1-3 mm; 另一方面, 肿瘤组织内血管密度的增加、肿瘤边缘部位的瘤细胞与血管接触增多, 也进一步促使肿瘤细胞随细胞数量的增多而脱落进入血管的机会增加. 因此, 肿瘤血管生成对肿瘤细胞的转移有直接的和间接的促进作用. 肿瘤血管表达的高低可以用肿瘤MVD加以量化, MVD不仅与肿瘤细胞的营养和供氧有关, 而且反映了肿瘤的浸润和转移能力[8].
血管形成过程的核心是内皮细胞的分裂增殖, 确切地说取决于血管内皮细胞的生存和凋亡平衡的结果. 血管生成时, 内皮细胞受生长因子刺激而分裂、移行、重塑, 形成原始血管和开放的血管网, 此过程依赖内皮细胞的生长和稳定性, 破坏内皮细胞和基质联系及干扰内皮细胞的信号传导足以引起Caspase依赖的内皮细胞的凋亡, 导致血管结构的退化. 已有研究表明Survivin在血管形成过程中也起关键作用[9-11]. 其机制可能是通过上调VEGF和COX-2的水平, 以促进肿瘤血管的生成[12-14]. VEGF是血管内皮生长因子, 又称血管通透因子, 是迄今鉴定出来的最重要的血管生成因子, 可作为肿瘤代谢及转移的标志. VEGF具有促进血管内皮细胞增殖, 增进血管能透性及改变细胞外基质的作用[15]. COX-2是花生四烯酸转化成前列腺素过程中重要的限速酶. 近年研究表明其在多种肿瘤组织中表达增强, 对肿瘤的发生、发展及转移有促进作用, 可能机制为促进细胞增殖、抑制凋亡及促进血管形成[16-18]. 当前研究发现, Survivin在肝癌[19]、胰腺癌[20]、直肠癌[21]、鼻咽癌[22]、乳腺癌[23]甲状腺癌[24]和神经母细胞瘤[25]中的表达和VEGF密切相关. 在肝癌[26]、子宫内膜癌[27]、肺癌[28]、胃癌[29]、大肠癌[30]和卵巢癌[31]中, Survivin和COX-2的表达均密切相关. 研究表明, COX-2, VEGF不仅通过旁分泌途径促进血管生成, 从而促进肿瘤的发生, 发展, 而且作为一种自分泌生长调节因子, 直接刺激肿瘤细胞的增殖或迁移[32-33]. 本研究表明Survivin, COX-2, VEGF在大肠癌中的阳性表达与MVD相关, 提示他们在大肠癌的血管生成中占有重要地位.
O'Connor et al[34]研究, Survivin在不增殖的血管中很少表达, 然而在肉芽组织中的新近形成的血管中明显表达, 说明Survivin是血管的保护性基因, 在受损伤时升高. 应用VEGF诱导静止期的内皮细胞分裂, 检测Survivin表达水平, 结果提示血管内皮细胞内Survivin含量升高了16倍, 在6-10 h达峰, 24 h开始下降. 而炎症因子TNF等未能诱导血管内皮细胞内Survivin的表达, 提示Survivin可能是血管形成中生长因子诱导的保护性基因, 维持血管内皮细胞的正常增殖. Mesri et al[15]研究认为VEGF在肿瘤血管生成过程中发挥的内皮细胞抗凋亡作用依赖于Survivin的表达上调. Tran et al[12]发现Survivin可有效地维持微小血管网的结构, 促进VEGF的内皮细胞保护功能, 抵抗化疗药物对血管内皮细胞的致凋亡作用, 从而增强肿瘤的抗药性. Mesri et al[15]还发现, Survivin的反义核苷酸酸可消除VEGF对抗肿瘤坏死因子或神经酰胺诱导的细胞死亡的抗凋亡作用, 导致内皮细胞凋亡和毛细血管迅速退化. 本实验发现, 在大肠癌组织中Survivin和COX-2, VEGF表达存在正相关, 提示促血管生成因子对大肠肿瘤的发生发展特别是在促进血管形成方面可能有Survivin的参与.
总之, 大肠癌组织中的Survivin, COX-2, VEGF的表达与肿瘤的MVD值成正相关. 提示在肿瘤血管形成方面, Survivin和COX-2, VEGF起着协同作用. 在大肠癌组织中, Survivin的表达的和COX-2, VEGF的表达呈明显相关性, 提示Survivin可能通过上调COX-2, VEGF因子来发挥其促进肿瘤血管生成的作用, 其具体作用机制有待进一步研究.
生存素(Survivin)是近年来发现的一种的凋亡抑制因子, 属于凋亡抑制蛋白(IAP)家族, 广泛表达在多种恶性肿瘤组织中. 当前研究显示, 其不但具有抑制凋亡的作用, 而且与肿瘤血管生成有密切关系.
余宏宇, 教授, 中国人民解放军第二军医大学附属长征医院病理科
Survivin是如何促进肿瘤血管生成的呢? 这是当前研究的热点问题. 本文选取了血管生成相关刺激因子COX-2、VEGF作为研究对象, 初步探讨Survivin在大肠癌肿瘤血管形成中的作用. 其具体机制有待进一步研究.
O'Connor et al研究, 发现Survivin 在不增殖的血管中很少表达, 然而在肉芽组织中的新近形成的血管中明显表达, 说明Survivin是血管的保护性基因, 在受损伤时升高. Mesri et al研究认为VEGF在肿瘤血管生成过程中发挥的内皮细胞抗凋亡作用依赖于Survivin的表达上调. Tran et al发现Survivin可有效地维持微小血管网的结构, 促进VEGF的内皮细胞保护功能.
本实验应用免疫组织化学方法, 联合研究Survivin、COX-2、VEGF在大肠癌组织中的表达, 探讨他们在肿瘤血管形成中的作用和相互关系, 初步探讨Survivin促进肿瘤血管形成作用的机制.
由于Survivin表达的组织特异性及功能的多样性, 使其成为一个非常有吸引力的癌症治疗靶点. 本文研究发现, Survivin可能通过上调COX-2, VEGF因子来发挥其促进肿瘤血管生成的作用. 通过更深入的研究, 进一步探明其促进肿瘤血管形成方面的机制, 为肿瘤的临床诊断和治疗提供一个更为广阔的应用前景.
本文设计尚可, 结果丰富, 统计学方法正确, 具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Holash J, Maisonpierre PC, Compton D, Boland P, Alexander CR, Zagzag D, Yancopoulos GD, Wiegand SJ. Vessel cooption, regression, and growth in tumors mediated by angiopoietins and VEGF. Science. 1999;284:1994-1998. [PubMed] [DOI] |
| 2. | Houlston RS. What we could do now: molecular pathology of colorectal cancer. Mol Pathol. 2001;54:206-214. [PubMed] [DOI] |
| 3. | Rohayem J, Diestelkoetter P, Weigle B, Oehmichen A, Schmitz M, Mehlhorn J, Conrad K, Rieber EP. Antibody response to the tumor-associated inhibitor of apoptosis protein survivin in cancer patients. Cancer Res. 2000;60:1815-1817. [PubMed] |
| 4. | Altieri DC. Survivin, cancer networks and pathway-directed drug discovery. Nat Rev Cancer. 2008;8:61-70. [PubMed] [DOI] |
| 5. | Kucukzeybek Y, Gul MK, Cengiz E, Erten C, Karaca B, Gorumlu G, Atmaca H, Uzunoglu S, Karabulut B, Sanli UA. Enhancement of docetaxel-induced cytotoxicity and apoptosis by all-trans retinoic acid (ATRA) through downregulation of survivin (BIRC5), MCL-1 and LTbeta-R in hormone- and drug resistant prostate cancer cell line, DU-145. J Exp Clin Cancer Res. 2008;27:37. [PubMed] [DOI] |
| 6. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7. Biochemistry. 2001;40:1117-1123. [PubMed] [DOI] |
| 7. | Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182-1186. [PubMed] |
| 8. | Weidner N, Gasparini G. Determination of epidermal growth factor receptor provides additional prognostic information to measuring tumor angiogenesis in breast carcinoma patients. Breast Cancer Res Treat. 1994;29:97-107. [PubMed] [DOI] |
| 9. | Hoel AW, Wang GJ, Simosa HF, Conte MS. Regulation of vascular smooth muscle cell growth by survivin. Vascular. 2007;15:344-349. [PubMed] |
| 10. | Delvaeye M, De Vriese A, Zwerts F, Betz I, Moons M, Autiero M, Conway EM. Role of the 2 zebrafish survivin genes in vasculo-angiogenesis, neurogenesis, cardiogenesis and hematopoiesis. BMC Dev Biol. 2009;9:25. [PubMed] [DOI] |
| 11. | Conway EM, Zwerts F, Van Eygen V, DeVriese A, Nagai N, Luo W, Collen D. Survivin-dependent angiogenesis in ischemic brain: molecular mechanisms of hypoxia-induced up-regulation. Am J Pathol. 2003;163:935-946. [PubMed] |
| 12. | Tran J, Rak J, Sheehan C, Saibil SD, LaCasse E, Korneluk RG, Kerbel RS. Marked induction of the IAP family antiapoptotic proteins survivin and XIAP by VEGF in vascular endothelial cells. Biochem Biophys Res Commun. 1999;264:781-788. [PubMed] [DOI] |
| 13. | Barnes N, Haywood P, Flint P, Knox WF, Bundred NJ. Survivin expression in in situ and invasive breast cancer relates to COX-2 expression and DCIS recurrence. Br J Cancer. 2006;94:253-258. [PubMed] [DOI] |
| 14. | Mori F, Piro FR, Della Rocca C, Mesiti G, Giampaoli S, Silvestre G, Lazzaro D. Survivin and Cyclooxygenase-2 are co-expressed in human and mouse colon carcinoma and in terminally differentiated colonocytes. Histol Histopathol. 2007;22:61-77. [PubMed] |
| 15. | Mesri M, Morales-Ruiz M, Ackermann EJ, Bennett CF, Pober JS, Sessa WC, Altieri DC. Suppression of vascular endothelial growth factor-mediated endothelial cell protection by survivin targeting. Am J Pathol. 2001;158:1757-1765. [PubMed] |
| 16. | Konturek PC, Rembiasz K, Burnat G, Konturek SJ, Tusinela M, Bielanski W, Rehfeld J, Karcz D, Hahn E. Effects of cyclooxygenase-2 inhibition on serum and tumor gastrins and expression of apoptosis-related proteins in colorectal cancer. Dig Dis Sci. 2006;51:779-787. [PubMed] [DOI] |
| 17. | Cusimano A, Foderà D, D'Alessandro N, Lampiasi N, Azzolina A, Montalto G, Cervello M. Potentiation of the antitumor effects of both selective cyclooxygenase-1 and cyclooxygenase-2 inhibitors in human hepatic cancer cells by inhibition of the MEK/ERK pathway. Cancer Biol Ther. 2007;6:1461-1468. [PubMed] |
| 18. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |
| 19. | Cui F, Chen B, Chen JZ, Huang YX, Luo RC. [Expressions of Survivin and vascular endothelial growth factor in hepatocellular carcinoma and their clinical significance]. Nanfang Yike Daxue Xuebao. 2008;28:761-763. [PubMed] |
| 20. | Lang SA, Schachtschneider P, Moser C, Mori A, Hackl C, Gaumann A, Batt D, Schlitt HJ, Geissler EK, Stoeltzing O. Dual targeting of Raf and VEGF receptor 2 reduces growth and metastasis of pancreatic cancer through direct effects on tumor cells, endothelial cells, and pericytes. Mol Cancer Ther. 2008;7:3509-3518. [PubMed] [DOI] |
| 21. | Yang D, Schneider S, Azuma M, Iqbal S, El-Khoueiry A, Groshen S, Agafitei D, Danenberg KD, Danenberg PV, Ladner RD. Gene expression levels of epidermal growth factor receptor, survivin, and vascular endothelial growth factor as molecular markers of lymph node involvement in patients with locally advanced rectal cancer. Clin Colorectal Cancer. 2006;6:305-311. [PubMed] [DOI] |
| 22. | Li YH, Hu CF, Shao Q, Huang MY, Hou JH, Xie D, Zeng YX, Shao JY. Elevated expressions of survivin and VEGF protein are strong independent predictors of survival in advanced nasopharyngeal carcinoma. J Transl Med. 2008;6:1. [PubMed] [DOI] |
| 23. | Ryan BM, Konecny GE, Kahlert S, Wang HJ, Untch M, Meng G, Pegram MD, Podratz KC, Crown J, Slamon DJ. Survivin expression in breast cancer predicts clinical outcome and is associated with HER2, VEGF, urokinase plasminogen activator and PAI-1. Ann Oncol. 2006;17:597-604. [PubMed] [DOI] |
| 24. | Zhang HY, Meng X, Du ZX, Fang CQ, Liu GL, Wang HQ, Deng WW. Significance of survivin, caspase-3, and VEGF expression in thyroid carcinoma. Clin Exp Med. 2009; Feb 10. [Epub ahead of print]. [PubMed] |
| 25. | Beierle EA, Nagaram A, Dai W, Iyengar M, Chen MK. VEGF-mediated survivin expression in neuroblastoma cells. J Surg Res. 2005;127:21-28. [PubMed] [DOI] |
| 26. | Song IH, Kim DW, Shin KC, Shin HD, Yun SY, Kim SB, Shin JE, Kim HJ, Kim EY. [Down-regulation of survivin in growth inhibition of hepatoma cells induced by a selective cyclooxygenase-2 inhibitor]. Korean J Hepatol. 2008;14:351-359. [PubMed] [DOI] |
| 27. | Erkanli S, Bolat F, Kayaselcuk F, Demirhan B, Kuscu E. COX-2 and survivin are overexpressed and positively correlated in endometrial carcinoma. Gynecol Oncol. 2007;104:320-325. [PubMed] [DOI] |
| 28. | Krysan K, Merchant FH, Zhu L, Dohadwala M, Luo J, Lin Y, Heuze-Vourc'h N, Põld M, Seligson D, Chia D. COX-2-dependent stabilization of survivin in non-small cell lung cancer. FASEB J. 2004;18:206-208. [PubMed] |
| 29. | Sun YS, Ye ZY, Zhao ZS, Shi D, Zou SC. [Expression of vascular endothelial growth factor C and survivin in gastric carcinoma and their clinical implications]. Zhonghua Weichang Waike Zazhi. 2006;9:264-267. [PubMed] |
| 30. | Calviello G, Resci F, Serini S, Piccioni E, Toesca A, Boninsegna A, Monego G, Ranelletti FO, Palozza P. Docosahexaenoic acid induces proteasome-dependent degradation of beta-catenin, down-regulation of survivin and apoptosis in human colorectal cancer cells not expressing COX-2. Carcinogenesis. 2007;28:1202-1209. [PubMed] [DOI] |
| 31. | Athanassiadou P, Grapsa D, Athanassiades P, Gonidi M, Athanassiadou AM, Tsipis A, Patsouris E. The prognostic significance of COX-2 and survivin expression in ovarian cancer. Pathol Res Pract. 2008;204:241-249. [PubMed] [DOI] |
| 32. | Kardosh A, Soriano N, Pyrko P, Liu YT, Jabbour M, Hofman FM, Schönthal AH. Reduced survivin expression and tumor cell survival during chronic hypoxia and further cytotoxic enhancement by the cyclooxygenase-2 inhibitor celecoxib. J Biomed Sci. 2007;14:647-662. [PubMed] [DOI] |
| 33. | Kunze D, Wuttig D, Kausch I, Blietz C, Blumhoff L, Burmeister Y, Kraemer K, Fuessel S, Toma M, Schwenzer B. Antisense-mediated inhibition of survivin, hTERT and VEGF in bladder cancer cells in vitro and in vivo. Int J Oncol. 2008;32:1049-1056. [PubMed] |
| 34. | O'Connor DS, Schechner JS, Adida C, Mesri M, Rothermel AL, Li F, Nath AK, Pober JS, Altieri DC. Control of apoptosis during angiogenesis by survivin expression in endothelial cells. Am J Pathol. 2000;156:393-398. [PubMed] |