修回日期: 2009-06-23
接受日期: 2009-06-29
在线出版日期: 2009-07-18
目的: 探讨血清DcR3水平对HCC的诊断价值及临床意义.
方法: 采用ELISA检测67例HCC、8例肝硬化、17例胆囊炎患者和28例正常人血清DcR3水平; 化学发光法测定血清AFP水平; 免疫组织化学二步法检测HCC癌组织中DcR3蛋白的表达.
结果: HCC组和肝硬化组血清DcR3水平均明显高于正常对照组(P<0.01), HCC血清DcR3水平与伴有肝硬化、包膜浸润和复发转移有关(P<0.05). DcR3蛋白在HCC癌组织中的表达与血清水平呈正相关(r = 0.395, P<0.01), 但DcR3血清阳性率明显高于癌组织IHC(P<0.05). AFP与DcR3联合检测对HCC的诊断灵敏度可由单项检测的82%和76%提高到93%.
结论: 血清DcR3升高在HCC的发生发展及浸润转移中起重要作用, 通过监测高危人群以及肝癌患者血清中的DcR3水平, 同时联合检测AFP, 可能对HCC的筛查、诊断和判断预后有一定意义.
引文著录: 杨梅松竹, 陈罡, 党裔武, 陈霜, 罗殿中. 肝细胞癌患者血清DcR3水平与临床意义. 世界华人消化杂志 2009; 17(20): 2042-2047
Revised: June 23, 2009
Accepted: June 29, 2009
Published online: July 18, 2009
AIM: To investigate the diagnostic value and clinical significance of elevated serum decoy receptor 3 (DcR3) in patients with hepatocellular carcinoma (HCC).
METHODS: Serum DcR3 levels were measured using enzyme-linked immunosorbent assay (ELISA) in 67 patients with HCC, 8 patients with liver cirrhosis, 17 patients with cholecystitis and 28 healthy individuals. Serum alpha fetoprotein (AFP) levels were measured by chemiluminescence. The expression of DcR3 in HCC tissue was evaluated by immunohistochemistry (IHC).
RESULTS: The levels of serum DcR3 in both HCC and liver cirrhosis patients were significantly higher than that in healthy individuals (P < 0.01). The level of serum DcR3 in HCC patients was correlated with the development of cirrhosis, capsular infiltration and metastasis (P < 0.05). There was a positive correlation between the levels of DcR3 in the serum and HCC tissue (r = 0.395, P < 0.01). The positive rate of DcR3 in the serum was significantly higher than that in HCC tissue (P < 0.05). The sensitivities of single detection of AFP or DcR3 were 82% and 3 76%, respectively. In contrast, the sensitivity of combined detection of AFP and DcR3 rose to 93%.
CONCLUSION: Elevated serum DcR3 may play an important role in the pathogenesis, development, invasion and metastasis of HCC. It may be of great significance for the screening, diagnosis and prognosis of HCC to simultaneously monitor the levels of DcR3 and AFP in the serum of high-risk populations and HCC patients.
- Citation: Yangmei SZ, Chen G, Dang YW, Chen S, Luo DZ. Clinical significance of elevated serum DcR3 in patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2009; 17(20): 2042-2047
- URL: https://www.wjgnet.com/1009-3079/full/v17/i20/2042.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i20.2042
诱捕受体3(decoy receptor 3, DcR3)是肿瘤坏死因子受体超家族(tumor necrosis factor receptor, TNFR)的新成员[1], 可以竞争性抑制配体与死亡受体的结合, 阻断配体诱导产生的细胞凋亡[2-3], 在多种恶性肿瘤, 特别是胃肠道肿瘤[4]中表达升高. 本课题组的前期研究[5-6]显示肝细胞癌(hepatocellular carcinoma, HCC)组织及细胞系存在DcR3 mRNA和蛋白的过表达, 并且可影响肿瘤细胞凋亡. 由于是一种分泌性蛋白, 可在血清中检测到, 有研究发现多种恶性肿瘤患者血清DcR3升高[7]. 为了进一步探讨DcR3对HCC的临床诊断价值, 我们采用酶联免疫吸附测定法(enzyme linked immunosorbent assay, ELISA)检测HCC、肝硬化、胆囊炎患者以及正常人血清DcR3水平, 化学发光法检测血清AFP水平, 免疫组织化学(immunohistochemistry, IHC)二步法检测HCC癌组织中DcR3蛋白表达, 探讨血清DcR3水平对HCC筛查、诊断和判断预后的意义.
血清标本取自2006-09/2007-09在广西医科大学第一附属医院行肝癌手术的HCC患者67例, 其中男58例, 女9例, 年龄29-74(平均47.7±10.2)岁. 患者术后均给予以化疗为主的综合治疗. HCC诊断按照2000年WHO分类标准分为高分化16例, 中分化37例, 低分化14例. HCC临床分期按照2003年国际抗癌联盟(UICC)和美国肿瘤联合会(AJCC)联合制定的TNM分期法分为Ⅰ期26例, Ⅱ期11例, Ⅲ期19例, Ⅳ期11例. 肝硬化患者8例, 其中男6例, 女2例, 年龄28岁-60(平均43.6±11.1)岁. 胆囊炎患者17例, 其中男9例, 女8例, 年龄25-79(平均55.3±15.4)岁. 以上患者术后均经病理证实. 正常对照组血清取自健康成年献血者28例. 标本取自患者术前和献血者外周静脉血, 静置后取上层血清, 分装保存于-80℃备用. 组织标本取自广西医科大学第一附属医院病理科上述HCC患者手术切除组织存档蜡块. Human DcR3 ELISA试剂盒购自奥地利Bender MedSystems GmbH公司. 抗DcR3兔多克隆抗体购自美国Santa Cruz公司, 工作浓度为1:150. IHC二步法试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 ELISA: 按照试剂盒说明书进行配液, 将标准蛋白和血清样本加入微孔板, 加生物素-结合物(Biotin-conjugate)孵育, 洗板, 加抗生物素蛋白链菌素-辣根过氧化物酶(streptavidin-HRP)孵育, 再洗板, 加四甲基联苯胺(TMB)避光反应, 加终止液终止反应, 酶标仪测量吸光值, 由标准曲线求出各血清样本浓度. 根据正常对照组血清DcR3水平, 按照百分位数法得到P95 = 122.22 ng/L, 依此设定阳性界值为122.22 ng/L, 浓度高于此值者, 则认为血清DcR3阳性.
1.2.2 IHC染色: 抗DcR3兔单抗已知阳性组织切片作阳性对照, PBS代替一抗作阴性对照. 4 μm厚连续石蜡切片, 脱蜡, 阻断内源性过氧化物酶, 高压修复抗原, 加一抗孵育, 加标记过氧化物酶的二抗孵育, 冲洗后加二氨基联苯胺(DAB)显色, 苏木精复染, 脱水, 封片后光镜下观察. 凡细胞质呈现明显的棕黄色者为阳性细胞. 由2名病理科医师采用双盲法阅片, 双评分半定量法评分[8]: 靶细胞阳性率<5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分; 显色程度按靶细胞显色有无及深浅记分, 细胞无染色为0分, 浅棕黄色为1分, 棕黄色为2分, 棕褐色为3分; 将两分相乘, 0分为(-), 1-4分为(+), 5-8分为(++), ≥9分为(+++).
1.2.3 化学发光法: AFP化学发光试剂盒购自广州伟之晨公司, 经美国雅培ARCHITECT i2000SR全自动化学发光免疫分析系统检测, 实验步骤严格按照试剂盒说明书进行, 将血清加入相应的样品杯中, 设定程序, 仪器自动进行定量检测. 按试剂盒提供的参考值, 确定阳性界值为10.90 mg/L.
统计学处理 应用SPSS13.0统计软件对计量资料采用秩和检验, 计数资料采用χ2检验, 相关性采用秩相关分析, 以P<0.05判为差异有显著性意义. 特异度、敏感度、阳性预测值、阴性预测值、Youden指数、粗符合率作为诊断价值的评价指标.
HCC组67例患者中51例血清DcR3阳性, 阳性率为76%. 肝硬化组8例患者中5例血清DcR3阳性, 阳性率为62%. 胆囊炎组17例患者中3例血清DcR3阳性, 阳性率为18%. 正常对照组28例患者中1例血清DcR3阳性, 阳性率为4%. 经Kruskal-Wallis秩和检验分析, HCC组血清DcR3水平明显高于正常对照组、胆囊炎组(P<0.01), 肝硬化组明显高于正常对照组(P<0.01), HCC组与肝硬化组、肝硬化组与胆囊炎组、胆囊炎组与正常对照组比较均无统计学差异(P>0.05, 表1).
HCC伴有肝硬化、无包膜或包膜浸润、复发转移患者血清DcR3阳性率分别明显高于HCC不伴肝硬化、包膜完整或无包膜浸润、无复发转移患者(P<0.05), 但与分化程度、临床分期、AFP水平、门脉癌栓、肿瘤结节及肿瘤直径无关(P>0.05, 表2).
| 临床病理 | n | 血清DcR3水平(n) | χ2值 | P值 | ||
| 参数 | 阳性 | 阴性 阳性率(%) | ||||
| 年龄(岁) | ||||||
| ≥50 | 30 | 25 | 5 | 83 | 1.555 | 0.212 |
| <50 | 37 | 26 | 11 | 70 | ||
| 性别 | ||||||
| 男 | 58 | 47 | 11 | 81 | 3.902 | 0.048 |
| 女 | 9 | 4 | 5 | 44 | ||
| 分化程度 | ||||||
| 高 | 16 | 13 | 3 | 81 | 0.405 | 0.817 |
| 中 | 37 | 28 | 9 | 76 | ||
| 低 | 14 | 10 | 4 | 71 | ||
| 临床分期 | ||||||
| ⅠⅡ | 37 | 26 | 11 | 70 | 1.555 | 0.212 |
| ⅢⅣ | 30 | 25 | 5 | 83 | ||
| 伴肝硬化 | ||||||
| 有 | 44 | 37 | 7 | 84 | 4.481 | 0.034 |
| 无 | 23 | 14 | 9 | 61 | ||
| AFP(mg/L) | ||||||
| ≥400 | 28 | 23 | 5 | 82 | 0.960 | 0.327 |
| <400 | 39 | 28 | 11 | 72 | ||
| 门脉癌栓 | ||||||
| 有 | 11 | 9 | 2 | 82 | 0.010 | 0.922 |
| 无 | 56 | 42 | 14 | 75 | ||
| 包膜浸润 | ||||||
| 无包膜或 | 37 | 32 | 5 | 86 | 4.886 | 0.027 |
| 包膜浸润 | ||||||
| 包膜完整 | 30 | 19 | 11 | 63 | ||
| 或无浸润 | ||||||
| 复发转移 | ||||||
| 有 | 40 | 34 | 6 | 85 | 4.306 | 0.038 |
| 无 | 27 | 17 | 10 | 63 | ||
| 肿瘤结节 | ||||||
| 多个 | 25 | 20 | 5 | 80 | 0.330 | 0.565 |
| 单个 | 42 | 31 | 11 | 74 | ||
| 肿瘤直径(cm) | ||||||
| ≥5 | 43 | 35 | 8 | 81 | 1.838 | 0.175 |
| <5 | 24 | 16 | 8 | 67 | ||
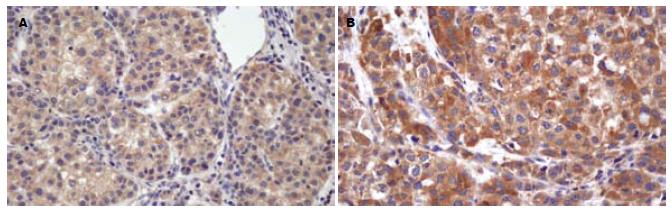
检测上述ELISA检测的67例HCC患者中的64例患者癌组织DcR3蛋白的表达(图1), 其中15例血清DcR3阴性(0-122.22 ng/L)患者中, 4例IHC呈低度阳性; 16例血清DcR3低水平(122.23-149.99 ng/L)患者中, 10例IHC阳性; 20例血清DcR3中等水平(150.00-299.99 ng/L)患者中, 14例IHC阳性; 13例血清DcR3高水平(≥300.00 ng/L)患者中, 11例IHC阳性. 经Kendall's tau_b秩相关分析, 癌组织中DcR3的表达与血清DcR3水平呈正相关(r = 0.395, P<0.01). IHC与ELISA检测阳性率分别为61%(39/64)和77%(49/64), 经配对设计χ2检验分析, DcR3血清ELISA检测阳性率明显高于癌组织IHC检测(P<0.05, 表3).
| 血清水平(ng/L) | n | 组织表达 | |||
| - | + | ++ | +++ | ||
| 阴性(0-122.22) | 15 | 11 | 4 | 0 | 0 |
| 低水平(122.23-149.99) | 16 | 6 | 5 | 4 | 1 |
| 中等水平(150.00-299.99) | 20 | 6 | 8 | 4 | 2 |
| 高水平(≥300.00) | 13 | 2 | 4 | 2 | 5 |
AFP与DcR3单项检测对HCC的诊断灵敏性分别为82%和76%, 联合检测可将灵敏度提高到93%, 且阴性预测值、Youden指数、粗符合率均有明显上升, 仅特异度与阳性预测值略有下降(表4).
| 标志物 | 灵敏度 | 特异度 | 阳性预测值 | 阴性预测值 | Youden指数 | 粗符合率 |
| AFP | 82(55/67) | 89(47/53) | 90(55/61) | 80(47/59) | 71 | 85.0 |
| DcR3 | 76(51/67) | 85(45/53) | 86(51/59) | 74(45/61) | 61 | 80.0 |
| AFP+DcR3 | 93(62/67) | 81(43/53) | 86(62/72) | 90(43/48) | 74 | 87.5 |
DcR3又被称作TR6或者M68, 是1998年Pitti et al[1]发现的一种无明显跨膜序列的分泌型蛋白, 属TNFR超家族成员, 可以和FasL[1-2,9], LIGHT[3], TLIA[10]等配体特异性结合, 竞争性地抑制配体与死亡受体(death receptor)的结合, 从而阻断该配体诱导产生的凋亡[2-3,11]. 并且通过降低T细胞与抗原呈递细胞之间的相互作用, 抑制T细胞趋化[12], 调节树突状细胞的分化和成熟[13], 诱发树突状细胞凋亡[14], 调节巨噬细胞的分化和激活, 抑制肿瘤相关巨噬细胞MHCⅡ的表达[15], 增加单核细胞的黏附能力[16], 调节免疫细胞之间的相互作用[17-18]和诱导免疫耐受[19]等机制, 在肿瘤的发生、发展以及免疫逃逸中发挥重要作用. 已有研究发现在神经系统[20-21]、泌尿系统[22]、消化系统[23-31]等多个系统的恶性肿瘤中存在DcR3的高表达. Shen et al[29-30]研究发现HCC组织中DcR3基因扩增与mRNA表达相一致, 存在DcR3 mRNA和蛋白的高表达. 本课题组的前期研究结果[5-6]显示HCC组织和HCC细胞系中均存在DcR3 mRNA和蛋白的高表达, 而癌旁组织无或者低表达, DcR3的高表达可抑制肿瘤细胞凋亡.
DcR3是一种分泌型蛋白, 可在血清中检测到. 有研究发现胃癌、肝癌、胆囊癌、结肠癌、甲状腺腺癌、胰腺癌、骨肉瘤、乳腺癌[7]、肾癌[22]、卵巢癌[32]等恶性肿瘤, 以及系统性红斑狼疮[33-34]、类风湿关节炎[35]等自身免疫性疾病患者血清DcR3水平有不同程度的升高, 而其中以肝癌、胃癌和胆囊癌等胃肠道肿瘤升高最显著. Wu et al[7]对多种肿瘤患者血清DcR3水平进行了研究, 包括35例HCC患者, 其中26例血清DcR3阳性, 阳性率74.3%, 血清水平明显高于正常人. 本研究检测了67例HCC患者, 其中51例阳性, 阳性率为76%, HCC血清DcR3水平与正常人和感染性疾病患者比较均显著升高, 与Wu et al[7]的研究结果相似, 证实了HCC患者血清中DcR3的水平明显高于正常人, 有希望成为新的HCC筛选标志物.
我们进一步将HCC患者分为HCC伴有肝硬化和HCC不伴肝硬化两组, HCC伴有肝硬化组血清DcR3阳性率明显高于HCC不伴肝硬化组(84% vs 61%). 另外, 肝硬化患者血清DcR3阳性率为62%(5/8), 血清水平明显高于正常对照组. 以上结果均提示DcR3的表达与肝硬化有密切关系. 在Wu et al[7]的研究中, 5例肝硬化患者血清DcR3平均水平为45 ng/L, 较正常显著升高, 又由于HCC患者中伴有肝硬化的达74%, Wu et al[7]推测血清中的一部分DcR3可能来源于肝硬化组织. 本课题组前期研究[8]也发现在部分肝硬化组织中存在DcR3 mRNA和蛋白的表达, 但是表达阳性率和表达强度明显低于HCC. 因此, 肝硬化中DcR3表达增高的发生机制, DcR3与肝硬化和HCC的发生发展是否有关等问题还有待于进一步研究.
在DcR3表达与HCC临床病理参数关系的研究中, Shen et al[29-30]和Chen et al[5-6]发现HCC组织中DcR3 mRNA和蛋白的表达与肿瘤大小、临床分期、浸润转移、包膜浸润等有关. 而HCC患者血清DcR3水平与临床病理参数之间的关系尚未见文献报道. 本研究发现, HCC患者中包膜浸润者血清DcR3阳性率明显高于无包膜浸润者、复发转移者明显高于无复发转移者. 提示DcR3与HCC的恶性进展和浸润转移密切相关, 推测血清DcR3高水平患者易发生肿瘤的浸润转移, 预后差, DcR3可能成为评价HCC预后的重要血清学指标.
为了探讨HCC患者血清中DcR3的水平与癌组织中DcR3蛋白表达的关系, 我们用IHC方法检测了67例HCC患者中64例手术切除癌组织DcR3蛋白的表达情况, 比较同一患者血清和组织DcR3蛋白表达的差异. 国内外尚未见这方面的报道. 本研究发现, DcR3蛋白在HCC癌组织中呈高表达, 且随着DcR3血清水平的升高, 组织中的表达相应增强, 即血清水平越高的患者, 其组织中DcR3蛋白表达越强. 相关分析表明组织中DcR3表达与血清水平呈正相关, 证明DcR3在组织中的表达与血清水平一致. 但ELISA检测阳性率明显高于IHC(77% vs 61%). 我们推测可能是由于ELISA检测较IHC检测更灵敏所致, 由此也提示DcR3血清学ELISA检测更灵敏、更简便、更适合于临床应用.
另一方面, AFP从20世纪70年代应用于临床检测, 到目前仍是最常使用的HCC诊断标志物, 广泛用于HCC的普查、诊断、判断治疗效果、预测复发等. 但是由于其特异度不高, 约为75%-80%, 因此出现了很多肿瘤标志物与AFP联合检测提高对HCC诊断效率的研究[36]. 为了提高HCC诊断效率, 弥补DcR3在多种疾病中均有表达, 特异性不高的缺点, 探讨了AFP与DcR3联合检测对HCC的诊断价值. 发现血清AFP、DcR3单项检测的灵敏度分别为82%、76%, 与叶茂 et al[36]和Wu et al[7]研究结果相符. 但由于二者单项检测的灵敏度不高, 部分患者可因假阴性而漏诊. 而联合测定AFP与DcR3可将灵敏度提高到93%, 明显提高了诊断敏感性, 能有效防止漏诊. 也说明DcR3对血清AFP水平在正常范围的HCC患者的筛查和诊断有一定的价值. 虽然联合检测的特异度和阳性预测值与单项检测相比略有降低, 但阴性预测值、Youden指数和粗符合率均有所上升, 说明了联合检测的诊断价值高于单项检测, AFP与DcR3联合检测能有效提高HCC的诊断率, 为尽早发现、尽早治疗HCC提供了有利条件, 以进一步改善患者的生存率和生存质量.
总之, HCC患者血清DcR3水平升高, 且与肿瘤的生长、浸润、复发、转移等代表肿瘤恶性生物学行为的因素有关, 因此通过监测高危人群以及肝癌患者血清中的DcR3水平, 同时联合检测AFP, 对HCC的筛查、诊断和判断预后有重要意义.
肝癌是我国常见的恶性肿瘤之一, 特异性的诊断指标一直是肝癌早期发现的研究重点. DcR3在多种恶性肿瘤中呈高表达, 并可分泌至血清中, 有望成为新的恶性肿瘤的诊断指标应用于临床.
田字彬, 教授, 青岛大学医学院附属医院消化内科
肿瘤标志物的研究目前备受关注, 也是肝癌的研究重点. 肿瘤标志物的发现, 对肿瘤的早期发现和早期诊断以及改善患者的生活质量将起到积极的推动作用.
以往研究发现DcR3在多种恶性肿瘤患者血清中升高, 可作为恶性肿瘤诊断、治疗和判断预后的一个新参数.
本研究采用ELISA和免疫组织化学方法研究肝癌患者血清和组织中DcR3的表达, 并进行相关性分析和检测阳性率的比较, 同时分析血清DcR3水平与肝癌各临床病理参数的关系, 初步探讨血清DcR3对肝癌的筛查、诊断和判断预后的意义.
HCC患者血清DcR3水平较正常人明显升高, 且与肿瘤的生长、浸润、复发、转移等代表肿瘤恶性生物学行为的因素有关, 因此通过监测高危人群以及肝癌患者血清中的DcR3水平, 可能有助于肝癌早期诊断和判断预后.
血清DcR3升高在HCC的发生发展及浸润转移中可能起重要作用, 通过监测高危人群以及肝癌患者血清中的DcR3、AFP水平, 可能对HCC的筛查、诊断和判断预后有较大意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Pitti RM, Marsters SA, Lawrence DA, Roy M, Kischkel FC, Dowd P, Huang A, Donahue CJ, Sherwood SW, Baldwin DT. Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer. Nature. 1998;396:699-703. [PubMed] [DOI] |
| 2. | Li W, Zhang C, Chen C, Zhuang G. Correlation between expression of DcR3 on tumor cells and sensitivity to FasL. Cell Mol Immunol. 2007;4:455-460. [PubMed] |
| 3. | Gill RM, Hunt JS. Soluble receptor (DcR3) and cellular inhibitor of apoptosis-2 (cIAP-2) protect human cytotrophoblast cells against LIGHT-mediated apoptosis. Am J Pathol. 2004;165:309-317. [PubMed] |
| 4. | Bai C, Connolly B, Metzker ML, Hilliard CA, Liu X, Sandig V, Soderman A, Galloway SM, Liu Q, Austin CP. Overexpression of M68/DcR3 in human gastrointestinal tract tumors independent of gene amplification and its location in a four-gene cluster. Proc Natl Acad Sci U S A. 2000;97:1230-1235. [PubMed] [DOI] |
| 5. | Chen G, Luo DZ, Wang Y, Liao ZL, Zhang MY. [Relationship between expression of decoy receptor 3 and apoptosis in hepatocellular carcinoma]. Zhonghua Binglixue Zazhi. 2007;36:113-117. [PubMed] |
| 6. | Chen G, Luo DZ. [The relationship between the expression of TR6 mRNA and protein in the apoptosis of hepatocellular carcinoma cells]. Zhonghua Ganzangbing Zazhi. 2007;15:302-303. [PubMed] |
| 7. | Wu Y, Han B, Sheng H, Lin M, Moore PA, Zhang J, Wu J. Clinical significance of detecting elevated serum DcR3/TR6/M68 in malignant tumor patients. Int J Cancer. 2003;105:724-732. [PubMed] [DOI] |
| 9. | Elnemr A, Ohta T, Yachie A, Kayahara M, Kitagawa H, Fujimura T, Ninomiya I, Fushida S, Nishimura GI, Shimizu K. Human pancreatic cancer cells disable function of Fas receptors at several levels in Fas signal transduction pathway. Int J Oncol. 2001;18:311-316. [PubMed] |
| 10. | Yang CR, Hsieh SL, Teng CM, Ho FM, Su WL, Lin WW. Soluble decoy receptor 3 induces angiogenesis by neutralization of TL1A, a cytokine belonging to tumor necrosis factor superfamily and exhibiting angiostatic action. Cancer Res. 2004;64:1122-1129. [PubMed] [DOI] |
| 11. | Ashkenazi A. Targeting death and decoy receptors of the tumour-necrosis factor superfamily. Nat Rev Cancer. 2002;2:420-430. [PubMed] [DOI] |
| 12. | Shi G, Wu Y, Zhang J, Wu J. Death decoy receptor TR6/DcR3 inhibits T cell chemotaxis in vitro and in vivo. J Immunol. 2003;171:3407-3014. [PubMed] |
| 13. | Hsu TL, Chang YC, Chen SJ, Liu YJ, Chiu AW, Chio CC, Chen L, Hsieh SL. Modulation of dendritic cell differentiation and maturation by decoy receptor 3. J Immunol. 2002;168:4846-4853. [PubMed] |
| 14. | You RI, Chang YC, Chen PM, Wang WS, Hsu TL, Yang CY, Lee CT, Hsieh SL. Apoptosis of dendritic cells induced by decoy receptor 3 (DcR3). Blood. 2008;111:1480-1488. [PubMed] [DOI] |
| 15. | Chang YC, Chen TC, Lee CT, Yang CY, Wang HW, Wang CC, Hsieh SL. Epigenetic control of MHC class II expression in tumor-associated macrophages by decoy receptor 3. Blood. 2008;111:5054-5063. [PubMed] [DOI] |
| 16. | Yang CR, Hsieh SL, Ho FM, Lin WW. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. J Immunol. 2005;174:1647-1656. [PubMed] |
| 17. | Wan X, Shi G, Semenuk M, Zhang J, Wu J. DcR3/TR6 modulates immune cell interactions. J Cell Biochem. 2003;89:603-612. [PubMed] [DOI] |
| 18. | Mueller AM, Pedre X, Killian S, David M, Steinbrecher A. The Decoy Receptor 3 (DcR3, TNFRSF6B) suppresses Th17 immune responses and is abundant in human cerebrospinal fluid. J Neuroimmunol. 2009;209:57-64. [PubMed] [DOI] |
| 19. | Chen C, Zhang C, Zhuang G, Luo H, Su J, Yin P, Wang J. Decoy receptor 3 overexpression and immunologic tolerance in hepatocellular carcinoma (HCC) development. Cancer Invest. 2008;26:965-974. [PubMed] [DOI] |
| 20. | Arakawa Y, Tachibana O, Hasegawa M, Miyamori T, Yamashita J, Hayashi Y. Frequent gene amplification and overexpression of decoy receptor 3 in glioblastoma. Acta Neuropathol. 2005;109:294-298. [PubMed] [DOI] |
| 21. | Chen L, Tian X, Li W, Agarwal A, Zhuang G. Expressions of Fas/DcR3 and RGD-FasL mediated apoptosis in pituitary adenomas. Neurol India. 2009;57:28-30. [PubMed] [DOI] |
| 22. | Macher-Goeppinger S, Aulmann S, Wagener N, Funke B, Tagscherer KE, Haferkamp A, Hohenfellner M, Kim S, Autschbach F, Schirmacher P. Decoy receptor 3 is a prognostic factor in renal cell cancer. Neoplasia. 2008;10:1049-1056. [PubMed] |
| 23. | Li H, Zhang L, Lou H, Ding I, Kim S, Wang L, Huang J, Di Sant'Agnese PA, Lei JY. Overexpression of decoy receptor 3 in precancerous lesions and adenocarcinoma of the esophagus. Am J Clin Pathol. 2005;124:282-287. [PubMed] [DOI] |
| 24. | Tsuji S, Hosotani R, Yonehara S, Masui T, Tulachan SS, Nakajima S, Kobayashi H, Koizumi M, Toyoda E, Ito D. Endogenous decoy receptor 3 blocks the growth inhibition signals mediated by Fas ligand in human pancreatic adenocarcinoma. Int J Cancer. 2003;106:17-25. [PubMed] [DOI] |
| 25. | Chen PH, Yang CR. Decoy receptor 3 expression in AsPC-1 human pancreatic adenocarcinoma cells via the phosphatidylinositol 3-kinase-, Akt-, and NF-kappa B-dependent pathway. J Immunol. 2008;181:8441-8449. [PubMed] |
| 26. | Takahama Y, Yamada Y, Emoto K, Fujimoto H, Takayama T, Ueno M, Uchida H, Hirao S, Mizuno T, Nakajima Y. The prognostic significance of overexpression of the decoy receptor for Fas ligand (DcR3) in patients with gastric carcinomas. Gastric Cancer. 2002;5:61-68. [PubMed] [DOI] |
| 28. | Chen G, Luo D. Over-expression of decoy receptor 3 in gastric precancerous lesions and carcinoma. Ups J Med Sci. 2008;113:297-304. [PubMed] |
| 29. | Shen HW, Wu YL, Peng SY. [Overexpression and genomic amplification of decoy receptor 3 in hepatocellular carcinoma and significance thereof]. Zhonghua Yixue Zazhi. 2003;83:744-747. [PubMed] |
| 30. | Shen HW, Gao SL, Wu YL, Peng SY. Overexpression of decoy receptor 3 in hepatocellular carcinoma and its association with resistance to Fas ligand-mediated apoptosis. World J Gastroenterol. 2005;11:5926-5930. [PubMed] |
| 31. | Mild G, Bachmann F, Boulay JL, Glatz K, Laffer U, Lowy A, Metzger U, Reuter J, Terracciano L, Herrmann R. DCR3 locus is a predictive marker for 5-fluorouracil-based adjuvant chemotherapy in colorectal cancer. Int J Cancer. 2002;102:254-257. [PubMed] [DOI] |
| 32. | Simon I, Liu Y, Krall KL, Urban N, Wolfert RL, Kim NW, McIntosh MW. Evaluation of the novel serum markers B7-H4, Spondin 2, and DcR3 for diagnosis and early detection of ovarian cancer. Gynecol Oncol. 2007;106:112-118. [PubMed] [DOI] |
| 33. | Lee CS, Hu CY, Tsai HF, Wu CS, Hsieh SL, Liu LC, Hsu PN. Elevated serum decoy receptor 3 with enhanced T cell activation in systemic lupus erythematosus. Clin Exp Immunol. 2008;151:383-390. [PubMed] |
| 34. | Han B, Bojalil R, Amezcua-Guerra LM, Springall R, Valderrama-Carvajal H, Wu J, Luo H. DcR3 as a diagnostic parameter and risk factor for systemic lupus erythematosus. Int Immunol. 2008;20:1067-1075. [PubMed] [DOI] |
| 35. | Bamias G, Siakavellas SI, Stamatelopoulos KS, Chryssochoou E, Papamichael C, Sfikakis PP. Circulating levels of TNF-like cytokine 1A (TL1A) and its decoy receptor 3 (DcR3) in rheumatoid arthritis. Clin Immunol. 2008;129:249-255. [PubMed] [DOI] |