修回日期: 2009-06-14
接受日期: 2009-06-15
在线出版日期: 2009-07-18
目的: 探讨幽门螺杆菌(H. pylori)感染与巨噬细胞表面的胞吞受体DEC205的关系.
方法: 用蛋白纯化法提取得到H. pylori-HSP60. 分别用H. pylori、H. pylori-HSP60和E.coli-LPS刺激单核细胞(NOMO1)后提取蛋白进行免疫印迹法分析. 利用PMA将NOMO1细胞分化成巨噬细胞, 再用H. pylori或H. pylori-HSP60刺激细胞后提取RNA进行实时PCR分析; 细胞表面DEC205抗原的表达通过流式细胞术进行分析.
结果: H. pylori的刺激能明显引起DEC205蛋白的表达, 而H. pylori-HSP60或E.coli-LPS的刺激只引起了少许DEC205蛋白的表达; 经PMA分化后的NOMO1细胞表面DEC205 mRNA的表达增强, 分化后的NOMO1细胞被H. pylori或H. pylori-HSP60刺激后也增强了DEC205 mRNA的表达; 流式细胞术结果表明NOMO1细胞在H. pylori刺激后, 细胞表面DEC205抗原的表达明显增加(88.10% vs 7.84%, P<0.05), 而且当NOMO1细胞被PMA分化后, 经H. pylori或H. pylori-HSP60刺激后DEC205表达也有所增高(74.73%, 51.31% vs 43.77%, 均P<0.05).
结论: H. pylori感染与巨噬细胞表面的胞吞受体DEC205有着密切的联系.
引文著录: 赵莹, 魏晓晴, 崔颖, 高颖. DEC205在幽门螺杆菌感染的巨噬细胞中的表达. 世界华人消化杂志 2009; 17(20): 2037-2041
Revised: June 14, 2009
Accepted: June 15, 2009
Published online: July 18, 2009
AIM: To investigate the relationship between Helicobacter pylori (H. pylori) infection and the expression of DEC205.
METHODS: H. pylori-HSP60 was prepared by a recombinant DNA procedure. After monocytic cells (NOMO1 line) were infected with H. pylori or stimulated with H. pylori-HSP60 or E.coli-LPS, whole cell protein was extracted and analyzed by Western blot. NOMO1 cells were then treated with PMA to induce their differentiation into macrophages, and infected with H. pylori or stimulated with H. pylori-HSP60. The expression of DEC205 mRNA was detected by real-time PCR. The expression of DEC205 protein on the surface of NOMO1 cells was analyzed by flow cytometry.
RESULTS: The expression of DEC205 protein was markedly increased following H. pylori infection, whereas the protein expression was only slightly upregulated after stimulation with H. pylori-HSP60 or E.coli-LPS. After treatment of NOMO1 cells with PMA, the expression of DEC205 mRNA was enhanced. Subsequent infection with H. pylori or stimulation with H. pylori-HSP60 could induce the expression of DEC205 mRNA in differentiated NOMO1 cells. Flow cytometry analysis indicated that the expression of DEC205 protein was upregulated obviously on the surface of H. pylori-infected NOMO1 cells (88.10% vs 7.84%, P < 0.05). Moreover, H. pylori infection and H. pylori-HSP60 stimulation could also increase DEC205 expression in differentiated NOMO1 cells (74.73% and 51.31% vs 43.77%, both P < 0.05).
CONCLUSION: H. pylori infection may be closely related with the expression of DEC205 on the surface of macrophages in gastric mucosa.
- Citation: Zhao Y, Wei XQ, Cui Y, Gao Y. Expression of DEC205 in Helicobacter pylori-infected macrophages. Shijie Huaren Xiaohua Zazhi 2009; 17(20): 2037-2041
- URL: https://www.wjgnet.com/1009-3079/full/v17/i20/2037.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i20.2037
通过巨噬细胞引起的细菌局部获得性免疫机制至今还不是十分清楚. 在H. pylori感染中, 巨噬细胞分泌的细胞因子产物明显升高[1]. H. pylori感染的胃组织中会通过淋巴细胞和巨噬细胞的大量浸润来进行免疫调节[2]. 然而, 胃黏膜中巨噬细胞和H. pylori的关系并不是十分清楚. DEC205属于甘露糖家族中C型凝集素超家族中的一个亚族, 与B细胞一样存在于巨噬、胸腺、肺及肠上皮细胞表面[3]. DEC205作为树枝状细胞表面的膜糖蛋白, 具有抗原提呈作用, 能够诱导抗原特异性T细胞免疫[4]. 人类的DEC205是一个200 kDa的糖蛋白, 表达于胸腺、树突状细胞及少量T细胞中[5]. 然而, DEC205在胃黏膜的分布仍然不清楚. Yamasaki et al[6]曾报道H. pylori-HSP60刺激外周血单核细胞后, 胃炎患者的DEC205的mRNA的表达明显增高. HSP60表达于H. pylori表面, 与此菌表面产生的尿素酶等病原因子突破了胃壁的天然保护屏障, 构成了H. pylori感染的病理变化[7]. 目前大量报道也指出由于H. pylori-HSP60的功能和位置, 使得这个蛋白对于H. pylori感染的局部和系统免疫产生影响[8]. 本研究调查了巨噬细胞中H. pylori感染与DEC205表达的关系, 即H. pylori或H. pylori-HSP60刺激经PMA分化的单核细胞系NOMO1细胞后DEC205的表达状况.
H. pylori(ATCC 43504)购于美国标准菌库. 细菌培养使用含有7%无菌、不含纤维蛋白的马血脑心浸液琼脂培养基, 在含有100 mL/L CO2, 50 mL/L O2, 和850 mL/L N2的微需氧培养箱中培养. 经过3 d的培养, H. pylori以A600 = 1.0(相当于1×108个细菌/mL)数量移至不含胎牛血清的RPMI 1640(Gibco公司)培养液中. 单核细胞系NOMO1购买于日本科研生物制品公司. 细胞培养在含有100 mL/L胎牛血清, 50 kU/L青霉素, 50 U/L链霉素和2.5 mg/L两性霉素B的RPMI 1640培养液中, 在37℃、50 mL/L CO2和99%湿度的温箱中. 在每次实验之前, 细胞被不含任何抗体的RPMI 1640培养液清洗3次, 并将细胞数量维持在2×106 cells/mL. 为了使细胞分化为巨噬细胞, 20 nmol/mL PMA被加入到培养液中. 大肠杆菌的脂多糖购买于Sigma公司. DEC205和Actin抗体购于BD公司. CD14抗体购于R&D公司. IgG-PE购于Santa Cruz公司. IgG-FITC购于MP Biomedicals公司. ECL发光剂购于Amersham Pharmacia公司. RNA抽取试剂盒购于Qiagen公司. 逆转录分析使用SuperScriptTM III First-Strand Synthesis System购于invitrogen. 流式细胞仪(BD公司, 美国), 紫外-可见分光光度计(Beckman公司, 美国), 实时PCR执行于LightCycler Quick System 350S (Roche公司, 瑞士), LightCycle software Ver.3.5软件(Roche公司, 瑞士), LAS-1000 mini图像分析系统(Fuji公司, 日本), Image Gauge Ver 4.0软件(Fuji公司, 日本).
1.2.1 蛋白纯化: 通过PCR技术构建H. pylori-HSP60基因重组表达载体pEGX-5X3, 经大肠杆菌DH5α表达得到可溶性GST融合蛋白, 采用谷胱甘肽琼脂糖凝胶4B进行分离与纯化, 经氨基酸序列测序确定其蛋白的一源性.
1.2.2 免疫印迹法: 将用H. pylori、H. pylori-HSP60或LPS处理的NOMO1细胞收集后离心, 在冰上孵育20 min, 用超音波破碎细胞, 离心后上清液按1:1与2×SDS样品缓冲液混合, 煮沸5 min. 溶胞产物用12% SDS-PAGE进行电泳, 转染至PVDF膜. 膜用TBS清洗后, 封闭于含有50 g/L脱脂奶的TBS/Tween20室温下孵育1 h, 经TBST清洗3次, 每次5 min, 用DEC205或actin抗体室温下孵育1 h, 此时抗体稀释于含有50 g/L脱脂奶的TBST溶液中, 再分别用IgG HRP标记的二抗室温下孵育1 h, 然后以ECL化学发光剂显色曝光于LAS-1000 mini图像分析系统. DEC205的条带灰度值分析于Image Gauge Ver 4.0软件, 并以肌动蛋白作为标准化计算.
1.2.3 实时PCR分析: 先将NOMO1细胞用20 μg/L的PMA预处理5 min, 然后用H. pylori或H. pylori-HSP60刺激. 全量的RNA从3×106 NOMO1细胞中利用RNeasy Mini kit进行提取. RNA的浓度, 通过A260值测定, 根据A260/A280比值, 推测RNA纯度. 提取的RNA保存于-80℃直至使用. 在确认RNA提取过程中没有DNA的污染后, 利用逆转录酶, 进行逆转录分析. 实时PCR执行于LightCycler Quick System 350S. 2 μL cDNA加入到20 μL反应体系中, 其中包括10 μL SYBR® Premix Ex TaqTM聚合酶混合物, 2 μL DEC205引物混合物(5'-CAAATTCCAAAAGGCCGTACTC-3'; 5'-CACCACTTCTGTCCATCACCA-3')或G3PDH引物混合物(5'-CAACGGATTTGGTCGTATTGG-3'; 5'-CTGGAAGATGGTGATGGGATTT-3'), 7.2 μL超纯水以及0.8 μL DNATaq聚合酶. 反应条件为先用95℃ 30 s, 1个循环; 95℃ 5 s, 55.5℃ 10 s, 72℃ 15 s, 35个循环; 65℃ 15 s, 40℃ 30 s, 1个循环. 数据用LightCycle software Ver 3.5分析, 计算IL-8/G3PDH比值.
1.2.4 流式细胞术分析: 用H. pylori或H. pylori-HSP60处理的NOMO1细胞表面DEC205和CD14的表达通过流式细胞术进行分析. 105细胞首先在室温下用IgG孵育15 min阻滞Fc受体. 细胞再用DEC205或CD14抗体孵育1 h, 然后用IgG-PE或IgG-FITC二抗孵育30 min. 所有的染色过程4℃及含有0.02%叠氮钠和0.2% BSA的PBS溶液中进行. 然后将样品固定在2%多聚甲醛/0.1 mol/L磷酸盐缓冲液(pH7.3)中20 min, 然后使用流式细胞仪进行分析.
统计学处理 实验结果以mean±SE表示. 数据通过Student's t检验进行统计学处理, P<0.05为有显著性差异.
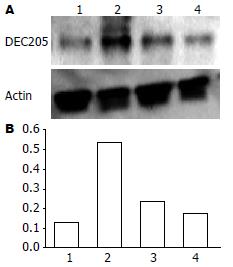
2×106/mL NOMO1细胞经5×107/mL H. pylori、100 mg/L H. pylori-HSP60或10 mg/L E.coli-LPS刺激后过夜培养,细胞溶解物分别用DEC205或actin抗体进行免疫印迹分析(图1A), H. pylori的刺激明显引起了DEC205蛋白的表达, 而H. pylori-HSP60或E.coli-LPS的刺激只引起了少许DEC205蛋白的表达, DEC205与内参actin相对灰度比值使用Image Gauge软件进行分析(图1B).
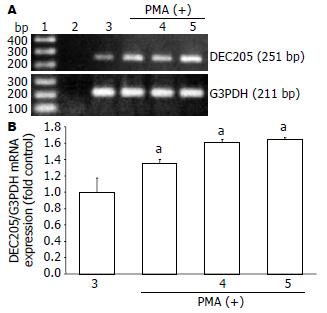
3×106/mL NOMO1细胞首先用20 μg/L PMA进行6 h的预处理后, 分别用5×107/mL H. pylori或100 mg/L H. pylori-HSP60刺激NOMO1细胞后进行过夜培养, 观察了DEC205 mRNA的表达状况. DEC205 mRNA的表达通过RT-PCR进行分析(图2A). 可以看到经PMA分化后的NOMO1细胞表面DEC205 mRNA的表达增强, 分化后的NOMO1细胞被H. pylori或H. pylori-HSP60刺激后似乎也增强了DEC205 mRNA的表达. 同时, DEC205 mRNA的表达也通过实时PCR进行定量分析(图2B). 结果显示PMA的分化增强了DEC205 mRNA的表达, 而细菌的额外刺激又增加了这个表达.
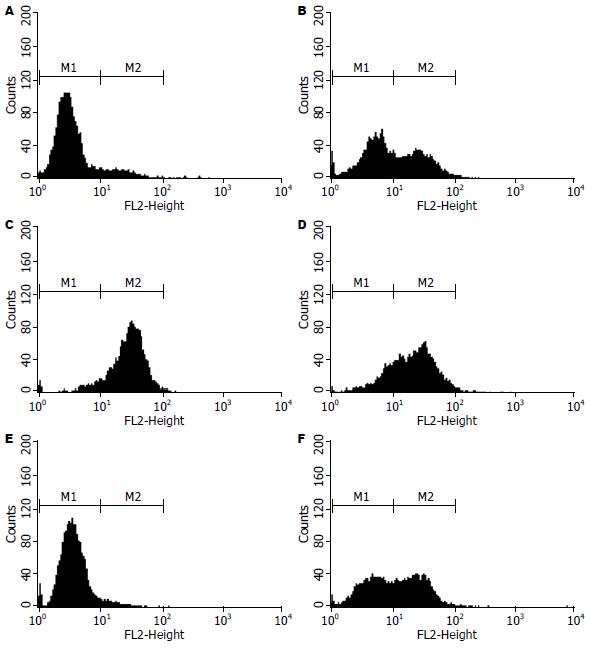
2×106/mL NOMO1细胞用20 μg/L PMA进行6 h的预处理或不处理后, 分别用5×107/mL H. pylori或100 mg/L H. pylori-HSP60进行过夜培养. 细胞表面DEC205表达通过流式细胞术进行分析(图3). 数据显示没有被PMA分化的NOMO1细胞在没有任何刺激下, 几乎没有DEC205的表达(图3A), 经H. pylori刺激后, DEC205的表达由刺激前的7.84%增长至刺激后的88.1%(图3C), 但H. pylori-HSP60的刺激没有引起DEC205表达的变化(图3E), 此结果与图1一致. 当NOMO1细胞被PMA分化后, 经H. pylori或H. pylori-HSP60刺激的DEC205表达由43.77%(图3B)分别增至74.73%(图3D)和51.31%(图3F), 此结果与图2一致. 这些结果表明了巨噬样NOMO1细胞DEC205的表达与细菌刺激有关.
H. pylori的慢性感染是慢性活动性胃十二指肠炎、胃十二指肠溃疡、胃MALT淋巴瘤以及胃癌发生发展的重要致病因子. 其中, MALT淋巴瘤的患者, 经除菌治疗后, 60%-70%的患者的淋巴瘤消失, 考虑是由于H. pylori感染刺激后引起胃淋巴组织增生. H. pylori作为非细胞侵入性细菌, 却能够引起胃的各种病变, 是因为此菌表面能够产生鞭毛、尿素酶、热休克蛋白、空泡毒素(VacA)和细胞毒素(CagA)等病原因子, 这些因素突破了胃壁的天然保护屏障, 构成了H. pylori感染的病理变化. 其中热休克蛋白作为受到外界不良刺激时被释放出来的应激蛋白, 已经被报道与原始适应性免疫系统有着紧密地联系, 能够诱导细胞产生炎性因子等物质来帮助宿主抵御外界刺激和损伤[9-10], 其功能与作用正被国内外学者所认知和密切关注.
甘露糖受体(MR)家族广泛地分布于巨噬细胞或树枝状细胞表面. MR与白色念珠菌、卡氏肺囊虫、结核分枝杆菌、克雷白(氏)杆菌属等的各种微生物结合后表达于巨噬细胞[10-14]. 此次研究, 我们显示了甘露糖受体(MR)家族其中成员之一的DEC205因为H. pylori的感染使之表达于巨噬细胞表面. 表明DEC205表达阳性的巨噬细胞可能在H. pylori感染的胃黏膜上也有着重要的免疫作用. DEC205的表达与IL4受体的信号传导相关, 阻断DEC205可以减少IL4从淋巴细胞中的分泌[15]. Yamasaki et al曾报道胃MALT淋巴瘤患者的淋巴细胞中IL4的分泌产物增多, 而胃炎的患者却没有增多, 此外, 胃MALT淋巴瘤中, 外周血单核细胞的DEC205表达明显减少. DEC205可能与胃MALT淋巴瘤中B细胞增殖有关. 另一方面, 在肿瘤的发展中, DEC205与IL4受体紧密相关[16]. 在一些病例中, DEC205表达缺失与乳腺和直肠浸润性癌有关[17]. 此次研究我们只调查了H. pylori与巨噬细胞的关系. 我们将会在今后的工作中进一步调查胃炎患者胃黏膜活检中DEC205的表达. 免疫系统如何认识胃中H. pylori早期感染以及其对菌体的反应, 目前还不是很清楚. 因为胃MALT淋巴瘤并不真正存在于胃中, 通常肠内淋巴组织免疫反应发生于回肠末端的肠道集合淋巴结内[18]. 目前的研究表明DEC205表达于单核/巨噬细胞. 因此, DEC205通过胞吞作用引起的抗原提呈效应和T细胞特殊免疫反应也可能占据于胃黏膜. DEC205在免疫反应或癌症的发生发展中具有许多功能. 我们认为目前探讨DEC205在胃炎中的角色只是第一步, 在今后的研究中我们还将继续探讨更深更广的H. pylori病理过程.
H. pylori感染的胃组织可通过淋巴细胞和巨噬细胞的大量浸润进行免疫调节. 表达于树突状细胞的DEC205是一种完整的膜糖蛋白, 与抗原摄取、处理和提呈相关, 能够诱导抗原特异性T细胞免疫. H. pylori感染与DEC205的关系目前尚不清楚.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
Yamasaki et al曾报道H. pylori-HSP60刺激外周血单核细胞后,胃炎患者的DEC205 mRNA表达明显增高.
本研究利用WB、实时PCR和FACS技术, 分别从蛋白水平、RNA水平及细胞表面抗原表达量来分析.H. pylori刺激细胞后DEC205的变化, 揭示H. pylori的致病机制, 国内外尚未见相关报道.
本研究通过探讨胃疾病重要致病因子H. pylori与甘露糖受体家族成员之一的DEC205的关系, 揭示H. pylori感染所致胃炎中DEC205扮演的免疫调节角色,为临床治疗提供新的靶点.
本文观察H. pylori感染的巨噬细胞中DEC205表达, 对阐明H. pylori免疫致病机制有重要理论指导意义.
编辑: 李军亮 电编:何基才
| 1. | Harris PR, Smythies LE, Smith PD, Dubois A. Inflammatory cytokine mRNA expression during early and persistent Helicobacter pylori infection in nonhuman primates. J Infect Dis. 2000;181:783-786. [PubMed] [DOI] |
| 2. | Suzuki T, Kato K, Ohara S, Noguchi K, Sekine H, Nagura H, Shimosegawa T. Localization of antigen-presenting cells in Helicobacter pylori-infected gastric mucosa. Pathol Int. 2002;52:265-271. [PubMed] [DOI] |
| 3. | East L, Isacke CM. The mannose receptor family. Biochim Biophys Acta. 2002;1572:364-386. [PubMed] |
| 4. | Heath WR, Belz GT, Behrens GM, Smith CM, Forehan SP, Parish IA, Davey GM, Wilson NS, Carbone FR, Villadangos JA. Cross-presentation, dendritic cell subsets, and the generation of immunity to cellular antigens. Immunol Rev. 2004;199:9-26. [PubMed] [DOI] |
| 5. | Shimizu K, Fujii S. An adjuvant role of in situ dendritic cells (DCs) in linking innate and adaptive immunity. Front Biosci. 2008;13:6193-6201. [PubMed] [DOI] |
| 6. | Yamasaki R, Yokota K, Okada H, Hayashi S, Mizuno M, Yoshino T, Hirai Y, Saitou D, Akagi T, Oguma K. Immune response in Helicobacter pylori-induced low-grade gastric-mucosa-associated lymphoid tissue (MALT) lymphoma. J Med Microbiol. 2004;53:21-29. [PubMed] [DOI] |
| 7. | Yokota K, Ayada K, Son-NanLin , Oguma K, Takenaka R. [Mechanisms of inflammation induced by H. pylori-HSP60]. Nippon Rinsho. 2005;63 Suppl 11:75-79. [PubMed] |
| 8. | Yunoki N, Yokota K, Mizuno M, Kawahara Y, Adachi M, Okada H, Hayashi S, Hirai Y, Oguma K, Tsuji T. Antibody to heat shock protein can be used for early serological monitoring of Helicobacter pylori eradication treatment. Clin Diagn Lab Immunol. 2000;7:574-577. [PubMed] |
| 9. | Takenaka R, Yokota K, Ayada K, Mizuno M, Zhao Y, Fujinami Y, Lin SN, Toyokawa T, Okada H, Shiratori Y. Helicobacter pylori heat-shock protein 60 induces inflammatory responses through the Toll-like receptor-triggered pathway in cultured human gastric epithelial cells. Microbiology. 2004;150:3913-3922. [PubMed] [DOI] |
| 10. | Zhao Y, Yokota K, Ayada K, Yamamoto Y, Okada T, Shen L, Oguma K. Helicobacter pylori heat-shock protein 60 induces interleukin-8 via a Toll-like receptor (TLR)2 and mitogen-activated protein (MAP) kinase pathway in human monocytes. J Med Microbiol. 2007;56:154-164. [PubMed] [DOI] |
| 11. | van de Veerdonk FL, Marijnissen RJ, Kullberg BJ, Koenen HJ, Cheng SC, Joosten I, van den Berg WB, Williams DL, van der Meer JW, Joosten LA. The macrophage mannose receptor induces IL-17 in response to Candida albicans. Cell Host Microbe. 2009;5:329-340. [PubMed] [DOI] |
| 12. | Swain SD, Lee SJ, Nussenzweig MC, Harmsen AG. Absence of the macrophage mannose receptor in mice does not increase susceptibility to Pneumocystis carinii infection in vivo. Infect Immun. 2003;71:6213-6221. [PubMed] [DOI] |
| 13. | Torrelles JB, Azad AK, Henning LN, Carlson TK, Schlesinger LS. Role of C-type lectins in mycobacterial infections. Curr Drug Targets. 2008;9:102-112. [PubMed] [DOI] |
| 14. | Barton E, Flanagan P, Hill S. Spinal infection caused by ESBL-producing Klebsiella pneumoniae treated with temocillin. J Infect. 2008;57:347-349. [PubMed] [DOI] |
| 15. | McKay PF, Imami N, Johns M, Taylor-Fishwick DA, Sedibane LM, Totty NF, Hsuan JJ, Palmer DB, George AJ, Foxwell BM. The gp200-MR6 molecule which is functionally associated with the IL-4 receptor modulates B cell phenotype and is a novel member of the human macrophage mannose receptor family. Eur J Immunol. 1998;28:4071-4083. [PubMed] [DOI] |
| 16. | Al-Tubuly AA, Spijker R, Pignatelli M, Kirkland SC, Ritter MA. Inhibition of growth and enhancement of differentiation of colorectal carcinoma cell lines by MAb MR6 and IL-4. Int J Cancer. 1997;71:605-611. [PubMed] [DOI] |
| 17. | Tungekar MF, Gatter KC, Ritter MA. Bladder carcinomas and normal urothelium universally express gp200-MR6, a molecule functionally associated with the interleukin 4 receptor (CD 124). Br J Cancer. 1996;73:429-432. [PubMed] |